
Кислоты
900igr.net

Сложные вещества, молекулы которых состоят из атомов водорода Н и кислотных остатков

кислоты
Жидкие
HCI, H 2 SO 4 , HNO 3
Твердые
H 3 PO 4 , H 2 SiO 3
Растворимые
в воде
Нерастворимые
в воде
H 2 SiO 3
H 2 CO 3 , H 2 SO 3 в свободном виде не существуют

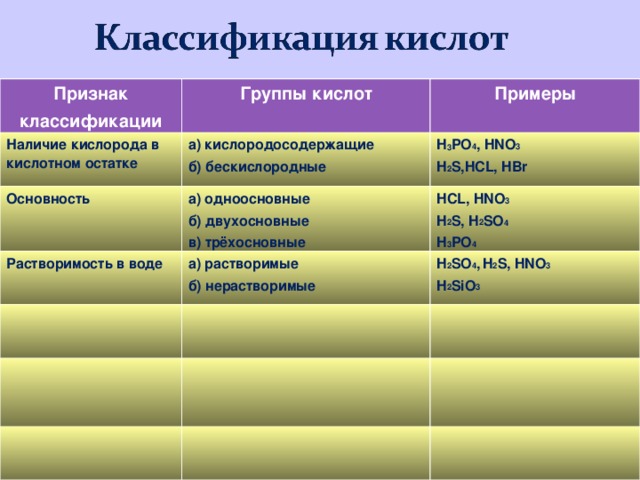
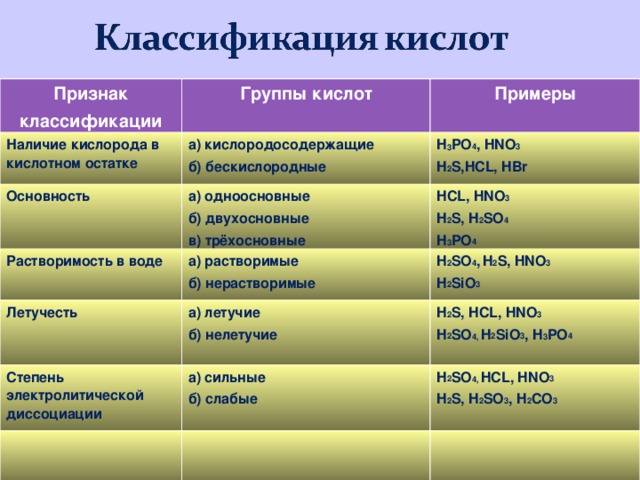
Признак
классификации
Группы кислот
Примеры

Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr

Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
Основность
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr
а) одноосновные
б) двухосновные
в) трёхосновные
HCL, HNO 3
H 2 S, H 2 SO 4
H 3 PO 4
Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
Основность
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr
а) одноосновные
б) двухосновные
в) трёхосновные
Растворимость в воде
HCL, HNO 3
H 2 S, H 2 SO 4
H 3 PO 4
а) растворимые
б) нерастворимые
H 2 SO 4 , H 2 S, HNO 3
H 2 SiO 3

Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
Основность
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr
а) одноосновные
б) двухосновные
в) трёхосновные
Растворимость в воде
HCL, HNO 3
H 2 S, H 2 SO 4
H 3 PO 4
а) растворимые
б) нерастворимые
Летучесть
H 2 SO 4 , H 2 S, HNO 3
H 2 SiO 3
а) летучие
б) нелетучие
H 2 S, HCL, HNO 3
H 2 SO 4, H 2 SiO 3 , H 3 PO 4
Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
Основность
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr
а) одноосновные
б) двухосновные
в) трёхосновные
Растворимость в воде
Летучесть
HCL, HNO 3
H 2 S, H 2 SO 4
H 3 PO 4
а) растворимые
б) нерастворимые
H 2 SO 4 , H 2 S, HNO 3
H 2 SiO 3
а) летучие
б) нелетучие
Степень электролитической диссоциации
H 2 S, HCL, HNO 3
H 2 SO 4, H 2 SiO 3 , H 3 PO 4
а) сильные
б) слабые
H 2 SO 4, HCL, HNO 3
H 2 S, H 2 SO 3 , H 2 CO 3

Признак
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Примеры
а) кислородосодержащие
б) бескислородные
Основность
H 3 PO 4 , HNO 3
H 2 S,HCL, HBr
а) одноосновные
б) двухосновные
в) трёхосновные
Растворимость в воде
Летучесть
а) растворимые
б) нерастворимые
HCL, HNO 3
H 2 S, H 2 SO 4
H 3 PO 4
H 2 SO 4 , H 2 S, HNO 3
H 2 SiO 3
а) летучие
б) нелетучие
Степень электролитической диссоциации
H 2 S, HCL, HNO 3
H 2 SO 4, H 2 SiO 3 , H 3 PO 4
а) сильные
б) слабые
Стабильность
H 2 SO 4, HCL, HNO 3
H 2 S, H 2 SO 3 , H 2 CO 3
а) стабильные
б) нестабильные
H 2 SO 4, H 3 PO 4, HCL
H 2 SO 3, H 2 CO 3, H 2 SiO 3

- HCl - хлороводородная (соляная) кислота
- HNO 3 - азотная кислота
- HNO 2 - азотистая кислота
- H 2 SO 3 - сернистая кислота
- H 2 SO 4 - серная кислота
- H 2 S - сероводородная
- H 2 CO 3 - угольная кислота
- H 2 SiO 3 – кремниевая кислота
- H 3 PO 4 - фосфорная кислота




Самой первой кислотой, которую научился получать и использовать человек, была уксусная

Муравей при укусе впрыскивает в ранку яд, содержащий изрядное количество муравьиной кислоты

Современным ботаникам известно более 800 видов растений вырабатывающих синильную кислоту и использующих её как оружие межвидовой борьбы.
HCN

Запах молочной кислоты улавливают кровососущие насекомые и кусают людей

В продуктах обмена веществ у человека обнаруживаются молочная, лимонная, яблочная, янтарная, уксусная и многие другие кислоты

- Работать в перчатках
- При попадании кислоты на кожу промыть проточной водой
- Обработать 5% раствором питьевой соды
- При разбавлении концентрированной серной кислоты сначала наливают воду, затем- кислоту.

Лакмус
Фенол-
фталеин
Метиловый
оранжевый


 Получите свидетельство
Получите свидетельство Вход
Вход
































 Презентация по химии на тему "Кислоты" (2.95 MB)
Презентация по химии на тему "Кислоты" (2.95 MB)
 0
0 774
774 40
40 Нравится
0
Нравится
0








