
Алкадиены

Содержание
- Диеновые углеводороды
- Классификация по положению двойных связей
- Получение
- Физические свойства
- Химические свойства (гидрирование, галогенирование, гидрогалогенирование, полимеризация)
- Натуральный каучук
- Получение резины
- Синтетические каучуки (бутадиеновый , изопреновый, СКС, СКН, наирит)
- Источники информации

Диеновые углеводороды
Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи.
Общая формула алкадиенов C n H 2 n -2 . По международной номенклатуре алкадиены называют так же , как и алкены, но только вместо окончания –ен здесь употребляется –диен .

Классификация по положению двойных связей
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1) углеводороды с кумулированными двойными связями, т.е. примыкающими к одному атому углерода. Например, пропадиен или аллен CH 2 = C = CH 2 ; 2) углеводороды с изолированными двойными связями, т.е. разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH 2 = CH – CH 2 – CH = CH 2 ;

3) углеводороды с сопряженными двойными связями, т.е. разделенными одной простой связью.
Например, бутадиен -1,3 или дивинил CH 2 = CH – CH = CH 2 ,
2-метилбутадиен -1,3 или изопрен CH 2 =С( CH 3 )– CH = CH 2 Наибольший интерес представляют углеводороды с сопряженными двойными связями.

Получение
Углеводороды с сопряженными двойными связями получают: 1) дегидрированием алканов , содержащихся в природном газе и газах нефтепереработки (бутан-бутиленовой фракции – Бызов итальянец), при пропускании их над нагретым катализатором
600 º С
CH 3 – CH 2 – CH 2 – CH 3 → CH 2 = CH – CH = CH 2 + 2 H 2
Cr 2 O 3 , Al 2 O 3

600 º С
CH 3 –CH(CH 3 )–CH 2 –CH 3 →
Cr2O3,Al2O3
CH 2 =C(CH 3 )-CH=CH 2 + 2H 2
2) дегидрированием и дегидратацией этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод академика С.В.Лебедева)
450 º С; ZnO , Al 2 O 3
2 CH 3 CH 2 OH → CH 2 = CH – CH = CH 2 + 2 H 2 O + H 2 3) дегидратация гликолей
CH 3 -CHOH-CH 2 –CH 2 OH → CH 2 =CH–CH=CH 2 +
( дивинил )
+ 2H 2 O

Физические свойства
Бутадиен -1,3 ( дивинил )– легко сжижающийся газ с неприятным запахом, t пл .= -108,9 º C , t кип .= -4,5 º C ; растворяется в эфире, бензоле, не растворяется в воде. 2- Метилбутадиен -1,3 ( изопрен )– летучая жидкость, t пл .= -146 º C , t кип .= 34, 1 º C ; растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.

Химические свойства
1) Гидрирование kat
CH 2 = CH-CH=CH 2 + H 2 → CH 3 – С H=CH-CH 3
2) Галогенирование
CH 2 = CH-CH=CH 2 + Br 2 → CH 2 Br– С H=CH - CH 2 Br
3 ) Гидрогалогенировани e
CH 2 = CH-CH=CH 2 + HCl → CH 3 – С H=CH-CH 2 Cl Запомните!

4 ) Полимеризация
Важной особенностью диеновых углеводородов с сопряженными связями является способность их полимеризоваться в каучукоподобные продукты.
В упрощенном виде реакцию полимеризации бутадиена -1,3 по схеме 1,4 присоединения можно представить следующим образом:
→
kat
nCH 2 =CH-CH=CH 2 → (- CH 2 - CH=CH-CH 2 -) n
t

Запомните!
В диенах, в которых двойные связи разделены одной простой, присоединение преимущественно идет в положения 1 и 4.

Натуральный каучук
Натуральный каучук получают из
млечного сока ( латекса ) каучуконосного дерева гевеи, растущего в тропических лесах Бразилии.
При нагревании без доступа воздуха каучук распадается с образованием диенового углеводорода – 2- метилбутадиена-1,3 или изопрена.
Каучук – это стереорегулярный полимер, в котором молекулы изопрена соединены друг с другом по схеме 1,4- присоединения с цис - конфигурацией полимерной цепи.
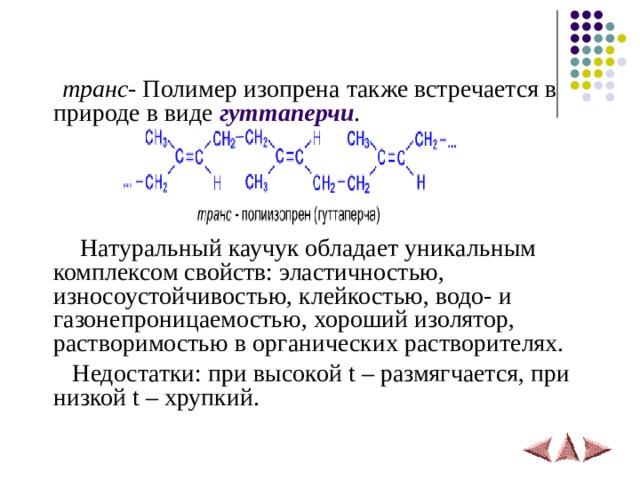
транс - Полимер изопрена также встречается в природе в виде гуттаперчи .
Натуральный каучук обладает уникальным комплексом свойств: эластичностью, износоустойчивостью, клейкостью, водо- и газонепроницаемостью, хороший изолятор, растворимостью в органических растворителях.
Недостатки: при высокой t – размягчается, при низкой t – хрупкий.

Получение резины
Для придания каучуку необходимых
физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140 ° С с серой.
Атомы серы присоединяются по месту разрыва некоторых двойных связей и линейные молекулы каучука "сшиваются" в более крупные трехмерные молекулы – получается резина , которая по прочности значительно превосходит невулканизированный каучук. Наполненные активной сажей каучуки в виде резин используют для изготовления автомобильных шин и других резиновых изделий.

Резина обладает большой эластичностью, прочностью, устойчива к действию растворителей.

Синтетические каучуки
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта.
Na, t
СКД nCH 2 =CH-CH=CH 2 → (-CH 2 -CH=CH-CH 2 -) n
C 2 H 5 OH →
бутилен → бутадиен → СКД
бутан →
Свойства: водо- и газонепроницаемость, уступает по эластичности и износостойкости.

И лишь в пятидесятые годы отечественные ученые осуществили каталитическую стереополимеризацию диеновых углеводородов и получили стереорегулярный каучук, близкий по свойствам к натуральному каучуку.
СКИ изопреновый (цис-изомер) стереорегулярного строения
CH 3 CH 3
| |
n CH 2 =C – CH=CH 2 → (- CH 2 – C = CH – CH 2 -)
пентан → изопентан → изопрен → СКИ
Природный каучук – тот же состав.

Широко применяются сополимерные каучуки – продукты совместной полимеризации (сополимеризации) бутадиена с другими непредельными соединениями.
Каучук полученный из бутадиена-1,3 (80% по массе) и стирола CH 2 =CH–C 6 H 5 (20% по массе) ( СКС ), широко используют при производстве автомобильных шин и резиновых изделий.
Если вместо стирола используют акрилонитрил CH2=CH-CN ( СКН ), то полученный продукт приобретает устойчивость к растворяющему действию бензина и масла.
СК на основе хлоропрена (2-хлорбутадиен-1,3) носит название наирита и обладает стойкостью к атмосферным воздействиям, к различным маслам.

Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.

5. Оганесян Э.Т. Руководство по химии
поступающим в вузы. Справочное пособие. – М.:
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.

9. Штремплер Г.И. Тесты, вопросы и ответы
по химии: Книга для учащихя 8-11 классов общеобразовательных учреждений. – М.: Просвещение, 1999.
10. Малыхин З.В. Тестовые задания для проверки знаний учащихся по органической химии. – М.: ТЦ «Сфера», 2001.
11. Городничева И.Н. Контрольные и проверочные работы по химии. 8-11 класс. – М.: Аквариум, 1997.
12. Гаврусейко Н.П. Проверочные работы по органической химии: Дидактический материал: Пособие для учителя. – М.: Просвещение, 1991.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация по теме: Алкадиены (229 KB)
Презентация по теме: Алкадиены (229 KB)
 0
0 1834
1834 294
294 Нравится
0
Нравится
0









