План урока
Тема: «Путешествие в мир кислот»
Тип урока: комбинированный урок.
Цель: познакомить учащихся с составом, классификацией и представителями кислот. Продолжить обучение учащихся работе с лабораторным оборудованием; сформировать умения экспериментировать, наблюдать, анализировать опыты, делать выводы; на новых примерах подтвердить зависимость свойств веществ от состава и строения; показать связь между свойствами веществ, их получением и применением; обратить внимание учащихся на правила работы в химическом кабинете.
Задачи:
Образовательная: добиться понимания использования кислот в жизни, в технике, в быту.
Воспитательная: формирование естественно- научного мировоззрения, бережного отношения к природе.
Развивающая: развитие речи, мышления, наблюдательности, активности, самостоятельности.
Методическая: использование ИКТ на уроках химии.
Методы и методические приемы: 1) словесный, наглядный, практический; 2) частично- поисковый.
Оборудование:
На демонстрационном столе: концентрированная серная кислота, колба, капельная воронка, индикаторы, вода, чашки Петри, лист бумаги, кусочек ткани, стеклянная палочка, растворы азотной, фосфорной, соляной кислот.
На столах учащихся: индикаторы, пробирки, концентрированные серная и соляная кислоты, штатив, стеклянная палочка, лучинка.
Межпредметные связи: биология (пищеварение), литература, история, математика (действия над числами, уравнения).
Использованная литература:
А. С. Егоров «Современный курс для подготовки к ЕГЭ» Ростов – на - Дону «Феникс» 2012;
Репетитор по химии под редакцией А.С. Егорова, Ростов – на - Дону «Феникс» 2011;
Доктор химических наук А. П. Пурмаль «Сколько кислоты в капле дождя?»;
С.В. Бочарова « Химия 11 класс» Поурочные планы по учебнику О. С. Габриеляна. Волгоград 2004;
О. С. Габриелян, Н. П. Воскобойникова, А. В. Яшукова « Настольная книга учителя химии» 8 класс «Дрофа» Москва 2002
Структура урока
Урок проводится как путешествие по миру кислот. Это путешествие совершается по следующему маршруту: ( слайд 3)
Ученики становятся пассажирами поезда, учитель – проводник этого поезда. Один ученик – помощник проводника, он работает вместе с учителем и указывает маршрут следования. На каждом пункте путешествия идет своя работа по отработке триединой дидактической цели: знания – умения – навыки.
Организационный момент: проверка обучающихся по списку.
Подготовка к восприятию нового материала:
Учитель. Какие классы неорганических веществ вы знаете?
Учащийся. Оксиды, основания, кислоты, соли.
Учитель. Что такое кислоты?
Изучение нового материала:
1. Показ презентации на тему: «Путешествие в мир кислот».
Учитель. Любой человек, невзирая на возраст, любит путешествовать! Вот и вас я приглашаю совершить путешествие в мир кислот. Давайте представим, что мы сели в поезд. Вы – пассажиры, я – проводник, и еще у нас будет помощник проводника – мой помощник. Он будет указывать маршрут нашего следования. А наши тетради сегодня пусть превратятся в путевой дневник. Начнем с путевых дневников.
Учитель просит записать в путевом дневнике: «Путешествие в мир кислот. Этапы путешествия».
Учитель. Мы находимся на станции Информационная. (Слайд 4)Прежде чем отправиться в путь, нам необходимо подготовиться к путешествию, получить информацию о веществах, которые будут нас окружать. Здесь мы познакомимся с многообразием веществ, относящихся к классу кислот. Приготовьтесь внимательно слушать и записывать.
Учитель делает необходимые записи на доске под табличкой «Станция Информационная». Аналогичные записи ученики делают в тетрадях.
Учитель. Посмотрите на таблицу. Обратите внимание на состав кислот, в них обязательно входит водород – он определяет основность. Вся остальная часть молекулы называется кислотным остатком. Следовательно, мы можем дать определение классу кислот.
Учащийся. Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка.
2. Раздача дидактического материала «Типы кислот» для использования при подготовке к ЕГЭ.
Учитель. Состав кислотных остатков различен: в одни входит кислород, в другие нет. Классифицируем кислоты по двум признакам:
по числу атомов водорода: а) одноосновные,
б) двухосновные,
в) трехосновные;
2) по наличию кислорода в кислотном остатке:
а) кислородные,
б) бескислородные ( слайд 5)
Помощник проводника. Мы прибываем на станцию Историческая (слайд 6 )
Входит ученик- историк. На нем старинная накидка, в руках свиток и гусиное перо. Он заранее подготовил материал об истории открытия уксусной, серной и азотной кислот и характеризует области их применения.
Историк. Уксусная кислота ( «Древесная кислота») – около 3 тыс. лет.
Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Почему уксусная кислота оказалась первой, понять нетрудно. С древнейших времен люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его, видимо, выливали, потом научились использовать как лекарство, приправу к пище, как растворитель красок. В России уксус, т.е. водный раствор уксусной кислоты, называли «кислая влажность» или «древесная кислота».
СН3СООН используют:
- при крашении;
- в кожевенном производстве;
- в лакокрасочной промышленности;
- основной компонент винного уксуса.
На основе СН3СООН получают вещества для борьбы с сорняками – гербициды.
Серная кислота (X веке) – Н2SО4
С серной кислотой люди познакомились значительно позднее, примерно в X веке. Честь ее открытия приписывается первому химику Абубекеру аль Рези. Серную кислоту выделили из купоросов, например из железного купороса, и соответственно назвали купоросным маслом. Именно под таким названием серная кислота была известна в России.
Препараты, содержащие FеSО4, используют при лечении малокровия (железодефицитной анемии). ВаSО4 – используется для рентгеновской диагностики заболеваний желудочно – кишечного тракта. Заполняя пищевод, желудок и кишечник «баритовая каша» ( смесь ВаSО4 с Н2О ), непрозрачная для рентгеновских лучей, проявляет контуры органов пищеварения, что позволяет ставить диагноз их заболеваний.
Соляная и азотная кислоты были выделены и определены химиками примерно в XV веке.
Соляную кислоту называли соляным спиртом, а азотную кислоту – селитряной водкой. Получали эти кислоты с помощью серной кислоты, которую потом поэтично стали называть «матерью всех кислот».
НCI играет важную физиологическую роль, т. к. способствует перевариванию пищи и убивает различные патогенные микроорганизмы (Рн желудочного сока = 1-2).
NаCI – поваренная ( каменная ) соль и как вкусовая приправа, и как исходное сырье для получения NаОН и других веществ.
Применяют НNО3 для азотных удобрений, лекарственных и взрывчатых веществ.
В медицинской практике используют ряд соединений азота:
1. 10% водный раствор NН3 (нашатырный спирт);
2. оксид азота (I) N2О ( «веселящий газ» ), в смеси с кислородом является средством для наркоза;
3. NaNО2 – как сосудорасширяющее средство.
4. AgNО3 ( ляпис ) – вяжущее бактерицидное средство.
Угольная кислота (XVIII веке)- Н2СО3
Угольную кислоту получили впервые в конце XVIII веке Джозеф Пристли, английский химик, он же священник. Для этого он растворял в воде углекислый газ. Раствор углекислого газа в воде назвали содовой водой, а так как она получила широкое применение как напиток, за это открытие Д. Пристли наградили золотой медалью.
Соли угольной кислоты имеют большое практическое значение:
мрамор используется в строительстве, архитектуре, скульптуре;
мел в строительстве,
кальцинированная сода в быту для стирки;
пищевая сода для выпечки, в медицине;
Учащиеся отмечают, что общее в составе кислот – наличие атомов водорода.
Учитель подводит их к выводу о том, что общее в составе и строении кислот обусловливает и общие свойства кислот.
Именно это предстоит выяснить на следующей остановке – Дегустационной. (слайд 7)
Учитель. В химическом кабинете ничего нельзя пробовать на вкус. Это – грубейшее нарушение техники безопасности. Но сегодня разрешаю вам определить вкус таблетки аскорбиновой кислоты или кристалликов лимонной, которые лежат перед каждым на тарелочке.
Учащиеся записывают первый вывод урока: большинство кислот кислые на вкус.
Я расскажу вам о пользе кислот,
Может, не знает о них наш народ.
Если ты проглотил аскорбинку,
Твой организм получил витаминку.
Она закрывает болезням врата –
Аскорбиновая кислота
Вы простудились – болит голова,
Вас аспирин выручает всегда.
Ну и, бесспорно, полезен лимон,
Кислотою лимонной наполнен он
Жуйте лимон, если горло болит,
Сок чудотворный вас исцелит.
Яблоко ешь — кислый вкус, красота,
В яблоке – яблочная кислота.
Яблочный уксус по ложке пейте,
Вы обязательно похудеете.
Уксус столовый на кухне хранится –
Для консервации он пригодится.
Учитель. Мы продолжаем свое путешествие.
Помощник проводника. У нас на пути красный свет - проезда нет! Станция «Стоп! Красный свет!». (слайд 8)
Учитель проводит демонстрационный опыт растворения в воде концентрированной серной (соляной) кислоты. Сильное разогревание содержимого сосуда учащиеся наблюдают с помощью градусника.
Фиксируется внимание учащихся на том, что в связи с выделением большого количества теплоты при растворении концентрированной серы (соляной) кислоты в воде нельзя вливать воду в кислоту. В этом случае вода, имеющая меньшую плотность, окажется на поверхности, закипит и её брызги вместе с кислотой могут обжечь руки и лицо. Учащиеся должны запомнить: кислоту надо приливать к воде, а не наоборот. В случае попадания кислоты на кожу следует промыть её водой и 5% раствором соды.
Полезно знать:
нерастворимая — кремниевая (H2SiO3);
нестойкие — угольная (Н2СОз = H2O + CO2) и сернистая (Н2SОз = Н2О + SO2);
летучие — сероводородная (H2S), а также НСl, HBr, HI, НNОз — но только в отсутствии воды и при нагревании.
Станция экспериментальная. (слайд 11)
Учитель обращает внимание учащихся на то, что на ряду с общими свойствами кислот - вкусом, они отличаются друг от друга по ряду признаков. Проводится сравнение свойств серной и соляной кислот.
В презентации и в путевых дневниках учащихся написаны свойства кислот:
* Металл + кислота = соль + водород
Пример: С какими из перечисленных веществ вступает в реакцию НCI (соляная) кислота: Na2О, Ag, SO3, Zn? Составьте уравнения возможных реакций.
Определяем принадлежность заданных условий веществ к соответствующим классам и тут же проверяем, реагируют ли они с кислотами. Получается:
Na2О — основный оксид — реагирует (получается соль и вода);
Ag — металл, находящийся в ряду активности после водорода, — не реагирует;
SOз — кислотный оксид — не реагирует;
Zn — металл, находящийся в ряду активности до водорода, — реагирует (получается соль и водород).
2. Чтобы составить уравнения реакций, определим валентность металлов (натрий — I, цинк — II) и составим формулы солей учитывая, что валентность кислотного остатка Сl составляет I. Осталось записать уравнения реакций:
Na2О+2НСl=2NaCl+Н2О;
Zn + 2НСl= ZnCl2 + H2.
*Кислота + МеО = соль+вода
2НСl+CaO=CaCl2 +H2 O
*кислота+Me(OH)y = соль+вода
HCl+NaOH=NaCl+H2O- реакция нейтрализации
Запомните: При составлении уравнений реакций не забывать, что водород выделяется в виде двухатомных молекул Н2
2AI+6HCI=2AICI3+3H2
кислоты не реагируют с медью
Задание №1 (слайд 12)
Кусочек природного мела СаСО3
смочите каплей соляной кислоты НСl. Что вы наблюдаете?
Составьте уравнение реакции.
СаСО3 + 2НСI = СаСI2 + Н2О + СО2
Задание №2
Проделайте качественную реакцию для солей угольной кислоты.
Для этого:
1. Налейте в пробирку 2 мл раствора K2CO3.
2. Добавьте по каплям HCl.
3. Что наблюдаете?
4. Составьте уравнения реакций в ионном виде.
К2СО3 + 2НCI= 2КCI+ Н2О+СО2
2К+ + СО32- + 2Н+ + 2СI- = 2К+ + 2СI -- + Н2О + СО2
СО32- + 2Н+ = Н2О + СО2
Вывод:
соли угольной кислоты легко можно определить при помощи сильных кислот. Являясь одной из самых слабых кислот, она легко вытесняется из солей более сильными кислотами.
Помощник проводника. Мы прибываем на станцию – Индикаторная. (слайд 13)
Учитель. Постепенно химики научились распознавать кислоты. Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты случайно пролил её. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провёл серию опытов с разными кислотами и цветками разных растений. Оказалось, что и васильки, и розы, и цветки некоторых других растений изменяли свою окраску при действии кислот. Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворе кислот он становился красным. После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот.
Л.О.№1.
(Учащиеся 1 ряда исследуют действие на индикаторы раствора HCl, 2 ряда -раствора H2SO4, 3 ряда -раствора HNO3. Результаты исследования обсуждаем и записываем в таблицу)
Загадка.
Попасть в кислоту – есть ли горше удача?
Но он перетерпит без вздохов, без плача.
Зато в щелочах у …………….
Начнется не жизнь, а сплошная малина.
(Фенолфталеин.)
|
| Фиолетовый лакмус | Метиловый оранжевый | Фенол-фталеин (бесцвет-ный) |
| HCl | Красный | Красный | Бесцвет-ный
|
| H2SO4 | Красный | Красный
| Бесцвет-ный
|
| HNO3 | Красный
| Красный
| Бесцвет-ный
|
Хочу все знать!(слайд 14)
Кусочек природного мела СаСО3 смочите каплей соляной кислоты НСl (можно взять аптечную кислоту). Там, куда упала капля, заметно энергичное вскипание. Внесите кусочек мела с "кипящей" каплей в пламя свечи или сухого спирта. Пламя окрасится в красивый красный цвет.
Это явление известное: кальций, входящий в состав мела, делает пламя красным. Но зачем кислота? Она, реагируя с мелом, образует растворимый хлорид кальция CaCl2, его брызги уносятся газами и попадают непосредственно в пламя - от этого опыт становится эффектнее.
К сожалению, такой опыт с прессованным школьным мелом не удается - в нем есть примесь соды (соли натрия), и пламя окрашивается в оранжевый цвет. Лучше всего опыт получается с кусочком белого мрамора, смоченного той же кислотой.
А убедиться в том, что соли натрия окрашивают пламя в интенсивный желтый цвет, вы сможете, внеся в пламя крупинку соли NaCl (или просто слегка "посолив" огонь).
| Индикатор | Исход-ный цвет | Цвет в кислой среде | Цвет в щелоч-ной среде |
| виноградный сок | темно-красный | красный | зеленый |
| синий ирис | ярко-синий | красный | зелено-голубой |
Химический кроссворд (слайд 15)

По горизонтали: 1. Вещества, в состав которых входит кислотный остаток. 3. Вещества, которые образуются при взаимодействии кислот с основаниями. 5. Вещество, состоящее из атомов водорода и кислорода. 6. Класс неорганических веществ. 8. Элемент, входящий в состав воды. 9. Газ, входящий в состав воздуха в самом большом количестве.
По вертикали: 1. Газ, поддерживающий горение. 2. Соединения, состоящие из двух элементов, один из которых кислород. 4. Вещества, изменяющие цвет под действием кислот и щелочей.
7. Название реакции между кислотой и щелочью. 8. Смесь газов, в состав которой входят кислород, азот и некоторые другие.
Ответы на химический кроссворд
По горизонтали: 1. Кислоты. 3. Соли. 5. Вода. 6. Основания.
8. Водород. 9. Азот.
По вертикали: 1. Кислород. 2. Оксиды. 4. Индикаторы.
7. Нейтрализация. 8. Воздух.
Закрепление полученных знаний:
(слайд 16)
Заполнение путевого дневника.
Презентация, подготовленная учащимися по теме: «Кислотные дожди».
Задание №1. Напишите уравнения реакций, позволяющих осуществить превращения по схемам:
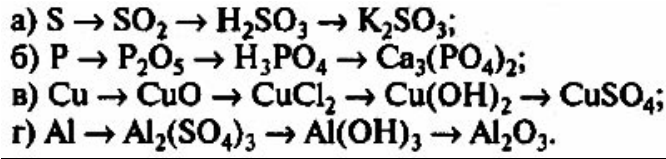
Задание №2. Закончите уравнения реакций и подберите коэффициенты:
а) СаО+НзРО4 — б) Na2О +Н2СОз —
в) Fе2Оз + H2SО4 — г) ZnO + HNО3 —
Подведение итогов урока:
Учитель. Уважаемые пассажиры, наше путешествие подошло к концу. Спасибо Вам за то, что вы помогли мне осуществить его. И если оно Вам понравилось, ответьте, пожалуйста, на следующие вопросы:
1. Что же такое кислотный дождь?
2. Неужели только человек – виновник кислотного дождя?
3. А может быть человек все-таки виноват в образовании кислотных дождей?
4. Насколько же велика вина человека?
Инструктаж по выполнению домашней работы:
параграф 20, стр. 251 – задание № 4
Опорный конспект
«Путешествие в мир кислот»
| Станция Информационная По содержанию атомов кислорода: Кислородные – HNO3, H2SO4 Бескислородные – H2S, HCI, HJ
| Нn(KO)n. по основности: Одноосновные – HCI, HNO3, HJ Двухосновные – H2SO4, H2SiO3 Трехосновные –H3PO4 |
| «Стой! Красный свет!»
Разрушают кожу, ткани, древесину!
| Осторожно! Нейтрализовать раствором соды, смыть водой! Кислоту надо приливать к воде, а не наоборот!!!
|
| Станция Экспериментальная
| 1.Металл + кислота = соль + водород 2.основный оксид + кислота = соль + вода
3.основание + кислота = соль + вода 4.Кислота + соль = новая кислота + новая соль |
Опорный конспект
«Путешествие в мир кислот»
| Станция Историческая | H2SO4- серная кислота (X в; купоросное масло) НCI- cоляная кислота (XV в.;соляный спирт) HNO3- азотная кислота (XV в.; селитряная водка) H2CO3 – угольная кислота (XVIII в.; содовая вода) |
| Станция Дегустационная Свойства | Кислоты: жидкие, твердые Многие хорошо растворимы в воде Растворы кислот имеют кислый вкус Многие разъедают растительные и животные ткани |
| Станция Индикаторная | Краснею от кислот, как от стыда
Синий лакмус красный |

 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок химии "Путешествие в мир кислот" (0.18 MB)
Урок химии "Путешествие в мир кислот" (0.18 MB)
 0
0 1860
1860 82
82 Нравится
0
Нравится
0


