
Основные соединения серы

Урок
Цели:
- - изучить особенности строение оксидов серы (IV и VI), сероводорода, сернистой и серной кислот;
- - изучить распространения соединений серы в природе, их роль в природе и жизни человека;
- - изучить физические и химические свойства основных соединений серы;
- - изучить медико-биологическое значение соединений серы;
- - узнать о способах получения, применение основных соединений серы;

6 группа «Экспериментаторы»
1. Теоретическая часть:
- Изучите химические свойства серной кислоты.
2. Практическая часть:
- ПЕРЕД ВАМИ 4 ПРОБИРКИ СРАСТВОРОМ СЕРНОЙ КИСЛОТЫ.
- В пробирку №1 пометите 1-2 гранулы цинка и прилейте 1 мл разбавленной серной кислоты. Что наблюдаете. Составьте уравнения реакции.
- В пробирку № 2 добавьте лакмус, что наблюдаете? Зафиксируйте результаты эксперимента. Сделайте вывод.
- В пробирку №3 поместите опилки, что наблюдаете? Зафиксируйте результаты эксперимента. Сделайте вывод.
- В пробирки с раствором соли серной кислоты добавьте раствор нитрата бария, что наблюдаете.
- В пробирку с раствором сульфида натрия добавьте раствор соли серебра. Что наблюдаете, Объясните данное наблюдение

Н 2 S - сероводород
- Гидрид серы
(ковалентная полярная
связь)
Влияние сероводорода на организм:
Сероводород не только скверно пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом количестве быстро наступает паралич дыхательных нервов, и тогда человек перестает ощущать запах – в этом и заключается смертельная опасность сероводорода.
Насчитывается множество случаев отравления вредным газом, когда пострадавшими были рабочие, на ремонте трубопроводов. Этот газ тяжелее, поэтому он накапливается в ямах, колодцах, откуда быстро выбраться не так-то просто.

СЕРОВОДОРОД
бесцв. газ с резким запахом тухлых яиц
Термически неустойчив, плохо растворим в воде. Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения - 60,35 °С, плотность 0,938 г/см3 (-81 °С)
Водный раствор – сероводородная кислота(слабая)
- Получение сероводорода
1. Н 2 + S=H 2 S ↑
2. FeS + 2HCl → FeCl2 + H2S↑

1.Сероводород окисляется- горит синим пламенем:
а.при недостатке O2
2H2S + O2 → 2S + 2H2O
б.при избытке O2
2H2S + 3O2 → 2SO2 + 2H2O
2.Сероводород проявляет восстановительные свойства
а. взаимодействует с бромной и хлорной водой
H2S + Br2 → S + 2HBr
H2S + Сl2 → S + 2HCl
3.Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до металла, а раствор соды удерживает ионы серы.

ХИМИЧЕСКИЕ СВОЙСТВА
1.H2S является очень слабой кислотой:
H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
2.Взаимодействует с основаниями:
H2S + 2NaOH(избыток) → Na2S + 2H2O
H2S (избыток) + NaOH → NaНS + H2O
3.Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:
- 2H2S + SO2 = 2Н2О + 3S

3) H2S проявляет очень сильные восстановительные свойства:
H2S + Br2 → S + 2HBr
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
3H2S + 8HNO3(конц) → 3H2SO4 + 8NO + 4H2O
H2S + H2SO4(конц) → S + SO2 + 2H2O
(при нагревании реакция идет по - иному:
H2S + 3H2SO4(конц) → 4SO2 + 4H2O

- Гидросульфиды
- Сульфиды
NaHS- гидросульфид натрия
Ba(HS) 2 - гидросульфид бария
Na 2 S – сульфид натрия
ZnS – сульфид цинка
PbS - сульфид свинца

SO 2 - серный газ
- SO2 - диоксид серы,
- оксид серы (IV)
(ковалентная полярная
связь)
- Бесцветный газ с резким запахом; хорошо растворим в воде
- (в 1V H2O растворяется 40V SO2 при н.у.);
- t°пл. = -75,5°C; t°кип. = -10°С.

Получение
1) При сжигании серы в кислороде:
S + O2 → SO2
2) Окислением сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
5) 2 SO3 2SO2 +O2 (температура, катализатор)

Химические свойства диоксида серы
- 1. Реакция взаимодействия с кислородом (получение SO 3 )
2SO 2 + O 2 = 2SO 3 (кислотный, бесцветная летучая жидкость). Катализатор платина.
Диоксид серы - восстановитель
- 2. Реакция взаимодействия с углеродом
SO 2 +С =S +СO 2
Диоксид серы — окислитель
3. взаимодействует с водой
SO2 + H2O = H2SO3
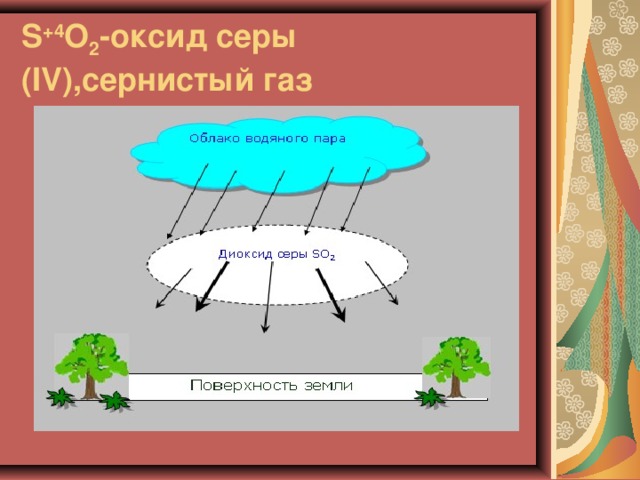
S +4 O 2 - оксид серы ( IV ),сернистый газ

H 2 S +4 О 3 - сернистая кислота
- Существует только в растворе, непрочное соединение
- 40 V S О 2 :1 V Н 2 О
- S О 2 +Н 2 О ↔ Н 2 S О 3
- Н 2 S О 3 ↔ Н + + Н S О 3 - гидросульфит - ион
- Н S О 3 - ↔ Н + + S О 3 2- сульфит – ион

Качественная реакция на сульфит-ион S О 3 2-
- Na 2 S О 3 +2НС l = 2 Na С l + Н 2 S О 3
- 2 Na + + S О 3 2- +2Н + +2С l - =2 Na + +2С l - + Н 2 О+ S О 2
- 2Н + + S О 3 2 - = Н 2 О+ S О 2

S +6 O 3 – оксид серы ( VI ), кислотный оксид (высшая степень окисления серы)
S +6 O 3 - бесцветная жидкость
S +6 O 3 + Н 2 О =Н 2 S +6 O 4 серная кислота

SO 3 -сернистый ангидрид
SO 3 -три оксид серы,
оксид серы ( Vi )
(ковалентная полярная связь)
- Бесцветная летучая
жидкость,
- t°пл. = 17°C; t°кип. = 66°С;
на воздухе "дымит",
- сильно поглощает влагу
(хранят в запаянных сосудах).
Получение
2SO 2 + O 2 → 2SO 3 + Q.
в присутствии катализатора (V2O5, Pt или Na2VO3):

SO3 — типичный кислотный оксид, ангидрид серной кислоты.
1. Кислотно-основные: При взаимодействии с водой образует серную кислоту:
- SO 3 + H 2 O → H 2 SO 4 .
Взаимодействует с основаниями:
- 2 KOH + SO 3 → K 2 SO 4 + H 2 O,
основными оксидами:
- CaO + SO 3 → CaSO 4 ,
c амфотерными оксидами:
- 3 SO 3 + Al 2 O 3 → Al 2 (SO 4 ) 3 .
SO 3 растворяется в 100%-й серной кислоте, образуя олеум:
- H 2 SO 4 (100 %) + SO 3 → H 2 S 2 O 7 .

Загрязнение воздуха оксидами неметаллов, особенно оксидами серы и азота, приводит к образованию кислотных дождей. Эти оксиды могут попадать в атмосферу из естественных источников – например, при извержении вулканов или при разложении органических веществ. Но кроме того, они образуются и при горении ископаемого горючего: угля, нефти и природного газа.


Кислоты попадают на землю вместе с дождем, снегом или градом (так называемое «влажное осаждение»). Даже на большом расстоянии от источника загрязнения дождь имеет слабокислую реакцию.

Кислотная среда ускоряет рост грибков и бактерий, оказывая при этом вредное влияние на растения. Некоторые растения способны преобразовывать оксид серы (IV) в другие соединения, которые скапливаются в кончиках листьев. Отравленные листья увядают и опадают.

Кислотные дожди также разрушают здания, памятники
и металлические конструкции.

Кислотные дожди воздействуют на пигменты, входящие в состав красок

Домашнее задание: изучить § 11-12, записи в тетрадях,
упр. 1, 2
на стр. 34.

 Получите свидетельство
Получите свидетельство Вход
Вход











 ПРЕЗЕНТАЦИЯ К УРОКУ "СОЕДИНЕНИЯ СЕРЫ" (655.5 KB)
ПРЕЗЕНТАЦИЯ К УРОКУ "СОЕДИНЕНИЯ СЕРЫ" (655.5 KB)
 0
0 2976
2976 338
338 Нравится
0
Нравится
0








