Цель урока: развивать и систематизировать знания учащихся о кислороде и сере как химических элементах и простых веществах.
Задачи:
- создать условия для развития представлений учащихся об элементах VIА - группы на примере кислорода и серы;
- развивать представления учащихся об аллотропии химических элементов;
- сформировать представления о водородных соединениях кислорода и серы;
- закрепить умения применять полученные знания при объяснении новых фактов;
- продолжить формировать умение составлять уравнения окислительно - восстановительных реакций, расставлять коэффициенты методом электронного баланса;
- воспитывать бережное отношение к природе, экологическую культуру, обращая внимание на свойства кислорода, озона и сероводорода.
Оборудование и реактивы: учебник «Химия 10» под ред. И. Е. Шимановича; таблица периодической системы химических элементов; рисунки с аллотропными модификациями кислорода и серы.
Тип урока: урок усвоения новых знаний.
- Организационный момент
- приветствие учащихся класса, сообщение дежурных класса информации об отсутствующих
- проверка готовности учащихся к уроку
- Опрос и актуализация знаний
Тест по теме «Галогены» с последующей взаимопроверкой в парах по листам самоконтроля.
1 вариант
1. Среди галогенов – простых веществ - твердым является
а) фтор б)хлор в)бром г)иод.
2. О фторе нельзя сказать, что он
а) самый активный; б) самый электроотрицательный; в) самый агрессивный;
г) самый легкий элемент.
3. Наиболее ярко выражены восстановительные свойства у
а) фтора б) хлора в) брома г) иода.
4. Из галогенов как отравляющее вещество в боевых действиях был применен впервые
а) фтор б) хлор в) бром г) иод.
5. Степень окисления хлора в соединении Са (ОСl)2
а) - 1 б) +1 в) +3 г) +5
6. Сила галогеноводородных кислот возрастает в ряду
а) НСl, НВr, НI; б) НI, НВr, НСl; в) НВr, НI, НСl; г) НI, НСl, НВr.
7. При сливании растворов бромида калия и нитрата серебра образуется осадок
а) белого цвета; б) желтоватого цвета; в) желтого цвета; г) оранжевого цвета.
8. Смешали два раствора, содержащие равные массы хлорида натрия и нитрата серебра по 20 г каждого. Масса выпавшего осадка равна
а) 16, 8 г б) 33, 6 г в) 48, 8 г г) 97, 7 г
9. Фтор взаимодействует с водой по уравнению ___
10. Хлор взаимодействует с горячим раствором гидроксида калия по уравнению______
2 вариант – смотрите документЦелеполагание
Через вступительное слово о том, что на данном уроке учащиеся будут на практике воплощать полученные знания о строении атома, периодическом законе и периодической системе, химической связи, окислительно - восстановительных реакциях при изучении кислорода и серы как химических элементов и простых веществ. Таким образом учащиеся подводятся к формулированию темы урока, к постановке цели и задач урока.
- Изучение нового материала
- Строение атома (фронтальное обсуждение, результатом которого является заполнение таблицы 1; графы Радиус атома и Значение электроотрицательности заполняются учителем заранее и предлагаются учащимся в ознакомительном порядке)
Затем сообщаются возможные валентные состояния и степени окисления, присущие для элементов VIA - группы.
- Аллотропные модификации кислорода и серы (демонстрация рисунков аллотропных модификаций кислорода и серы, работа со сравнительной таблицей 2, работа с §38, с. 187 - 188).
Обращаю внимание на то, что модификации могут отличаться составом, строением молекул, способом их расположения в кристаллах.
Физкультминутка. Учащимся предлагается смоделировать динамичные фигуры молекул кислорода и озона (становятся в пары и тройки).
- Химические свойства простых веществ кислорода и серы
Работа в тетрадях – закончить предложенные уравнения реакций, 3 и 4 реакции рассмотреть как ОВР:
Fe + O2 =
Р + О2 =
Zn + S =
S + O2 =
- Озон – работа с §38, с. 189. Дополнительно сообщается реакция разрушения озона в атмосфере.
- Водородные соединения кислорода и серы
Сообщаются сведения о составе, строении и свойствах воды и сероводорода. Учащиеся одновременно делают в тетради соответствующие записи.
- Распространенность в природе. Применение кислорода и серы.
Самостоятельная работа с §38, с. 186 - 187, 191.
- Первичный контроль, коррекция знаний и умений.
1. Заполните пробелы в утверждениях:
1. Кислород и сера - элементы ……. . группы ………. . подгруппы.
2. Заряд ядра атома кислорода равен …….
3. В ядре атома кислорода содержится …… протонов, …… нейтронов, …. . электронов.
4. Атомы кислорода и серы имеют на внешнем уровне …. . электронов.
5. Кислород имеет степень окисления в соединениях ……. и является в ходе химической реакции …………. .
6. Сера имеет степени окисления в соединениях …………… и является в ходе химической реакции и окислителем, и …………. .
7. Аллотропные модификации кислорода: …………….
2. Исправь ошибку и запиши правильно уравнения
Na + O = Na2O
S + F2 = SF6
Fe + S2 = FeS
P + O2 = PO5
S + Cl2 = SCl2
S + H2O = H2S + O2
3. Определите степень окисления и валентность серы в соединениях: сульфид кальция, сульфит кальция, сульфат кальция.
4. Вычислите массовые доли серы и хлора в соединении серы с хлором SCl4.
5. Какой объем оксида серы (IV) образуется при сжигании серы в 10 л воздуха?
- Обобщение и систематизация знаний
Учащимся предлагается ответить на следующие вопросы:
- Какова распространённость кислорода и серы в природе?
- В виде каких соединений кислород и сера в природе?
- Укажите состав воздуха и содержание в нём кислорода.
- Каково строение молекулы кислорода?
- Каково строение молекулы ромбической серы?
- Какое явление называют аллотропией? Какие аллотропные модификации кислорода и серы вам известны?
- Каковы химические свойства кислорода?
- Каковы химические свойства серы?
- Рефлексия
Предлагается обратить внимание на тему урока, задачи урока, записи в тетрадях.
– Вспомните, как вы работали на уроке.
– Какие ощущения были у вас на уроке?
– Довольны ли вы своей работой на уроке?
– С какими ощущениями вы пойдёте домой?
Озвучивается домашнее задание, даётся качественная оценка работе класса, выставляются отметки.
Домашнее задание: §38, задания 2, 7.
Задания творческого характера: подготовить презентацию на тему «Распространенность кислорода и серы в природе».

 Получите свидетельство
Получите свидетельство Вход
Вход


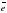 на внешнем электронном слое
на внешнем электронном слое








 Урок химии "Кислород и сера" (29.31 КB)
Урок химии "Кислород и сера" (29.31 КB)
 0
0 2110
2110 314
314 Нравится
0
Нравится
0







