Цель:
изучить строение, свойства, получение и применение серной кислоты.
Задачи урока:
-образовательная: познакомить учащихся с физическими и химическими свойствами концентрированной и разбавленной серной кислоты; рассмотреть ее получение; показать народнохозяйственное значение этой кислоты и ее солей;
-развивающая: развитие речи, памяти, логического мышления, умений совместной деятельности; развитие и закрепление умений и навыков работы с лабораторным оборудованием;
-воспитательная: формирование мировоззрения, навыков сотрудничества;
приемственности знаний; осуществление межпредметных связей; воспитание разумного отношения к природе, экологической грамотности.
Оборудование и реактивы: коллекция минералов соединений серы, концентрированная и разбавленная серная кислота, металлический цинк, раствор сульфата меди (П), оксид меди (П), раствор гидроксида натрия, раствор хлорида бария, соли серной кислоты (медный купорос, железный купорос, безводный сернокислый натрий, гипс др. ), 2 таблетки норсульфазола, индикаторы (фенолфталеин, метиловый оранжевый, лакмус), пробирки, горелка, сухое горючее, спички, лучинка, ПК, мультимедийный проектор.
Ход урока.
I. Организационный момент.
II. Актуализация знаний.
Закончите уравнения возможных реакций:
а) SO2 + Ca(OH) 2 =
б) Na2SO3 + HCl =
в) SO3 + NaOH =
г) SO2 + H2O =
д) Cl2 + SO2 + H2О =
е) SO3 + HNO3 =
Для окислительно-восстановительных реакций приведите электронный баланс, для реакций, протекающих в растворах, - ионные уравнения.
III. Изучение нового материала.
В 1260 году алхимик и епископ Альберт Великий (Альберт фон Больштедт) в поисках «эликсира молодости» решил попытаться выделить его из железного купороса. Засыпав в реторту порошок купороса, он стал ее нагревать. В начале из реторты пошел «белый дым», а потом в сосуд-приемник начали поступать бесцветные прозрачные капли неизвестной жидкости. Епископ собрал немного этой жидкости и размешал ее оструганной деревянной палочкой; палочка вскоре почернела.
Альберт Великий назвал полученную жидкость «купоросным маслом». Позднее, в 1590 году, немецкий алхимик и врач Андреас Либавий, тоже пытаясь отыскать «эликсир», смешал серу и селитру, а потом нагрел смесь в длинногорлой колбе-алембике, отводя выходящий из нее «дым» в сосуд с водой. Когда в колбе осталась только коричневая сплавленная масса, он закончил опыт и стал испытывать содержимое сосуда с водой, где поглощался «дым».
Капнул немного этой жидкости на кусок железа, и она зашипела и запузырилась; нанес ее на свинцовую пластину – осталось белое пятно. Но свинец не поддался «кислому спирту», как назвал полученную жидкость Либавий.
Это была концентрированная серная кислота, которую долгое время называли «купоросным маслом» (см. презентацию, слайд).
С серной кислотой, ее свойствами и солями мы с вами подробнее познакомимся на сегодняшнем уроке.
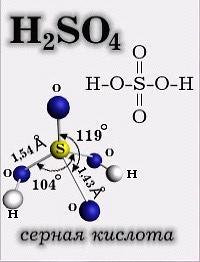
Рассмотрим строение молекулы серной кислоты (см. презентацию, слайд).

Физические свойства.
Чистая (100% «дымящая») серная кислота представляет собой бесцветную тяжелую вязкую жидкость, при небольшом охлаждении затвердевающую с образованием бесцветных кристаллов (t плавления 100 С). Поэтому обычно используют не чистую кислоту, а концентрированный 98% раствор.
Получение серной кислоты.
В настоящее время ее получают контактным способом.
(демонстрация коллекции минералов соединений серы)
Например, сырьем для производства серной кислоты служит железный колчедан – пирит FeS2, который после отделения от пустой породы подвергают обжигу. Газ, выходящий из обжиговой печи, содержит значительное количество оксида серы (1VОчищенный газ нагревается в теплообменнике до 4500 С и поступает в контактный аппарат, где происходит его окисление до серного ангидрида (SO3).
Внутри контактного аппарата на специальных решетках находится катализатор – оксид ванадия (V) V2O5, содержащий промоторы. Образовавшийся SO3 поглощают концентрированной серной кислотой. Образуется олеум – раствор серного ангидрида в серной кислоте (см. презентацию, слайд).
1 стадия получение сернистого газа S + O2= SО2
2 стадия получение серного ангидрида 2SO2 + O2 ---- 2SO3
3 стадия получение серной кислоты H2O + SO3 = H2SO4
С сернокислотным производством связаны большие экологические проблемы, например, образование кислотных дождей.
Термин «кислотные дожди» ввел английский химик А. Смит более 100 лет назад. Причиной возникновения кислотных дождей являются массовые промышленные выбросы оксида серы (1V) и оксидов азота в атмосферу (см. презентацию, слайд).
Свойства разбавленной серной кислоты.
Индикаторы изменяют свой цвет в растворах кислот.
В растворе серной кислоты фенолфталеин остаётся бесцветным, оранжевый метиловый оранжевый становится красно-розовым, фиолетовый лакмус-красным.
(Учащиеся в 3 пробирки с 2 мл серной кислоты добавили по одной капли каждого индикатора. Полученные результаты записали в тетрадь).
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Конспект урока химии "Соединения серы" (86 КB)
Конспект урока химии "Соединения серы" (86 КB)
 0
0 1991
1991 269
269 Нравится
0
Нравится
0



