Цель урока:
Рассмотреть строение, свойства, получение и применение предельных карбоновых кислот.
Задачи:
углубить и систематизировать знания о предельных карбоновых кислотах на примере муравьиной, уксусной и щавелевой кислот;
познакомиться с основными способами их получения в лаборатории и в промышленности;
сообщить сведения об истории открытия этих кислот, свойствах и способах безопасного их применения;
продолжить развивать активную и творческую деятельность, навыки самостоятельно добывать знания, умения работать с химическими веществами, соблюдая правила техники безопасности.
Оборудование и реактивы.
На демонстрационном столе — пластмассовый штатив с пробирками, спиртовка, зажим для пробирок; безводная муравьиная кислота, 5%-е водные растворы муравьиной кислоты, уксусной кислоты, гидроксида железа (III), водный раствор гидроксида диамминсеребра, лакмус, гидрокарбонат натрия, 10% раствор аммиака.
Примерно за две недели до проведения урока класс разбивается на четыре группы, различающихся уровнем подготовки учащихся. Каждой группе предлагается в форме исследовательской работы собрать информацию и подготовить к уроку информацию по определенной теме и выступить с ним на семинаре.
Задание группе 1. Группа: «Историки». Собирают информацию по истории открытия, происхождение названия, нахождение в природе и физические свойства муравьиной, уксусной, щавелевой кислот.
Задание группе 2. Группа «Химики – эксперты».
Проводят исследовательскую работу по изучению химических свойствам муравьиной, уксусной, щавелевой кислот.
Задание группе 3 Группа: «Технологи».
Изучают основные способы получения и применения муравьиной, уксусной и щавелевой кислот.
Задание группе 4 Группа «Практиков» Применение муравьиной, уксусной и щавелевой кислот.
ХОД УРОКА
План урока
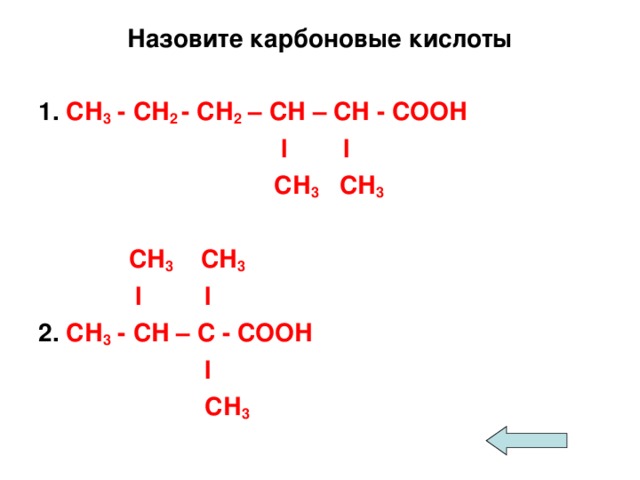
I. Актуализация знаний о строении, классификации, номенклатуре и видов изомерии карбоновых кислот
II. Изучение нового материала.
1. Органические кислоты в природе
2. Физические свойства
3. Химические свойства
4. Получение
5. Применение
III. Закрепление полученных знаний (решение кроссворда)
I V. Домашнее задание:
Учитель. С каким классом органических веществ вы познакомились на предыдущих уроках? Вспомните название и определение данного класса.
Учитель. Сегодня мы познакомимся с историей открытия, способами получения, физическими и важнейшими химическими свойствами, практическим значением представителей предельных карбоновых кислот. Отдельным учащимся предлагалось заранее подготовить к уроку сообщение по определенной теме и выступить с ним на семинаре. Прежде чем начать обсуждение данных вопросов, проверим решение домашних задач на нахождение молекулярных формул веществ, о которых сегодня и пойдет речь (к доске вызываются 2 уч-ся).
Домашние задачи
Задача 1. Массовая доля кислорода в предельной одноосновной кислоте равна 53,3%. Какая это кислота?
(СН3СООН – уксусная кислота)
Задача 2 Предельную одноосновную карбоновую кислоту массой 18,4 г нейтрализовали 80 г 20% раствора гидроксида натрия. Определите формулу этой кислоты.
(НСООН – муравьиная кислота.)
Учитель. Каковы отличительные особенности карбоновых кислот от других классов изученных веществ?
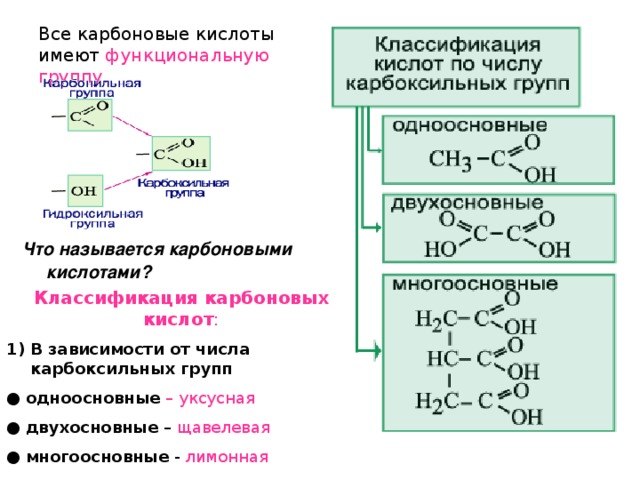
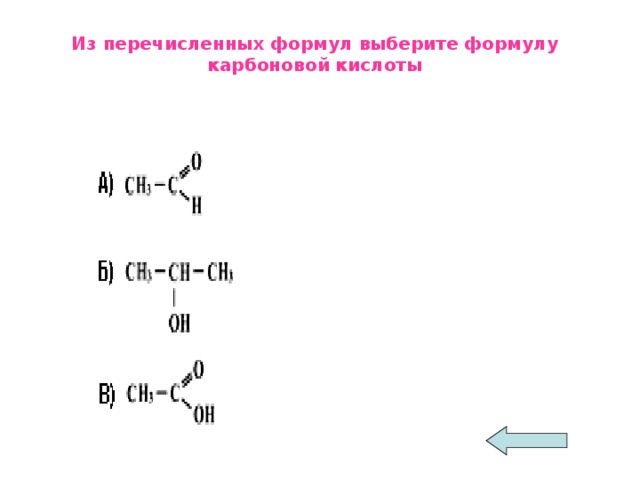
Учащиеся. Карбоновые кислоты – кислородсодержащие органические вещества. Молекулы которых содержат одну, две или более карбоксильных функциональных групп –СООН, соединенных с углеводородным радикалом

Общая формула: R – COOH
Проблемный вопрос: почему функциональная группа у карбоновых кислот называется карбоксильной?
Учащиеся. Эта группа состоит из двух функциональных групп: карбонильной и гидроксильной
Учитель. Виды классификации карбоновых кислот?
Учащиеся. Карбоновые кислоты классифицируют по двум признакам: а) по числу функциональных групп; б) по строению углеводородного радикала (примеры).
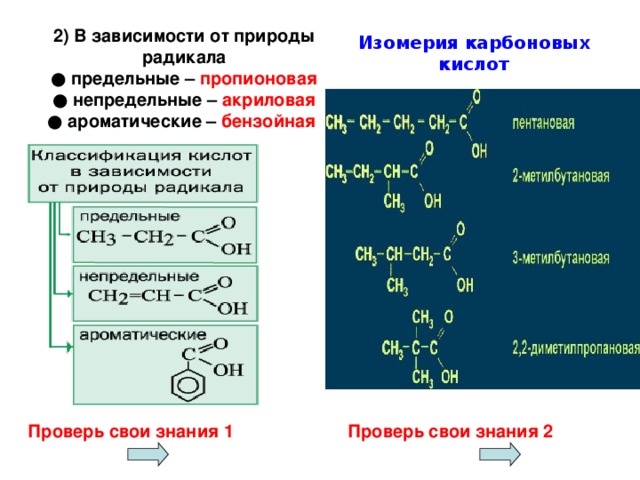
Учитель. Какие виды изомерии характерны для карбоновых кислот.
Учащиеся. Изомерия углеродного скелета и межклассовая изомерия (примеры), изомерия положения кратной связи (для непредельных кислот)
Учитель (по окончании решения задач). Итак, вы успешно справились с решением предложенных задач и нашли молекулярные формулы тех веществ, о которых вами подготовлены сообщения. Начнем работу нашего семинара с рассмотрения истории открытия, происхождения названий, нахождения в природе и физических свойств интересующих нас соединений. В ходе семинара вам необходимо составить конспект урока в виде таблицы.
Слово для выступления имеют ребята из первой группы.
Ученик (из 1-й группы). Химическая формула НСООН, соответствует простейшей монокарбоновой кислоте – муравьиной. Ее название указывает на источник, из которого эта кислота впервые была выделена. Муравьиная кислота открыта в кислых выделениях рыжих муравьев. Она является одним из компонентов яда, который выделяют жалящие муравьи, а также компонентом жгучей жидкости жалящих гусениц шелкопряда. В 1670 г. английский ботаник и зоолог Джон Рей провел необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел ее до кипения и пропустил через сосуд струю горячего пара. После конденсации пара получился водный раствор, обладавший сильнокислой реакцией. Это и был раствор муравьиной кислоты. В чистом виде муравьиную кислоту впервые получил в 1749 г. Андреас Сигизмунд Маргграф. Муравьиная кислота служит насекомым своеобразным «химическим оружием» для защиты и нападения. Муравьиная кислота полезна для крупных млекопитающих, так, медведи после зимней спячки избавляются от паразитов, ложась на муравейник. Муравьи, кусая его, впрыскивают муравьиную кислоту.
Практически каждый человек хотя бы раз в своей жизни получил ожог от укусов муравьев. Ощущение очень напоминает ожог крапивой – ведь муравьиная кислота содержится и в тончайших волосках этого весьма распространенного растения. Вонзаясь при соприкосновении в кожу, они сразу же обламываются, а их содержимое болезненно обжигает. Муравьиная кислота также присутствует в пчелином яде, сосновой хвое, в небольших количествах найдена в различных фруктах, тканях, органах, выделениях животных и человека.
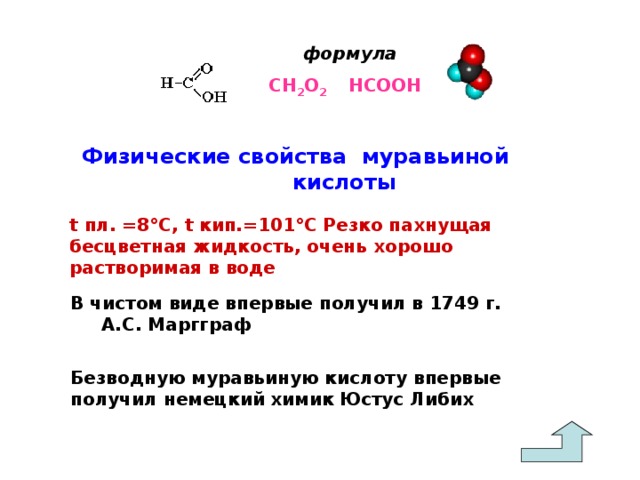
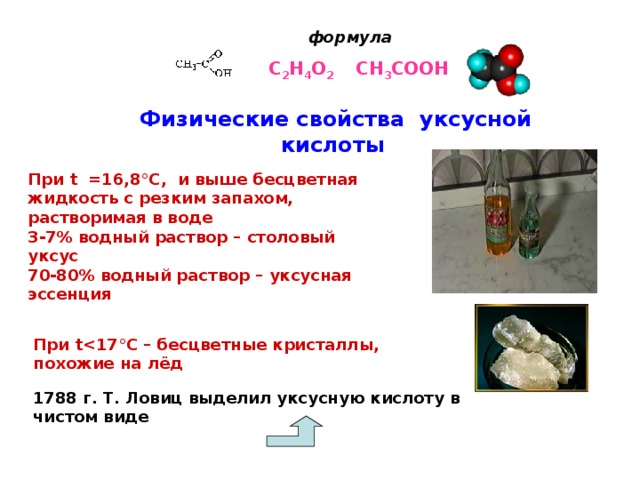
Современное название муравьиной кислоты по систематической номенклатуре – метановая кислота. Это резко пахнущая бесцветная жидкость, очень хорошо растворимая в воде,
tпл. = 8 °С, tкип. = 101 °С. Муравьиная кислота – самая простая и при этом самая сильная монокарбоновая кислота, она в десять раз сильнее уксусной. Когда немецкий химик Юстус Либих получил безводную муравьиную кислоту, оказалось, что это очень опасное соединение.
При попадании на кожу кислота не только жжет, но и буквально растворяет ее, оставляя долго не заживающие раны, а после на коже остаются рубцы, поэтому с этой кислотой нужно обращаться очень осторожно.
Учитель. А сейчас мы остановимся на отдельных химических свойствах муравьиной кислоты.
Ученик. Важнейшим специфическим свойством муравьиной кислоты является ее способность вступать в реакцию «серебряного зеркала» с гидроксидом диамминсеребра(I) [Аg(NН3)2]ОН, в отличие от всех остальных карбоновых кислот. Это объясняется тем, что муравьиная кислота по своему химическому строению является одновременно и карбоновой кислотой, и альдегидом (в ее молекуле мы видим как карбоксильную функциональную группу –СООН, так и альдегидную группу –СНО). Поэтому муравьиная кислота восстанавливает серебро из аммиачного раствора его гидроксида (так называемого реактива Толленса), причем среди продуктов реакции присутствует углекислый газ, что тоже необычно. Это связано с окислением муравьиной кислоты до угольной кислоты, которая сразу же распадается на воду и углекислый газ:
НСООН + 2 [Ag(NH3)2]OH = CO2 + 2H2O+ 2Ag↑ + 4NH3 или НСООН + 2 [Ag(NH3)2]OH = NH4HCO3 + H2O+ 2Ag↓+ 3NH3
Параллельно проводится демонстрационный опыт: в пробирку с раствором гидроксида диамминсеребра(I) добавляют муравьиную кислоту и слегка нагревают – на стенках пробирки образуется зеркальный налет восстановленного металлического серебра.
Ещё одно отличительное химическое свойство муравьиной кислоты – способность разлагаться под действием концентрированной серной кислоты на воду и угарный газ
НСООН → СО + Н2О
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
Учитель.
Все, наверное, помнят эти строки из детских книг. «На крапиву не садись, если сядешь, не сердись»
Объясните их. (Муравьиная кислота при попадании на кожу вызывает ожоги).
Поскольку мы коснулись химических свойств муравьиной кислоты, попробуйте ответить на такие вопросы. Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению болевых ощущений. Почему боль утихает, если пораненное место смочить нашатырным спиртом? Что еще можно использовать в данном случае?
Учащиеся. Муравьиная кислота – электролит, при ее растворении в воде происходит процесс электролитической диссоциации:
НСООН НСОО– + Н+.
В результате кислотность среды повышается, и процесс разъедания кожи усиливается. Чтобы боль утихла, нужно нейтрализовать кислоту, для чего необходимо использовать растворы, обладающие слабощелочной реакцией. А к ним как раз и относится нашатырный спирт – водный раствор аммиака, содержащий гидроксид аммония NH4ОН. Изменение окраски лакмуса добавленного заранее в кислоту, свидетельствует о протекании реакции нейтрализации.
При его взаимодействии с муравьиной кислотой происходит реакция нейтрализации:
НСООН + NН4ОН = НCOONH4 + H2O
Н+ + ОН - = Н2О
Для тех же целей вполне подойдет и водный раствор имеющейся в каждом доме питьевой соды – гидрокарбоната натрия NаНСО3:
НСООН + NaHСO3 = НСООNа + Н2О + СO2
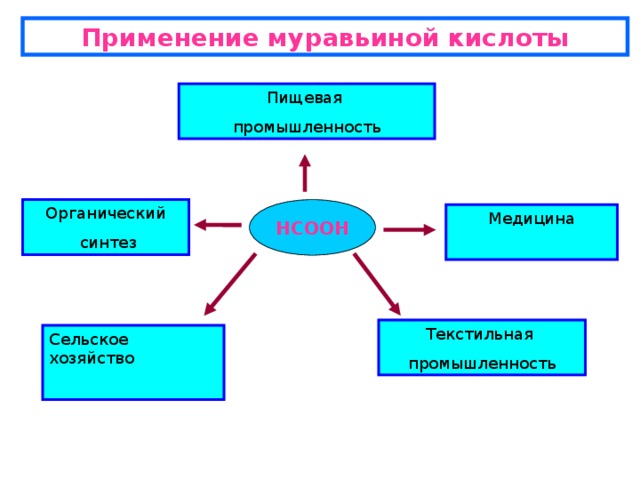
Учитель. Рассмотрим вопрос о получении и применении муравьиной кислоты.
Ученик. Раньше муравьиную кислоту получали довольно варварским методом - обработкой муравьев паром. Теперь для этих целей используют другие способы. Основным из них является реакция угарного газа и едкого натра при повышенной температуре и давлении.
В результате получается формиат натрия (натриевая соль муравьиной кислоты) HCOONa, которую обрабатывают серной кислотой. Образовавшуюся муравьиную кислоту отгоняют при пониженном давлении.
2HCOONa + H2SO4 = 2HCOOH + Na2SO4
Известен также способ получения муравьиной кислоты каталитическим окислением метана:
Учитель. Почему соли муравьиной кислоты называются формиаты?
Учащиеся. Название солей муравьиной кислоты происходит от латинского слова formica, что означает «муравей».
Ученик. Муравьиная кислота обладает ярко выраженными бактерицидными свойствами. Поэтому ее водные растворы используют как пищевой консервант код Е- 236, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки). В пчеловодстве муравьиная кислота используется как эффективное средство от варроатоза – болезни пчел, вызываемой клещами-паразитами. За рубежом она применяется еще как консервант при заготовке силоса. Если муравьиную кислоту добавлять в зелёную массу прямо во время косьбы, можно обойтись без сушки – массу можно сразу же закладывать на сохранение, не опасаясь дождя. Такие корма лучше сохраняются до самой весны, не теряют питательных свойств, а коровы на таких кормах дают больше молока. Невозможно обойтись без муравьиной кислоты и при дублении кож. Народная медицина издавна использовала муравьиную кислоту для лечения ревматических болей и радикулитов, при этом источником лекарства служили живые муравьи. В медицине эта кислота применяется для растираний при ревматизме в виде 1 % раствора муравьиной кислоты в этиловом спирте, известного под названием муравьиного спирта (название историческое: это лекарство когда-то готовили настаиванием муравьёв на спирту).
В начале XVIII в. ученые научились вовлекать муравьиную кислоту в реакции с различными спиртами, получая вещества с узнаваемыми запахами. Например, при нагревании бензилового спирта с муравьиной кислотой получали вещество с запахом жасмина.
Учитель. А теперь познакомимся с еще одной карбоновой кислотой, известной человеку с глубокой древности. Слово для выступления имеют ребята из 2-й группы.
Ученик.
Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Знаете ли вы, что слово “уксус” происходит от греческого слова “оксос”, означающего “кислый”? Почему уксусная кислота оказалась первой, понять нетрудно. С древнейших времен люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его, видимо, выливали, потом научились использовать как лекарство, приправу к пище, как растворитель красок
В России уксус называли «кислой влажностью» или «древесной кислотой». Последнее название связано с получением уксусной кислоты при сухой перегонке древесины лиственных пород, прежде всего березы.
В чистом виде уксусную кислоту получил впервые в 1788 г преемник М. В. Ломоносова российский академик Товий Ловиц. Чистую уксусную кислоту он назвал ледяной по той причине, что при охлаждении ниже 17 ° С она превращалась в бесцветную кристаллическую массу, очень похожую на лед.
Уксусная кислота – важнейший продукт обмена в живых организмах. Поэтому её можно обнаружить в зелёных растениях, в поте, в моче и желчи многих животных, в скисшем вине, пиве, квасе и многих других веществ.
Уксусная кислота (по систематической номенклатуре – этановая) – бесцветная жидкость с характерным острым запахом, очень хорошо растворимая в воде, tпл = 17 °С, tкип = 118 °С;
3–7%-й водный раствор уксусной кислоты называется столовым уксусом, а 70–80%-й раствор – уксусной эссенцией. Безводная уксусная кислота при охлаждении до 16,8 °C превращается в прозрачные кристаллы, похожие на лед. Вот почему ее называют ледяной. В 1800 г. Ловиц нечаянно пролил концентрированную уксусную кислоту на стол. Собирая кислоту фильтровальной бумагой, ученый выжимал ее пальцами над стаканом. Вскоре он заметил, что пальцы потеряли чувствительность, побелели и распухли. Через несколько дней кожа на пальцах стала лопаться и отваливаться большими и толстыми кусками. Полученная травма навела Ловица на мысль использовать концентрированную уксусную кислоту для выведения мозолей. Еще одна опасность уксусной кислоты заключается в том, что вдыхание человеком ее паров может привести к отеку горла.
Учитель. Химические свойства уксусной кислоты.
Ученик.
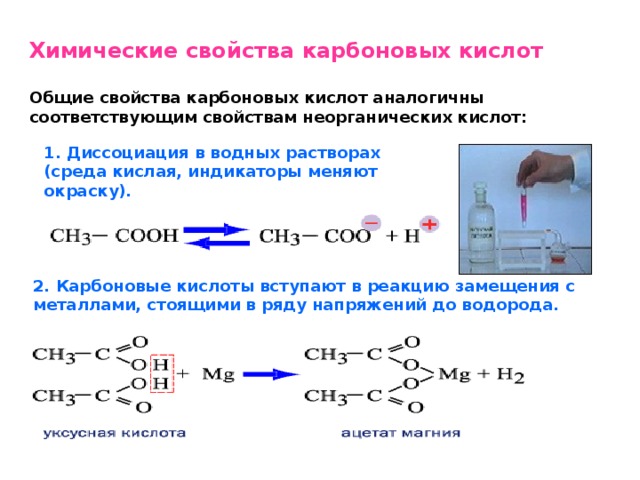
Уксусная кислота СН3СООН – одноосновная карбоновая кислота предельного ряда. По химическим свойствам уксусная кислота уступает муравьиной, что является результатом влияния радикала СН3 на карбоксильную группу:
Подобно минеральным кислотам в водных растворах уксусная кислота диссоциирует на ионы:
СН3СОOН СН3СОО– + Н+.
Уксусная кислота проявляет общие химические свойства, характерные для всех кислот. Это объясняется наличием ионов водорода, образующихся при диссоциации в водных растворах. Поскольку уксусная кислота относится к слабым электролитам, то ионов водорода и ацетат-ионов образуется мало.
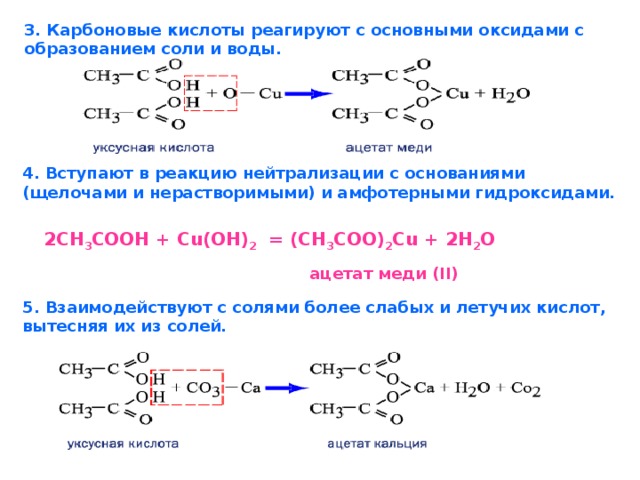
Как и минеральные кислоты, уксусная кислота взаимодействует с металлами, основными оксидами, основаниями и солями:
С помощью уксусной кислоты в быту можно избавиться от ржавчины на одежде. Основная часть ржавчины – это гидроксид железа (III), который не растворяется в воде. Если место, где появилась ржавчина обработать уксусной кислотой, то ржавчина исчезает, так как нерастворимый в воде гидроксид железа (III) превращается в растворимую соль уксусной кислоты ацетат железа(III), которую легко удалить водой. Параллельно проводится демонстрационный опыт.
3СН3СООН + Fe (OH)3 → (CH3COO)3Fe + 3H2O
3СН3СОО +3Н+ + Fe (OH)3 → 3CH3COO- + Fe3+ + 3H2O
Учитель.
Вопрос. Как влияет метильный радикал в молекуле уксусной кислоты на карбоксильную группу?
Проблемный вопрос: некоторые лекарственные препараты нельзя запивать целым рядом напитков, в том числе кислые фрукты и соки, маринады, блюда с уксусом нельзя употреблять в пищу наряду с антибиотиками пенициллинового ряда и эритромицином. Как вы думаете, чем вызван данный запрет?
Ученик. Кислоты, содержащиеся в указанных продуктах, могут вступать в химическое взаимодействие с названными антибиотиками, нейтрализуя их воздействие на организм.
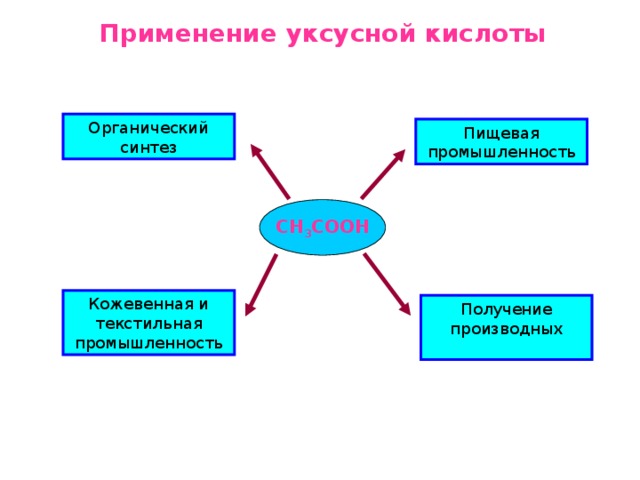
Учитель. Верно. А сейчас перейдём к изучению способов получения уксусной кислоты. Слово для выступления имеют учащиеся 3-й группы.
Ученик (из 3-й группы). Древнейший способ получения уксусной кислоты заключается в окислении этилового спирта кислородом воздуха при участии бактерий:
В настоящее время уксусную кислоту получают окислением ацетальдегида кислородом в присутствии катализатора ацетата марганца(II):
Большое значение имеет также способ, основанный на окислении н-бутана кислородом в присутствии катализатора ацетата кобальта(II):
Очень перспективен метод карбонилирования метилового cпирта, т. е. присоединения к нему молекулы угарного газа в присутствии катализатора йодида кобальта:
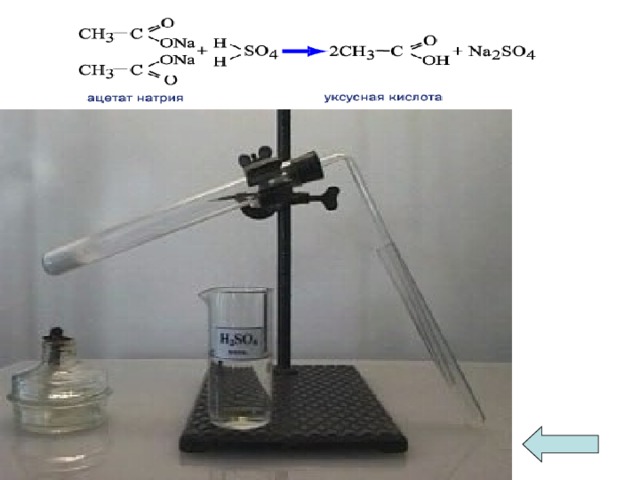
В лаборатории уксусную кислоту получают из её солей ацетатов при добавлении конц. серной кислоты и нагревани:
2CH3COONa + H2SO4 → 2 CH3COONa + Na2SO4
Учитель. Попробуйте объяснить происхождение названия солей уксусной кислоты.
Ученик. Слово уксусная на латинском языке называется «ацетум».
Учитель. Нам остается рассмотреть вопрос о применении уксусной кислоты.
Ученик. В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии.
В настоящее время уксусную кислоту в виде эссенции (70% раствор и столового уксуса 9% раствор) широко применяют в пищевой промышленности в качестве консерванта и регулятора кислотности под кодом Е-260.
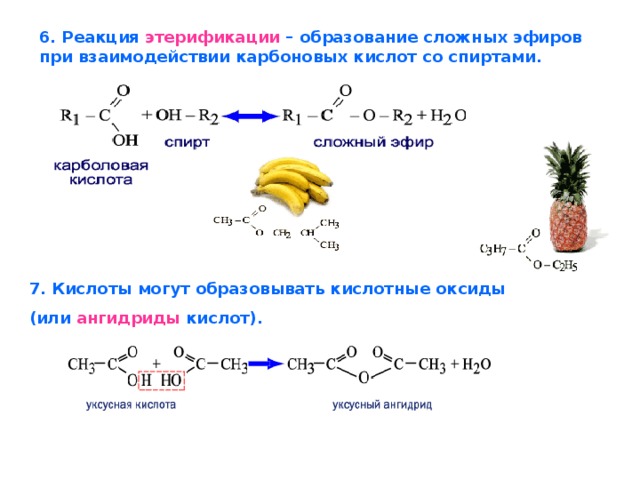
Незаменима она и в органическом синтезе при производстве сложных эфиров, прежде всего этилацетата, лекарств, например аспирина, искусственных волокон – ацетатного шелка, красителей – индиго, негорючей кинопленки, органического стекла, ядохимикатов для борьбы с сорняками, стимуляторов роста растений.
Знаете ли вы, что если потребуется отвинтить ржавую гайку, то рекомендуется вечером положить на нее тряпку, смоченную в уксусной кислоте? Утром отвинтить эту гайку будет значительно легче.
Знаете ли вы, что в течение суток в организме человека образуется 400 г уксусной кислоты? Этого хватило бы для изготовления 8 л обычного уксуса.
Учитель. Проблемный вопрос:
По сравнению со спиртами кислоты имеют более высокие t кип., чем это можно объяснить?
Ответ. Это можно объяснить ассоциацией молекул кислот за счёт водородной связи. Прочность водородной связи в кислотах примерно в 2 раза выше, чем у спиртов.
Учитель. Итак, осталось еще кислота, о которой, может быть, многие знают очень мало. Слово предоставляется ребятам из 3-й группы.
Щавелевая кислота является двухосновной карбоновой кислотой, по международной номенклатуре ИЮПАК – этандиовая.
Щавелевая кислота или её калиевые и натриевые соли в незначительном количестве присутствует в плодах и ягодах. Но в таких овощных растениях, как щавель, ревень, листья свеклы, ее довольно много. Она содержится в клевере и даже плодах томатов. В оболочках клеток многих съедобных грибов присутствует в значительном количестве в виде щавелевокислой извести, является продуктом обмена во многих живых организмах.
Органическая щавелевая кислота — это живое вещество, ценный для нашего здоровья продукт, снабжающий организм железом и магнием, необходимыми для кроветворения, а также стимулирующий вялый кишечник. Основной источник органической щавелевой кислоты — сырые овощи и фрукты. Если ежедневно употреблять свежие соки из овощей, в которых она содержится, и дополнять питание сырыми овощами в виде салатов, то отпадет необходимость в поисках витамина В6 и магния, дефицит в которых мы порой ощущаем.
При употреблении щавеля в больших количествах щавелевая кислота взаимодействует с растворимыми солями кальция, содержащимися в крови, и образуют нерастворимую соль оксалата кальция. Вот эта соль и причиняет нам массу неприятностей — образование камней в почках и мочевом пузыре, ревматизм суставов, артриты, разрушения зубов, костей и другие заболевания.
Людям, имеющим высокую свертываемость крови и предрасположенным к тромбофлебиту, употреблять щавель не рекомендуется. Многие плоды и ягоды способствуют выведению из организма щавелевой кислоты, к их числу относятся яблоки, груши, айва, кизил, листья черной смородины, листья винограда в виде настоя.
Физические свойства:
Простейшая двухосновная карбоновая кислота; молекулярная масса 90,04; бесцветные кристаллы; растворяется в воде: в 100 г - 10 г (20°С) , ограниченно - в спирте, эфире; нерастворима в бензоле, хлороформе, t плавления 189,5°С;
Если человек употребляет продукты, содержащие повышенное количество щавелевой кислоты и пьет жесткую воду с большим содержанием кальция, то в его организме происходит процесс образования кальциевых солей щавелевой кислоты (оксалаты кальция)
Это можно проиллюстрировать химическим опытом:
Н2С2О4 + СаCI2→ СаС2О4↓ +2HCI
Конечно же, от съеденных нескольких тарелок зеленого борща камни не образуются, но тем не менее, если у вас почки не в порядке, лучше поберечься. Впрочем, в некоторых странах эту проблему решили достаточно просто: рекомендуют при варке зеленых щей или борща добавить 1 —2 столовые ложки раствора хлористого кальция, который можно купить в любой аптеке. В этом случае, вероятнее всего, оксалат кальция отложится не в почках, а в кастрюле.
Учитель. Можно ли щавелевую кислоту считать гомологом муравьиной кислоты? Дайте обоснованный ответ.
Получение и применение:
Впервые щавелевая кислота синтезирована в 1842 Ф. Вёлером из дициана.
В промышленности её получают пиролизом формиата натрия (HCOONa).
Щавелевую кислоту получают
из окиси углерода и гидроксида натрия промежуточным получением формиата натрия, при нагревании которого образуется оксалат натрия, подкисляя который, выделяют щавелевую кислоту
окислением углеводов, спиртов или гликолей смесью серной и азотной кислот в присутствии V2O5.
окислением этилена или ацетилена азотной кислотой в присутствии PdCl2 или Pd(NO3)2;
Щавелевая кислота - относительно сильная кислота, поэтому её используют в бытовой химии для удаления ржавчины и накипи. Она входит в состав композиций для очистки алюминия, серебра, хрома и медных сплавов. Применяется в качестве растворителя целлюлозы, в производстве красителей, чернил, как отбеливающего средство и осадитель редкоземельных элементов. В косметике применяется как активная добавка в отбеливающих кремах от веснушек.
В пищевой промышленности щавелевая кислота не находит применения, так как ее нерастворимые соли могут откладываться в печени человека, образуя камни. Кроме того, щавелевая кислота разъедает посуду, она сильнее уксусной кислоты примерно в 200 раз.
Щавелевая кислота и её соли токсичны, ПДК в воде водоемов хозяйственно-бытового пользования 0,2 мг/л.
Знаете ли вы, что эффективное средство для чистки поверхности меди и латуни - это смесь щавелевой кислоты (1 г), этилового спирта (5 мл), скипидара (4 мл) и воды (1 мл). Ее взбалтывают и наносят на очищаемое место мягким тряпичным тампоном, а через 5-10 минут протирают изделие сухой тряпкой. Скипидар и спирт обезжиривают поверхность, а щавелевая кислота взаимодействует с соединениями меди с образованием соли - оксалата меди CuC2O4, который легко удаляется с поверхности металла.
IV. Домашнее задание: § 20
Задачи
NaOH
Осуществить превращение: СН4→С2Н2 → С2Н4О → Х1→ СН3СООН → СН3СООNa → Х2
III. Закрепление полученных знаний (решение кроссворда)
Вывод.
Сегодня на уроке мы познакомились с физическими, химическими свойствами и способами получения отдельных представителей карбоновых кислот. Узнали интересные сведения об истории открытия этих кислот, но самое главное - способах безопасного их применения человеком.
Рефлексия. Подведение итогов урока.
Учитель:
Наш урок подходит к концу. И я хотела бы узнать, понравился ли вам урок? Что нового и интересного вы узнали на сегодняшнем уроке? С каким настроением вы уходите с урока?
Я рада, что у большинства из вас настроение хорошее и вы узнали много нового и интересного, что вам пригодится и в повседневной жизни . Спасибо за урок, вы хорошо поработали.
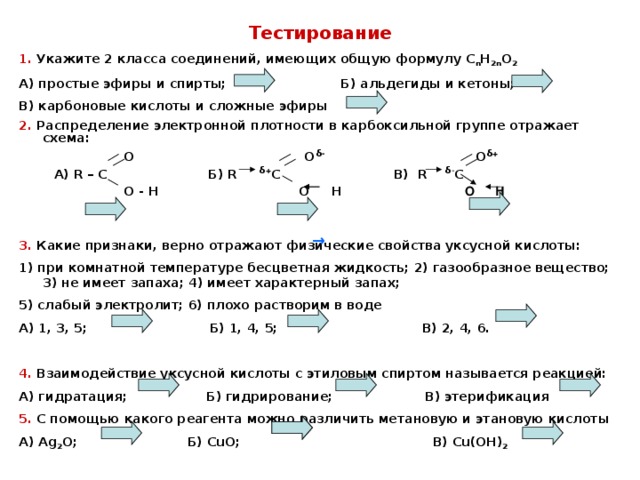
Тестирование
Вариант 1
1. Укажите 2 класса соединений, имеющих общую формулу СnН2nО2
А) простые эфиры и спирты;
Б) альдегиды и кетоны;
В) карбоновые кислоты и сложные эфиры;
2. Гомологом муравьиной кислоты является … кислота
А) щавелевая; б) масляная; в) бензойная.
3. Какие признаки, верно, отражают физические свойства уксусной кислоты:
1) при комнатной температуре бесцветная жидкость;
2) газообразное вещество;
3) не имеет запаха;
4) имеет характерный запах;
5) слабый электролит; 6) плохо растворим в воде
А) 1, 3, 5;
Б) 1, 4, 5;
В) 2, 4, 6.
4. Какая реакция невозможна:
а) СН 3СООН + Аg→ ; б) СН 3СООН + Сu (ОН)2→ ; в) СН 3СООН + НСООН→
5. С помощью какого реагента можно различить метановую и этановую кислоты:
А) Cu(OH)2; Б) CuO; В) Ag2O.
Вариант 2
1. Какая из общих формул соответствует карбоновым кислотам:
а) СnH2n+2O б) СnH2nO в) СnH2nO2
2. Кислота НООС – СООН по международной номенклатуре называется:
А) щавелевая; б) этановая; в) этандиовая;
3. С какими из перечисленных веществ в соответствующих условиях реагирует уксусная кислота:
1) медь; 2) оксид кальция; 3) оксид серы (VI); 4) метанол; 5) хлор; 6) этаналь; 7) карбонат натрия?
а)2,4,5,7, б) 1,2,5,6 в) 2,3,4,5
4. Уксусную кислоту в промышленности получают окислением:
А) бутаналя; б) этана; в) бутана.
5. Уксусную кислоту применяют:
а) в качестве восстановителя;
б)в производстве ацетатного волокна;
в) для дубления кож.

 Получите свидетельство
Получите свидетельство Вход
Вход








![Химические свойства муравьиной кислоты Важнейшим специфическим свойством муравьиной кислоты является её способность вступать в реакцию «серебряного зеркала» с гидроксидом диамминсеребра ( I ) НСООН + 2 [ Ag(NH 3 ) 2 ] OH = CO 2 + 2H 2 O+ 2Ag ↓ + 4NH 3 2. Ещё одно отличительное химическое свойство муравьиной кислоты – способность разлагаться под действием концентрированной серной кислоты на воду и угарный газ НСООН = СО + Н 2 О 3. Кроме того, муравьиная кислота окисляется хлором: НСООН + Сl 2 → СО 2 + 2 HCl .](https://fsd.videouroki.net/html/2013/11/01/98667575/img11.jpg)


















 Представители предельных карбоновых кислот (1.43 MB)
Представители предельных карбоновых кислот (1.43 MB)
 0
0 4118
4118 220
220 Нравится
0
Нравится
0



