Урок химии в 11 классе Тема урока: «Кислородсодержащие органические соединения» Нурекенова Зейнегул Каламтаевна, учитель химии
Тип урока: урок обобщения знаний.
Цели урока: закрепить, обобщить и систематизировать знания по кислородсодержащим органическим соединениям, в том числе и на основе генетической связи между классами этих веществ. Закрепить умения предсказывать химические свойства незнакомых органических веществ, опираясь на знание функциональных групп. Развивать у учащихся доказательную речь, умения использовать химическую терминологию, проводить, наблюдать и описывать химический эксперимент. Воспитывать потребности в знаниях о тех веществах, с которыми мы соприкасаемся в жизни.
Методы: словесный, наглядный, практический, проблемно-поисковый, контроль знаний.
Реактивы: ацетилсалициловая кислота (аспирин), вода, хлорид железа(III), раствор глюкозы, универсальный индикатор, раствор сульфата меди (II), раствор гидроксида натрия, яичный белок, этанол, бутанол-1, уксусная кислота, стеариновая кислота.
Оборудование: компьютер, экран, проектор, таблица «Классификация кислородсодержащих органических веществ», опорный конспект «Функциональная группа определяет свойства вещества», ступка с пестиком, стеклянная палочка, спиртовка, пробиркодержатель, воронка, фильтр, стаканы, штатив с пробирками, пипетка, мерный цилиндр на 10 мл.
I. Организационный момент. Сегодня на уроке:
1) Вы закрепите умения предсказывать химические свойства незнакомых органических веществ, опираясь на знание функциональных групп.
2) Вы узнаете, какие известные вам функциональные группы входят в состав самого знаменитого жаропонижающего средства.
3)Вы обнаружите функциональные группы в веществе сладкого вкуса, который применяют в медицине как питательное вещество и компонент кровозамещающих жидкостей.
4) Вы увидите, как можно получить чистое серебро.
5) Мы поговорим о физиологическом воздействии этилового спирта.
6) Мы обсудим последствия употребления алкогольных напитков беременными женщинами.
7) Вы приятно удивитесь: оказывается, вы знаете уже так много!
II. Повторение и обобщение полученных знаний учащихся. 1. Классификация кислородсодержащих органических соединений.
Обобщение материала начинаем с классификации кислородсодержащих органических веществ. Для этого мы воспользуемся таблицей «Классификация кислородсодержащих органических соединений». В ходе фронтальной работы повторим кислородсодержащие функциональные группы.
В органической химии существуют три важнейшие функциональные группы, включающие атомы кислорода: гидроксильная, карбонильная и карбоксильная. Последнюю можно рассматривать как сочетание двух предыдущих. В зависимости от того, с какими атомами или группами атомов связаны данные функциональные группы, кислородсодержащие вещества делятся на спирты, фенолы, альдегиды, кетоны и карбоновые кислоты.
Рассмотрим эти функциональные группы и их влияние на физические и химические свойства веществ.
Просмотр видиофрагмента.
Вы уже знаете, что это не единственно возможный признак классификации. Одинаковых функциональных групп в молекуле может быть несколько, и обратите внимание к соответствующей строке таблицы.
Следующая строка отражает классификацию веществ по типу радикала, связанного с функциональной группой. Хочется обратить внимание на то, что в отличие от спиртов, альдегидов, кетонов и карбоновых кислот гидроксиарены выделяют в отдельный класс соединений – фенолы.
Число функциональных групп и строение радикала определяют общую молекулярную формулу веществ. В данной таблице они приведены только для предельных представителей классов с одной функциональной группой.
Все классы соединений, «уместившиеся» в таблицу, являются монофункциональными, т. е. несут только одну кислородсодержащую функцию.
Для закрепления материала по классификации и номенклатуре кислородсодержащих веществ привожу несколько формул соединений и прошу учащихся определить «их место» в приведенной классификации и дать название.
| формула | Название | Класс вещества |
| 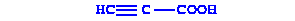
| Пропиновая кислота | Непредельная, одноосновная кислота |
| 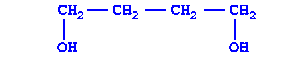
| Бутандиол-1,4 | Предельный, двухатомный спирт |
| 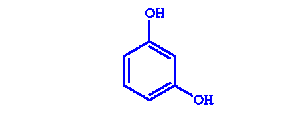
| 1,3-Дигидроксибензол | Двухатомный фенол |
| 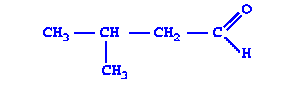
| 3-Метилбутаналь | Предельный альдегид |
| 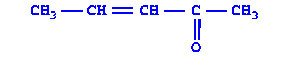
| Бутен-3-он-2 | Непредельный кетон |
| 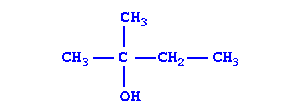
| 2-Метилбутанол-2 | Предельный, одноатомный спирт |
Взаимосвязь строения и свойств кислородсодержащих соединений.
Природа функциональной группы оказывает существенное влияние на физические свойства веществ данного класса и во многом определяет его химические свойства.
В понятие «физические свойства» входит агрегатное состояние веществ.
Агрегатное состояние линейных соединений разных классов:
| Число атомов C в молекуле | Спирты | Альдегиды | Карбоновые кислоты |
| 1 | ж. | г. | ж. |
| 2 | ж. | ж. | ж. |
| 3 | ж. | ж. | ж. |
| 4 | ж. | ж. | ж. |
| 5 | ж. | ж. | ж. |
Гомологический ряд альдегидов начинается с газообразного при комнатной температуре вещества - формальдегида, а среди одноатомных спиртов и карбоновых кислот газов нет. С чем это связано?
Молекулы спиртов и кислот дополнительно связаны друг с другом водородными связями.
Учитель просит учащихся сформулировать определение «водородная связь» (это межмолекулярная связь между кислородом одной молекулы и гидроксильным водородом другой молекулы), корректирует его и при необходимости диктует для записи: химическая связь между электронодефицитным атомом водорода и электроноизбыточным атомом элемента с большой электроотрицательностью (F, O, N) называется водородной.
А сейчас сравните температуры кипения (°C) первых пяти гомологов веществ трех классов.
| Число атомов C в молекуле | Спирты | Альдегиды | Карбоновые кислоты |
| 1 | +64,7 | -19 | +101 |
| 2 | +78,3 | +21 | +118 |
| 3 | +97,2 | +50 | +141 |
| 4 | +117,7 | +75 | +163 |
| 5 | +137,8 | +120 | +186 |
Что можно сказать после рассмотрения таблиц?
В гомологических рядах спиртов и карбоновых кислот отсутствуют газообразные вещества и температуры кипения веществ высокие. Это связано с наличием водородных связей между молекулами. За счет водородных связей молекулы оказываются ассоциированными (как бы сшитыми), поэтому, чтобы молекулы стали свободными и приобрели летучесть, необходимо затратить дополнительную энергию на разрыв этих связей.
Что можно сказать о растворимости спиртов, альдегидов и карбоновых кислот в воде? (Демонстрация растворимости в воде спиртов – этилового, пропилового, бутилового и кислот – муравьиной, уксусной, пропионовой, масляной и стеариновой. Демонстрируется также раствор муравьиного альдегида в воде.)
При ответе используется схема образования водородных связей между молекулами кислоты и воды, спиртов, кислот.
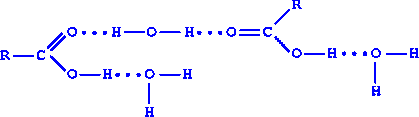
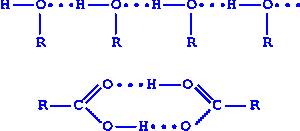
Необходимо отметить, что с увеличением молекулярной массы растворимость в воде спиртов и кислот уменьшается. Чем больше углеводородный радикал в молекуле спирта или кислоты, тем труднее группе OH держать молекулу в растворе за счет образования слабых водородных связей.
3. Генетическая связь между различными классами кислородсодержащих соединений.
Изображаю на доске формулы ряда соединений, содержащих по одному атому углерода:
CH4 → CH3OH → HCOH → HCOOH→ CO2
Почему именно в такой последовательности они изучаются в курсе органической химии?
Как изменяется степень окисления атома углерода?
Учащиеся диктуют строчку: -4, -2, 0, +2, +4
Теперь становится ясно, что каждое последующее соединение является все более окисленной формой предыдущего. Отсюда очевидно, что продвигаться по генетическому ряду слева направо следует с помощью реакций окисления, а в обратном направлении – с использованием процессов восстановления.
Не выпадают ли кетоны из этого «круга родственников»? Конечно, нет. Их предшественники – вторичные спирты.
Химические свойства каждого класса веществ были подробно рассмотрены на соответствующих уроках. Для обобщения этого материала я предложила в качестве домашней работы задания по взаимопревращениям в несколько необычной форме.
1. Соединение с молекулярной формулой C3H8O подвергли дегидрированию, в результате чего получили продукт состава C3H6O. Это вещество вступает в реакцию «серебряного зеркала», образуя соединение C3H6O2. При действии на последнее вещество гидроксидом кальция получили вещество, используемое в качестве пищевой добавки под кодом E 282. Оно препятствует росту плесени в хлебобулочных и кондитерских изделиях и, кроме того, содержится в таких продуктах, как швецарский сыр. Определите формулу добавки E 282, напишите уравнения упомянутых реакций и назовите все органические вещества.
Решение:
CH3 – CH2 – CH2 – OH → CH3 – CH2 – COH + H2 (кат. – Cu, 200-300 °C)
CH3 – CH2 – COH + Ag2O → CH3 – CH2 – COOH + 2Ag (упрощенный вид уравнения, аммиачный раствор оксида серебра)
2CH3 – CH2 – COOH + Сa(OH)2 → (CH3 – CH2 – COO)2Ca + 2H2O.
Ответ: пропионат кальция.
2. Соединение состава C4H8Cl2 с неразветленным углеродным скелетом нагрели с водным раствором NaOH и получили органическое вещество, которое при окислении Cu(OH)2 превратилось в C4H8O2. Определите строение исходного соединения.
Решение: если 2 атома хлора находятся у разных атомов углерода, то при обработке щелочью мы получили бы двухатомный спирт, который не окислялся бы Cu(OH)2. Если 2 атома хлора находились бы при одном атоме углерода в середине цепи, то при обработке щелочью получили бы кетон, который не окисляется Cu(OH)2. Тогда, искомое соединение – 1,1-дихлорбутан.
CH3 – CH2 – CH2 – CHCl2 + 2NaOH → CH3 – CH2 – CH2 – COH + 2NaCl + H2O
CH3 – CH2 – CH2 – COH + 2Cu(OH)2 → CH3 – CH2 – CH2 – COOH + Cu2O + 2H2O
3. При нагревании 19,2 г натриевой соли предельной одноосновной кислоты с гидроксидом натрия образовалось 21,2 г карбоната натрия. Назовите кислоту.
Решение:
При нагревании происходит декарбоксилирование:
R-COONa + NaOH → RH + Na2CO3
υ(Na2CO3) = 21,2 / 106 = 0,2 моль
υ(R-COONa) = 0,2 моль
М(R-COONa) = 19,2 / 0,2 = 96 г/моль
М(R-COOH) = М(R-COONa) – М(Na) + M(H) = 96-23+1= 74 г/моль
В соответствии с общей формулой предельных одноосновных карбоновых кислот для определения количества атомов углерода надо решить уравнение:
12n + 2n + 32= 74
n=3
Ответ: пропионовая кислота.
Для закрепления знаний о химических свойствах кислородсодержащих органических веществ, выполним тест.
Групповая работа учащихся. Задание для 1 группы
Рассмотрите структурные формулы двух веществ, назовите функциональные группы.
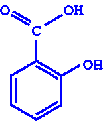
| 
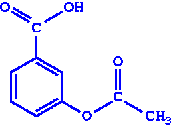
| 
|
| салициловая кислота | ацетилсалициловая кислота (аспирин) |
Проведите лабораторную работу «Обнаружение функциональных групп в молекуле ацетилсалициловой кислоты».
Цели: закрепить знания учащихся о качественных реакциях органических соединений, отработать навыки экспериментального определения функциональных групп.
Реактивы и оборудование: ацетилсалициловая кислота (аспирин), вода, хлорид железа(III); ступка с пестиком, стеклянная палочка, спиртовка, пробиркодержатель, воронка, фильтр, стаканы, штатив с пробирками, пипетка, мерный цилиндр на 10 мл.
Опыт 1. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирине).
В пробирку помещают 2-3 крупинки ацетилсалициловой кислоты, добавляют 1 мл воды и энергично встряхивают. К полученному раствору прибавляют 1-2 капли раствора хлорида железа(III). Что наблюдаете? Сделайте выводы.
Фиолетовое окрашивание не появляется. Следовательно, в ацетилсалициловой кислоте НООС-С6Н4-О-СО-СН3 отсутствует свободная фенольная группа, так как это вещество – сложный эфир, образованный уксусной и салициловой кислотами.
Опыт 2. Гидролиз ацетилсалициловой кислоты.
В пробирку помещают измельченную таблетку ацетилсалициловой кислоты и добавляют 10 мл воды. Доводят содержимое пробирки до кипения и кипятят в течение 0,5-1 мин. Профильтруйте раствор. Затем к полученному фильтрату прибавляют 1-2 капли раствора хлорида железа(III). Что наблюдаете? Сделайте выводы.
Запишите уравнение реакции:
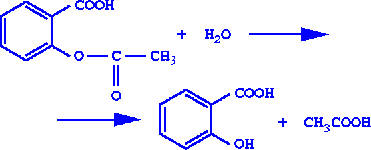
Оформите работу, заполнив таблицу, в которой есть следующие графы: выполняемая операция, реактив, наблюдения, вывод.
Появляется фиолетовое окрашивание, что указывает на выделение салициловой кислоты, содержащей свободную фенольную группу. Как сложный эфир ацетилсалициловая кислота легко гидролизуется при кипячении с водой.
Задание для 2 группы
1. Рассмотрите структурные формулы веществ, назовите функциональные группы.
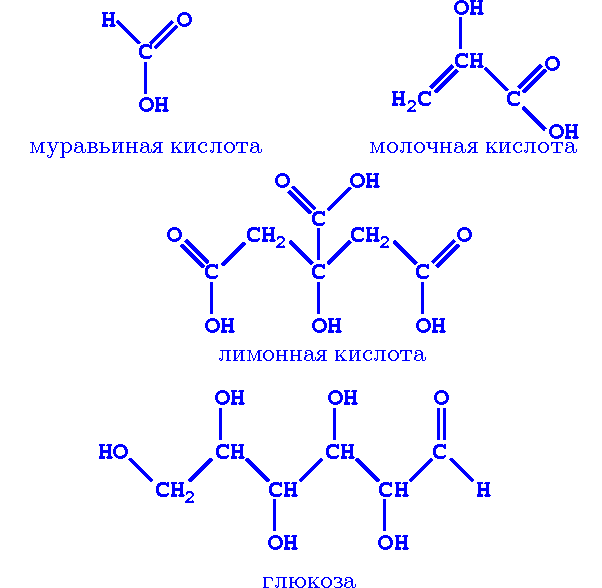
2. Проведите лабораторную работу «Обнаружение функциональных групп в молекуле глюкозы».
Цели: закрепить знания учащихся о качественных реакциях органических соединений, отработать навыки экспериментального определения функциональных групп.
Реактивы и оборудование: раствор глюкозы, универсальный индикатор, раствор сульфата меди (II), раствор гидроксида натрия, спиртовка, пробиркодержатель, спички, мерный цилиндр на 10 мл.
2.1. Налейте в пробирку 2 мл раствора глюкозы. С помощью универсального индикатора сделайте вывод о наличии или отсутствии карбоксильной группы.
2.2. Получите гидроксид меди (II): влейте в пробирку 1 мл сульфата меди (II) и добавьте к нему гидроксид натрия. К полученному осадку прилейте 1 мл глюкозы, встряхните. Что наблюдаете? Для каких функциональных групп характерна данная реакция?
2.3. Полученную в опыте № 2 смесь нагрейте. Отметьте изменения. Для какой функциональной группы характерна данная реакция?
2.4. Оформите работу, заполнив таблицу, в которой есть следующие графы: выполняемая операция, реактив, наблюдения, вывод.
Демонстрационный опыт. Взаимодействие раствора глюкозы с аммиачным раствором оксида серебра.
Результаты работы:
— карбоксильная группа отсутствует, т.к. раствор имеет нейтральную реакцию на индикатор;
— осадок гидроксида меди (II) растворяется и появляется ярко-синее окрашивание, характерное для многоатомных спиртов;
— при нагревании этого раствора выпадает желтый осадок гидроксида меди (I), который при дальнейшем нагревании краснеет, что показывает наличие альдегидной группы.
Вывод. Таким образом, молекула глюкозы содержит карбонильную и несколько гидроксильных групп и представляет собой альдегидоспирт.
Задание для 3 группы
Физиологическое действие этанола
1. Каково действие этанола на живые организмы?
2. Используя имеющиеся на столе оборудование и реактивы, продемонстрируйте влияние этанола на живые организмы. Прокомментируйте увиденное.
Цель опыта: убедить учащихся, что спирт денатурирует белки, необратимо нарушает их структуру и свойства.
Оборудование и реактивы: штатив с пробирками, пипетка, мерный цилиндр на 10 мл, яичный белок, этанол, вода.
Ход опыта: в 2 пробирки налейте по 2 мл яичного белка. В одну добавить 8 мл воды, в другую – столько же этанола.
В первой пробирке белок растворяется, хорошо усваивается организмом. Во второй пробирке образуется плотный белый осадок – в спирте белки не растворяются, спирт отнимает у белков воду. В результате этого нарушаются структура и свойства белка, его функции.
3. Расскажите о влиянии этилового спирта на различные органы и системы органов человека.
Расскажите о последствиях употребления алкогольных напитков беременным женщинам.
III. Домашнее задание.
1. Осуществите превращения:
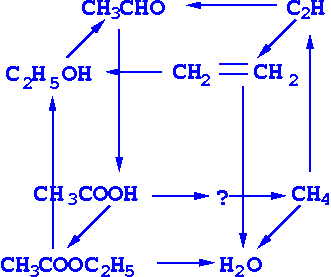
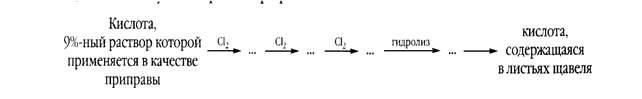
2. Изучите возможные причины загрязнения окружающей среды вблизи производства: метанола, фенола, формальдегида, уксусной кислоты. Проанализируйте влияние этих веществ на природные объекты: атмосферу, водные источники, почву, растения, животных и человека. Опишите меры оказания первой помощи при отравлении.


 Получите свидетельство
Получите свидетельство Вход
Вход



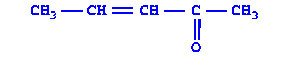








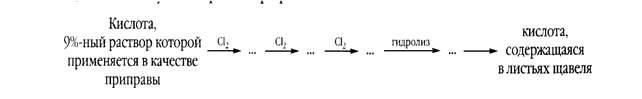









 Урок химии "Органические соединения" (53.16 КB)
Урок химии "Органические соединения" (53.16 КB)
 0
0 1643
1643 173
173 Нравится
0
Нравится
0







