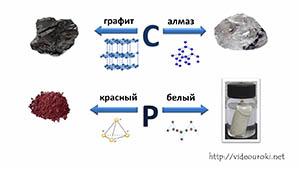
Само название «водородные соединения» говорит о том, что в состав данных соединений входит водород. К таким соединениям относятся гидриды и летучие водородные соединения. Давайте разберемся, в чем их отличие.
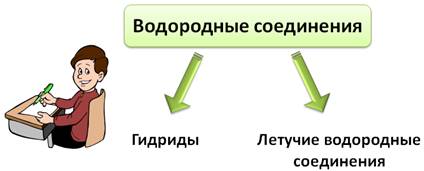
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
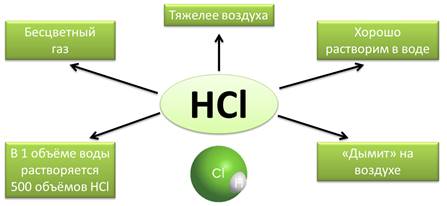
Рассмотрим свойства хлороводорода – HCl. Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное облако.
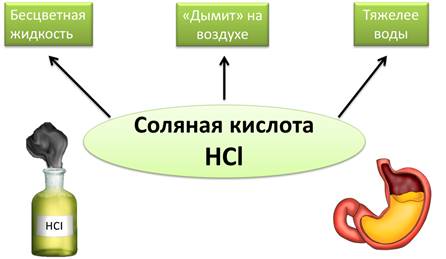
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в желудочном соке человека и некоторых животных.
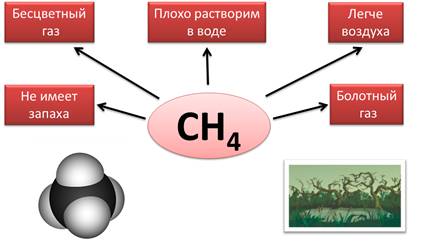
Еще одни важным летучим водородным соединением является метан – СН4. Метан – бесцветный газ, плохо растворим в воде, легче воздуха, не имеет запаха. Его еще называют болотным газом, т.к. он образуется на дне болот и водоемов при разложении растительных остатков без доступа кислорода. Кроме того, метан содержится в природном и попутном нефтяном газе.
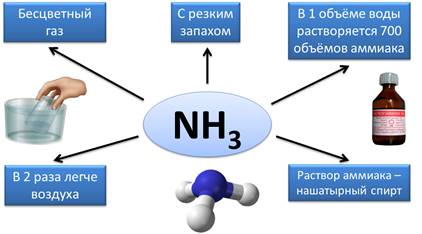
Известным и распространенным водородным соединением является аммиак – NH3. Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется 700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде называют нашатырным спиртом, который широко используют в медицине.
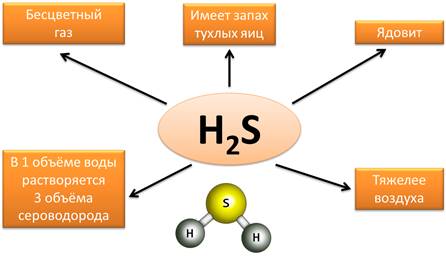
Сероводород – H2S – тоже известное летучее водородное соединение. Он является бесцветным газом, имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма сероводорода, он тяжелее воздуха.
Оксиды
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.

Например: CaO – оксид кальция, K2O – оксид калия, Al2O3 – оксид алюминия. А если элемент имеет несколько степеней окисления или переменную валентность, то после названия оксида в скобках римскими цифрами указывают численное значение степени окисления. Например: Fe2O3 – оксид железа (III) (читается: «оксид железа три»), CuO – оксид меди (II) (читается: «оксид меди два»), CrO3 – оксид хрома (VI) (читается: «оксид хрома шесть»).
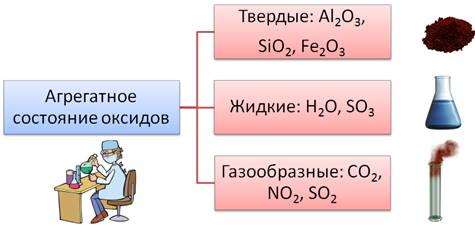
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
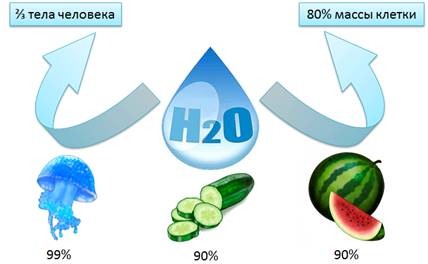
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
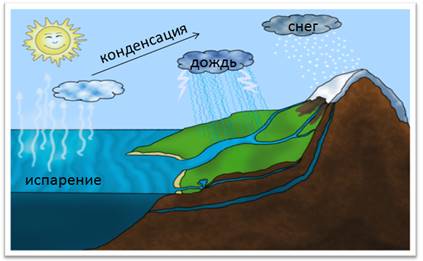
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
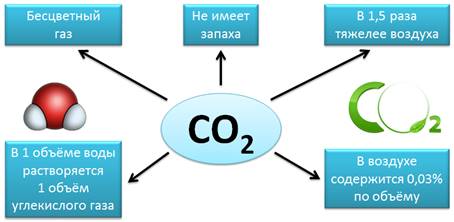
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а твердый диоксид углерода, или «сухой лед» используют для хранения продуктов питания, в частности мороженого. Т.к. углекислый газ не поддерживает горение, его используют для тушения пожаров. В медицине углекислый газ используют для углекислотных ванн.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 34114
34114