Атомы металлов имеют небольшое число электронов на внешнем уровне (от 1 до 3), поэтому эти электроны могут легко отрываться. А нейтральные атомы при этом становятся ионами. Электроны могут свободно перемещаться то к одному иону, то к другому, связывая их в единое целое. Причем электроны, соединяясь с ионами, превращают их в атомы, затем опять отрываются и атомы опять становятся ионами и так постоянно. Их так и называют атом-ионами.
Me0 – nē ↔ Men+

Эти свободные электроны еще называют «электронным газом», они постоянно перемещаются по всему объему металла. Поэтому металлическая связь основана на обобществлении электронов и свободном перемещении их в поле ядер атомов.
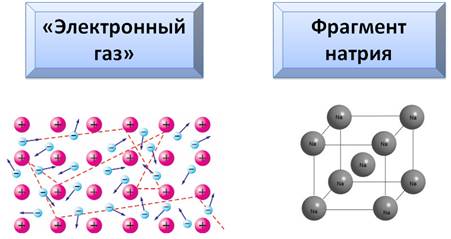
Строение фрагмента металла натрия
Каждый атом натрия окружён восьмью другими атомами. Оторвавшиеся электроны двигаются то к одному, то к другому иону, удерживая при этом весь кристалл.
Металлическая связь имеет сходство и с ковалентной связью. Это сходство основано на обобществлении электронов, но при образовании ковалентной связи обобществляются внешние неспаренные электроны двух соседних атомов, а при образовании металлической в обобществлении участвуют все атомы. Это отличие стало причиной разных физических свойств: вещества с ковалентной связью хрупки, а с металлической –пластичны.
Металлическая связь в металлах и сплавах определяет такие свойства этих соединений, как металлический блеск, ковкость и пластичность, тепло-и электропроводность.
Например, золотая статуэтка оленя, которой уже более 3,5 тыс. лет не потеряла до сих пор своего характерного блеска.

Металлическая связь характерная для металлов и сплавов, находящихся в твердом и жидком агрегатном состоянии, а вот в парообразном, атомы металлов связаны между собой ковалентной связью.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 13951
13951

