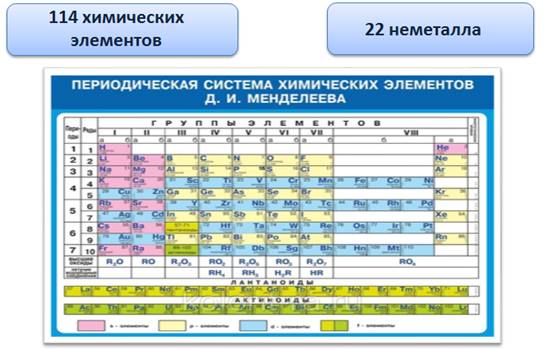
Из 114 химических элементов 22 элемента являются неметаллами. Они располагаются в правом верхнем углу от линии от бора к астату.
Неметаллы, в отличие от металлов, могут быть газами, жидкостями и твёрдыми веществами.
Газами являются элементы VIII A группы. Их ещё называют благородными, или инертными газами. Их молекулы одноатомны. Благородные газы не вступают в реакции друг с другом и другими соединениями. Однако сейчас известно более 150 соединений с инертными газами.
Благородные газы широко используются человеком: гелий используется для заполнения аэростатов и дирижаблей, потому что он легкий и негорючий; неон используют для изготовления световой рекламы.

Газами ещё являются такие вещества, как N2, O2, H2, N2, F2, Cl2.
Единственная жидкость среди неметаллов – это бром (Br2). Это тяжелая бурая жидкость с неприятным запахом.
В твёрдом состоянии находятся сера, углерод, йод, фосфор.

Многие молекулы неметаллов состоят из двух атомов, поэтому в их химической формуле пишется индекс два. К таким молекулам относятся: H2, N2, O2, F2, Cl2, Br2, I2. Их относительная молекулярная масса равна произведению относительной атомной массы на число атомов в молекуле. Например, для того, чтобы найти относительную молекулярную массу брома, мы его относительную атомную массу умножаем на два и получаем результат – 160.
Mr (Br2) = Ar (Br) · 2 = 80 · 2 = 160
Кислород существует не только в виде молекулы О2, но и в виде молекулы О3. Посмотрите, атом один и тот же, а простые веществ различны. Т.е. способность атомов данного химического соединения образовывать несколько простых веществ называют аллотропией. А сами простые вещества – аллотропные видоизменения или модификации.

Сравнение свойств кислорода и озона
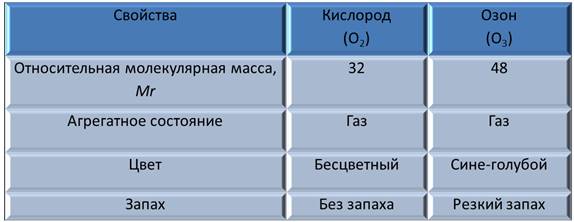
Из таблицы видно, что у кислорода и озона различные относительные молекулярные массы, т.к. число атомов различно, оба находятся в газообразном состоянии, однако кислород не имеет цвета, а озон имеет сине-голубую окраску, кислород не имеет запаха, а озон имеет резкий запах. Из этого, можно сделать вывод, что аллотропные модификации отличаются по своим свойствам.
Аллотропные модификации имеет и углерод. Сравним две его аллотропные модификации – это графит и алмаз. Различие в их свойствах связано с кристаллической решёткой этих соединений.

Фосфор тоже имеет аллотропные модификации – красный и белый фосфор. В составе белого фосфора 4 атома, поэтому его молекулярную формулу можно записать, как Р4.
Все неметаллы, за исключением йода и графита не имеют металлического блеска, однако деление элементов на металлы и неметаллы является относительным. Сравним, например, аллотропию олова (Sn). При комнатной температуре существует бета-олово (β-Sn). Из этого белого олова – металла изготавливали оловянных солдатиков, изнутри покрывали консервные банки, это олово входит в состав припоя и других сплавов. Но при температуре ниже +13,2 0С более устойчиво альфа-олово (α-Sn). Оно напоминает неметалл, т.к. представляет собой серый мелкокристаллический порошок. Белое олово может превратиться в серое при температуре – 33 0С, это явление получило название «оловянная чума».


 Получите свидетельство
Получите свидетельство Вход
Вход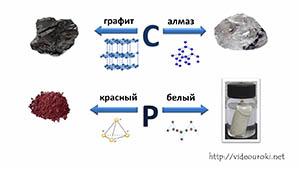



 0
0 18629
18629

