Бинарные соединения еще называют двухэлементными соединениями, потому что «би» от лат. – два. Т.е. бинарные соединения – это сложные вещества, состоящие из двух химических элементов.
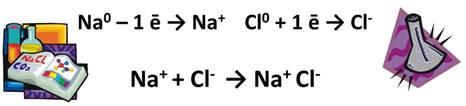
Например, при изучении ионной и ковалентной связи, мы встречали такие соединения. При образовании молекулы NaCl, Na отдаёт свой электрон атому Cl, при этом они оба превращаются в ионы Na+ и Cl-.
Ионное соединение
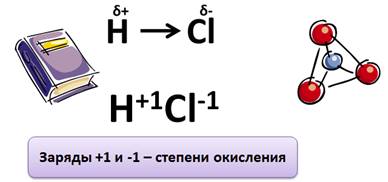
При образовании молекулы HCl, общая пара электронов смещена к атому Cl, т.к. он более электроотрицательный и на атомах появляются частичные заряды: на атоме H+δ, на атоме Cl-δ. Если предположить, что электрон от Н полностью перешёл к атому Cl, то их заряды будет не частичные, а +1 и –1: H+1 и Cl-1. Эти условные заряды и называют степенью окисления.
Ковалентная полярная связь
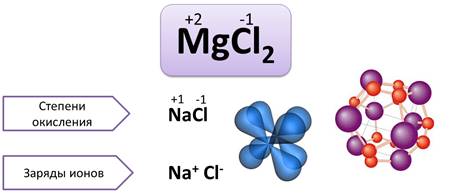
Значения степеней окисления ставят над символом элемента арабской цифрой, впереди которой ставят «+» или «-». Например, MgCl2, степень окисления Mg (+2), Cl (–1). Следует различать степени окисления и заряды ионов. Например, в молекуле NaCl, степень окисления Na (+1), а Cl (–1). В зарядах этих ионов цифры опускают и записывают ионы Na+, Cl-.
Степени окисления
Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит только из ионов.
Степень окисления может быть положительной, отрицательной и нулевой. Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона. Максимальная степень окисления равна номеру группы. Т.е. у N высшая степень окисления равна +5, т.к. он находится в V группе. Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня. Минимальная степень окисления равна № группы – 8. Т.о. у N минимальная степень окисления будет 5 – 8 = –3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления. Например, у N она равна +3.
Нужно знать, что степень окисления простых веществ равна 0, т.е. у N2, H2, S8, Cu, O3 и др. простых веществ она – 0.
Степень окисления F всегда –1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (–1).
У кислорода степень окисления –2, потому что он второй элемент по электроотрицательности, исключение cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (–2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов А групп численно совпадает с валентностью. Например, в соединении Na2O степень окисления Na (+1), т.к. он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его – единица. Аналогично и в соединении BaS, степень окисления Ва (+2), т.к. он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (–1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (–1).
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность – нет.
Валентность – это число связей, которыми атом связан с другими атомами, а степень окисления – это условный заряд атомов.
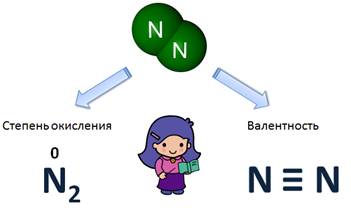
Сравним валентность и степень окисления у азота (N2). Степень окисления равна 0, т.к. это простое вещество, а вот валентность равна III, потому что атом азота связан с другим атомом азота тройной связью.
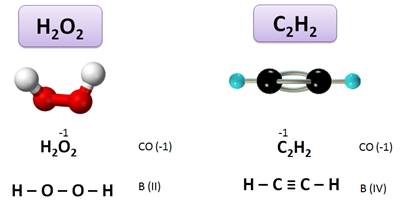
Или в пероксиде (Н2О2) степень окисления О (–1), а валентность равна II, т.к. О связан двумя связями с атомами водорода: Н – О – О – Н.
А в ацетилене (С2Н2) степень окисления С (–1), а валентность IV:
Н – С ≡ С – Н.
Учитывая, что суммарная степень окисления равна 0, можно найти степени окисления элементов в соединении, а также составить формулу соединения, зная степени окисления.
Определим степени окисления элементов в соединении Fe2O3. Степень окисления О нам известна (–2). Следовательно, три атома О будут иметь общий заряд (–6), т.к. (–2) · 3 = –6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3.

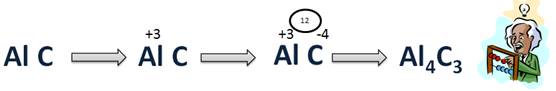
Составим формулу соединения Al с C. Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al – элемент III A группы. Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С – элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (–4). Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы. 12 : 3 = 4, значит индекс у Al – 4, 12 : 4 = 3, значит индекс у С – 3. Следовательно, формула будет Al4C3.
Чтобы дать название бинарному соединению нужно сделать следующим образом: сначала называют более электроотрицательный элемент – это неметалл. Его латинское название стоит в именительном падеже и употребляется с суффиксом – ид. Например: оксид, хлорид, сульфид, нитрид. Второе слово обозначает элемент менее электроотрицательный, его название стоит в родительном падеже.
Например, назовём следующие соединения: Na2S, K2O, BaCl2, Mg3N2.
Na2S – сульфид натрия, K2O – оксид калия, BaCl2 – хлорид бария, Mg3N2 – нитрид магния. Если элемент имеет переменную степень окисления, то после названия в скобках римскими цифрами указывают степень окисления. Например, назовём следующие соединения: MnO2, CO2, P2O5.
MnO2 – оксид марганца (IV), CO2 – оксид углерода (IV), P2O5 – оксид фосфора (V).
Название бинарного соединения

В некоторых случаях, число атомов элементов обозначают при помощи названий числительных на греческом языке. Т.е. 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д. Например, СО – монооксид углерода, или оксид углерода (II); СО2 – диоксид углерода, или оксид углерода (IV).

Для того чтобы химики всего мира понимали друг друга, необходимо было создать единую терминологию и номенклатуру, т.е. названия веществ. Впервые в 1785 г. такими учеными, как А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле, были разработаны принципы номенклатуры. В настоящее время принципы номенклатуры и терминологии разрабатывает Международный союз теоретической и прикладной химии (ИЮПАК).

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 18653
18653

