Реакции обмена – это реакции, в результате которых, два сложных вещества обмениваются своими составными частями.
Запишем реакцию взаимодействия двух сложных веществ: гидроксида натрия и сульфата меди (II). Они должны обменяться своими составными частями, т.е. у натрия вместо гидроксид-иона будет сульфат-ион, а у меди вместо сульфат-иона будет гидроксид-ион. Осталось правильно составить формулы продуктов реакции согласно зарядам. Т.е. образуется сульфат натрия – Na2SO4 и гидроксид меди (II) – Cu(OH)2.

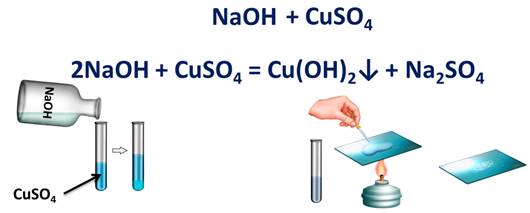
Запишем правило: щелочь + соль = основание + соль
Признаком этой реакции является образование осадка голубого цвета. Этот осадок – гидроксид меди (II), поэтому мы ставим после него стрелку, направленную вниз. Еще образуется соль – сульфат натрия. В этом легко убедится, если отфильтровать садок, а на предметное стекло поместить несколько капель раствора и выпарить. После чего на стекле появятся белые кристаллы соли.
Аналогично обмениваются ионами йодид натрия с нитратом свинца (II). В результате реакции выпадает осадок йодида свинца (II).
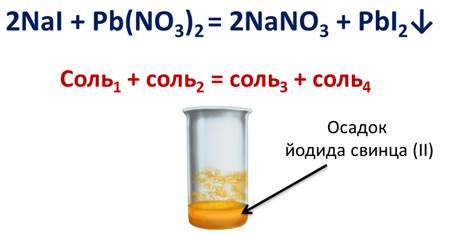
Запишем правило: соль1 + соль2 = соль3 + соль4
Проведем эксперимент. Для этого в пробирку с раствором щелочи добавим несколько капель фенолфталеина. Раствор окрасится в малиновый цвет. Если же к содержимому пробирки добавить кислоты, то малиновая окраска исчезает. Выпарим содержимое полученного раствора. На предметном стекле появляются кристаллы соли. В реакцию у нас вступает щелочь – гидроксид натрия и серная кислота. У гидроксида натрия – гидроксид-ионы, у серной кислоты – сульфат-ионы. Обменяем их ионами, у натрия теперь будут сульфат-ионы, у водорода – гидроксид-ионы. В результате образуется соль – сульфат натрия и вода.

Запишем правило: щелочь + кислота = соль + вода
В каждом из этих растворов была своя седа: у щелочи – щелочная, у кислоты – кислая, а стала нейтральная. Поэтому реакцию обмена между щелочью и кислотой называют реакцией нейтрализации.
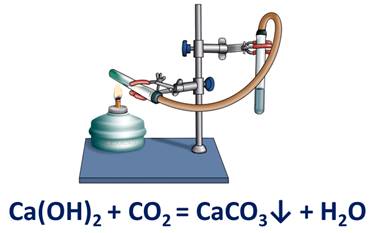
Реакция обмена наблюдается и при взаимодействии известковой воды и углекислого газа. При этом наблюдается помутнение известковой воды вследствие образования осадка – карбоната кальция.
Если в пробирку с карбонатом натрия прилить соляной кислоты, то начинается «вскипание» раствора, вследствие образования углекислого газа. Откуда же углекислый газ, ведь по правилам должна образоваться угольная кислота. Но так как это соединение непрочное, то она распадается на углекислый газ и воду.

Правило: соль + кислота = новая соль + новая кислота
Реакции обмена идут до конца, если в результате их образуется осадок, газ или вода.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 12106
12106

