Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.
2Н2О
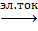 2Н2↑+
О2↑
2Н2↑+
О2↑
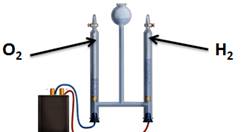
Растения также разлагают воду в процессе фотосинтеза.
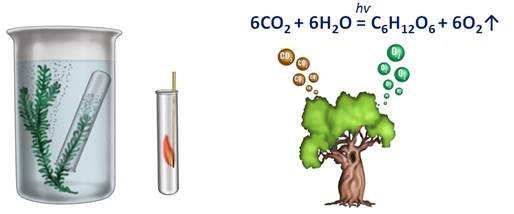
Если веточку водного растения элодеи поместить в специальный прибор и выставить на яркий свет, то уже через 10-15 мин начнет выделяться кислород, в результате разложения воды на свету, т.е. происходит фотолиз воды (фотос – свет, лизос – разложение). Образовавшийся водород вместе с углекислым газом в результате биохимических реакций образует глюкозу. Совокупность всех этих реакций и называют процессом фотосинтеза. В результате фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.
6СО2 + 6Н2О = С6Н12О6 + 6О2↑
Для воды также характерны и реакции соединения. Если в фарфоровую чашечку поместить несколько кусочков негашеной извести, а затем прилить к ним немного воды, то когда вода впитается, над чашечкой появиться пар. Т.о. мы «погасили» негашеную известь водой. В результате этой реакции образуется новое вещество – гашеная известь.
СаО + Н2О = Са(ОН)2
негашеная гашеная
известь известь
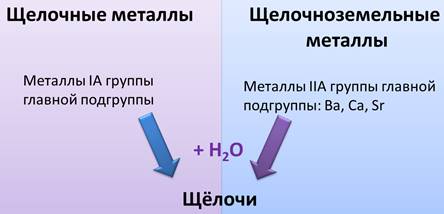
Все оксиды металлов I A группы главной подгруппы и металлы IIA группы: Ca, Ba, Sr при взаимодействии с водой образуют щёлочи. Поэтому металлы I A группы главной подгруппы называют щелочными металлами, а металлы II A группы, как Ba, Ca, Sr – щелочноземельными.
При взаимодействии с водой оксидов неметаллов будут образовываться соответствующие кислоты, где неметалл будет иметь туже степень окисления, как и в оксиде. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, в которой степень окисления фосфора тоже +5.
P2O5 + 3H2O = 2H3PO4
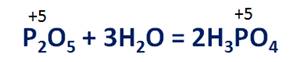
Поэтому, основания и кислородсодержащие кислоты в химии называют гидроксидами.
Вода реагирует с оксидами металлов и неметаллов только в том случае, если образуется растворимый гидроксид. Например, с оксидом калия вода образует растворимое основание – гидроксид калия, а вот с оксидом меди (II) вода не реагирует, т.к. гидроксид меди (II) нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода реагирует с оксидом серы (VI) с образованием серной кислоты, а с оксидом кремния (IV) не реагирует, т.к. кремниевая кислота нерастворимая.
K2O + H2O = 2KOH
CuO + H2O ≠
SO3 + H2O = H2SO4
SiO2 + H2O ≠
Реакции замещения идут тогда, когда с водой реагируют щелочные или щелочноземельные металлы. При взаимодействии натрия с водой образуется щёлочь и водород.
2Na + 2H2O = 2NaOH + H2↑
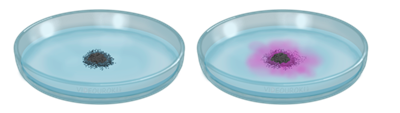
Эту реакцию можно наблюдать в следующем опыте: нальем в чашку Петри воды, добавим туда несколько капель фенолфталеина. Затем поместим маленький кусочек натрия. Кусочек натрия округляется, т.к. начинает плавиться из-за образования большого количества теплоты, «бегает» по поверхности воды, т.к. образующийся водород его выталкивает, раствор при этом окрашивается в малиновый цвет, из-за образования щёлочи.
Реакции обмена с участием воды – это реакции гидролиза. Если в таблице растворимости в клетке стоит прочерк, т.е. вещество в таком случае в водной среде гидролизуется (гидро – вода, лизос – разложение). Например, при гидролизе сульфида алюминия образуется гидроксид алюминия – нерастворимое в воде основание и газ – сероводород.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
При гидролизе карбида кальция образуется газ – ацетилен и щелочь – гидроксид кальция. В этом легко убедиться, если воду добавить кусочек карбида кальция, то можно заметить выделение газа ацетилена, если в образовавшийся раствор капнуть несколько капель фенолфталеина, то он окрасится в малиновый цвет.
Гидролиз протекает и в живых организмах и составляет основу их жизнедеятельности, как гидролиз жиров и белков.
Поэтому вода не только самое важное вещество на планете, но и соединение, обладающее разнообразными химическими свойствами.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 18972
18972

