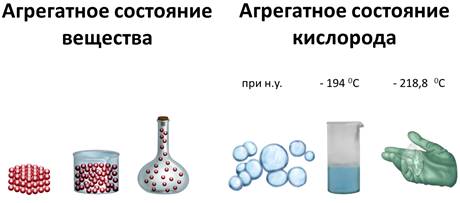
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком, твёрдом. Например, кислород, является газом, но при температуре -194 0С он превращается в голубую жидкость, а при температуре -218,8 0С – затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
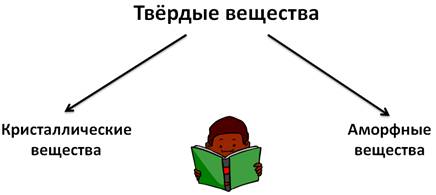
Твёрдые вещества делят на кристаллические и аморфные. Аморфные вещества не имеют четкой температуры плавления, при нагревании размягчаются и переходят в текучее состояние. К аморфным веществам относятся пластмассы, воск, шоколад, пластилин, жевательные резинки.
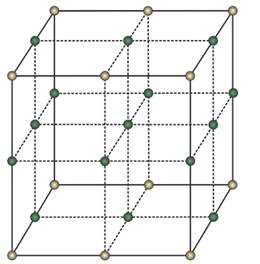
Кристаллические вещества состоят из частиц, которые имеют четкое расположение в определенных точках пространства. Если соединить эти частицы, то получится своеобразный каркас, который называется кристаллической решеткой. А точки, где находятся частицы – узлами кристаллической решетки. В узлах кристаллической решетки могут находиться ионы, атомы, молекулы. Эти частицы совершают колебательные движения. При повышении температуры размах этих колебаний увеличивается, что приводит к тепловому расширению тел.
Кристаллическая решётка
В зависимости от типа частиц в кристаллической решетки и характера связи между ними, различают ионные, атомные, молекулярные и металлические кристаллические решётки.

Ионные кристаллические решётки

Ионными, называются кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионным типом связи. Это соли, основания, некоторые оксиды. Например, кристалл хлорида натрия, построен из чередующихся ионов Na+ и Cl-. Они образуют решётку в виде куба. Связи в этом кристалле очень прочные, поэтому вещества с ионным типом связи имеют высокую твердость и прочность, они нелетучи и тугоплавки.
Атомные кристаллические решётки

Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. Эти атомы между собой соединены очень прочными ковалентными связями. Атомную кристаллическую решётку имеет алмаз. Ограненный и отшлифованный алмаз называют бриллиантом. Он широко используется в ювелирном деле.
Кроме алмаза атомную кристаллическую решётку имеют и такие простые вещества, как бор, кремний, германий, и сложные: кремнезём, кварц, песок, горный хрусталь, в состав которых входит SiO2. Вещества с атомной кристаллической решеткой имеют высокие температуры плавления, они прочные и твёрдые, практически нерастворимые.
Молекулярные кристаллические решётки
Молекулярная кристаллическая решётка – это кристаллическая решетка, в узлах которой находятся молекулы. Связи у веществ с молекулярной кристаллической решёткой могут быть ковалентными полярными, как в молекулах HCl, H2O, и ковалентными неполярными, как в молекулах O2, O3, N2, H2 и др. Атомы внутри молекулы связаны прочно, а вот связи между самими молекулами непрочные. Поэтому вещества с молекулярной кристаллической решеткой имеют малую твердость, низкие температуры плавления и кипения, летучи. К веществам с молекулярной кристаллической решеткой относятся: лед (вода в твердом агрегатном состоянии), который уже при температуре выше 0 0С переходит в жидкое состояние, его кристаллическая структура разрушается; твердый оксид углерода (IV) – «сухой лед», который возгоняется при увеличении температуры, т.е. превращается в газ, твёрдые хлороводород и сероводород, твёрдые простые вещества. Такие как, одноатомные благородные газы, двухатомные молекулы (O2, N2, H2, Cl2, I2), трёхатомные (O3), четырёхатомные, как Р4, восьмиатомные молекулы, как S8. Молекулярную кристаллическую решетку имеют большинство органических веществ: глюкоза, сахар, нафталин, спирт, лимонная кислота.
Металлические кристаллические решётки

Металлическую кристаллическую решётку имеют вещества с металлическим типом связи. В узлах этой кристаллической решетки находятся ионы металла и свободные электроны. Поэтому вещества с этим типом связи обладают ковкостью, пластичностью, имеют металлический блеск, электро- и теплопроводны.
Для веществ молекулярного строения справедлив закон французского химика Ж. Л. Пруста – закон постоянства состава: молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста – основной из законов химии, однако он несправедлив для веществ немолекулярного строения.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 20089
20089