Опорный конспект
Дата ______________ Ф. И. ________________
Урок по теме:________________
Задание №1.
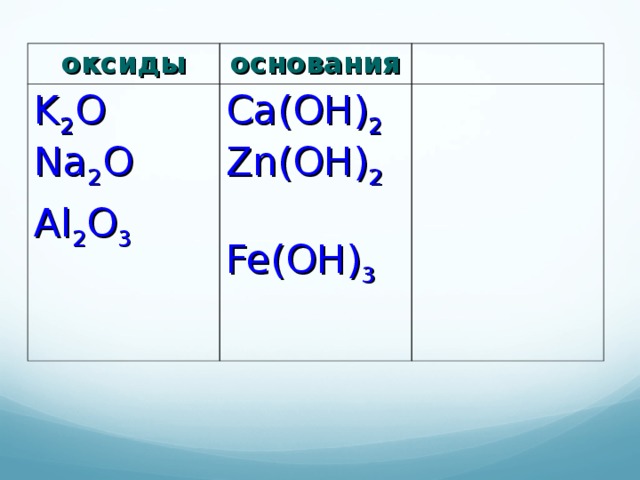
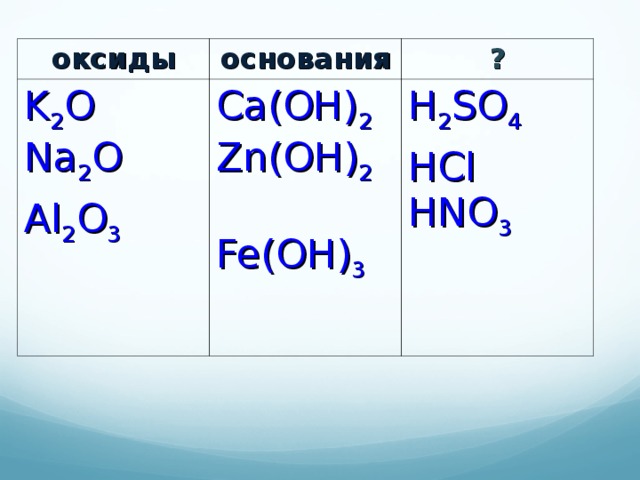
Распределите предложенные формулы по классам:
HCl, HNO3, H2SO4, Ca(OH)2, K2O, Na2O, Al2O3, Zn(OH)2, Al(OH)3.
Таблица 1.
| ОКСИДЫ | ОСНОВАНИЯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
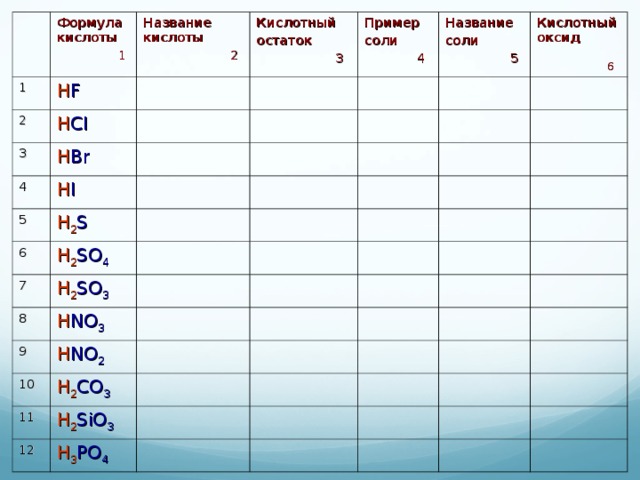
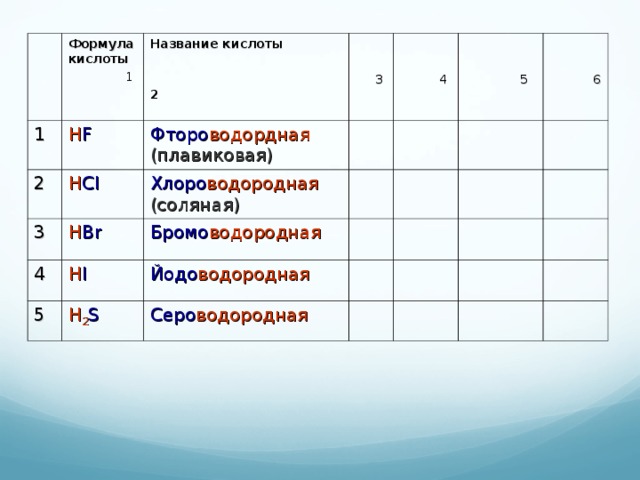
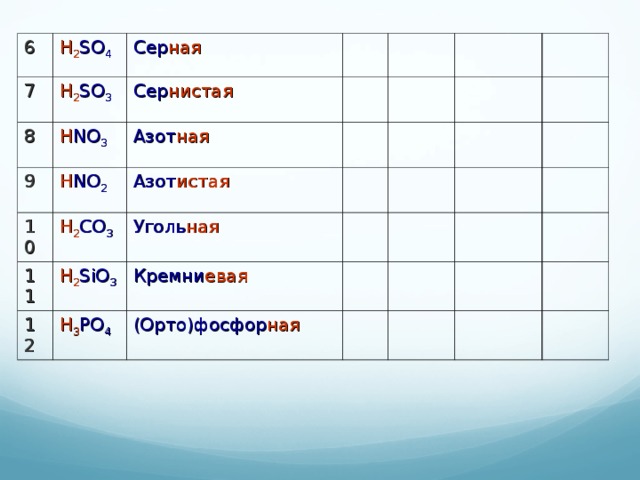
Таблица 2. Номенклатура кислот и солей
|
| Формула кислоты | Название кислоты | Кислотный остаток | Пример соли | Название соли | Кислотный оксид |
| 1 | HF |
|
|
|
|
|
| 2 | HCl |
|
|
|
|
|
| 3 | HBr |
|
|
|
|
|
| 4 | HI |
|
|
|
|
|
| 5 | H2S |
|
|
|
|
|
| 6 | H2SO4 |
|
|
|
|
|
| 7 | H2SO3 |
|
|
|
|
|
| 8 | HNO3 |
|
|
|
|
|
| 9 | HNO2 |
|
|
|
|
|
| 10 | H2CO3 |
|
|
|
|
|
| 11 | H2SiO3 |
|
|
|
|
|
| 12 | H3PO4 |
|
|
|
|
|
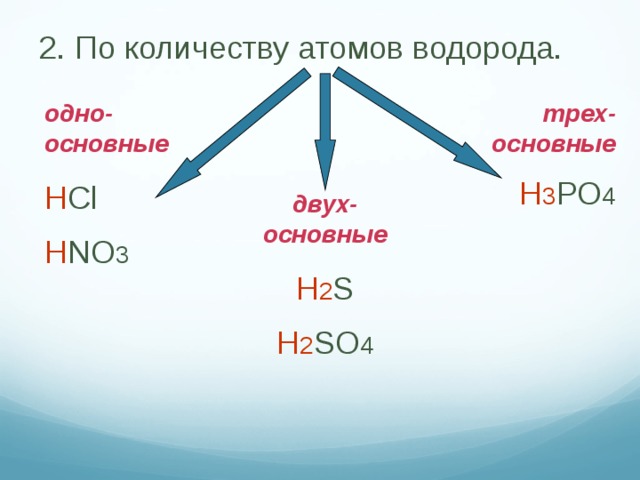
Классификация кислот.
Схема 1. Схема 2.
Кислоты Кислоты




__________ ____________ _____________ ____________
________________
Опыт. Химические свойства кислот.
Налейте в 4 пробирки 1-2мл соляной кислоты HCl и добавьте в пробирки №1 - №3 несколько капель индикаторов, а в пробирку №4 универсальную индикаторную бумагу.
Запишите свои наблюдения в таблицу 3.
Таблица 3. Изменение окраски индикатора.
|
|
ЛАКМУС |
МЕТИЛОВЫЙ ОРАНЖЕВЫЙ |
ФЕНОЛ - ФТАЛЕИН | УНИВЕРСАЛЬНАЯ ИНДИКАТОРНАЯ БУМАГА |
| НЕЙТРАЛЬНАЯ СРЕДА |
|
|
|
|
| КИСЛОТНАЯ СРЕДА |
|
|
|
|
Задание №2
А) Дан «текст», в котором «спрятаны» формулы кислот. Подчеркните и назовите их.
H2OSOHBrNa2CO3MgBaH2CO3SO4KOH
H3PO4P2O5CaH2SHPH3NO2CS2NH3CO3
HClBaSHKSHH2NaOH2SiO3NaClH2SO4
Б) « Третий лишний»
Укажите кислоту, которая не соответствует признаку, объединяющему две другие. Назовите кислоты.
а) H2S б)H2SO4 в)HNO3
HNO3 H3PO4 HF
H3PO4 H2CO3 HBr
Приложение №1
ИНСТРУКТИВНАЯ КАРТА:
Форма работы: парная.
Задание: Исследовать окраску индикаторов в кислотных средах.
Оборудование и реактивы: 2 пробирки с соляной и 2 пробирки с лимонной кислотами, лакмусовая бумажка, жидкие фенолфталеин и метилоранж, стеклянные палочки.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. Не пробовать кислоты на вкус и не нюхать их в близком расстоянии. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1). Перепишите в тетрадь таблицу, представленную в конце опыта.
2). Смочите соляной кислотой (HCl) из 1-ой пробирки лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
3) Затем в эту же пробирку с кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой.
4) Результаты наблюдений запишите в таблицу.
5) Во 2-ую пробирку с соляной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой.
6) Результаты наблюдений запишите в таблицу.
7). Повторите опыты, описанные выше, используя две другие пробирки с лимонной кислотой.
Не забывайте результаты наблюдений фиксировать в таблице!
Приложение № 2
Задание: выпишите отдельно оксиды, кислоты, основания. Назовите вещества.
| | 1 вариант | 2 вариант | З вариант |
| 1 | HNO3 | KOH | Fe2O3 |
| 2 | MgO | Na2SO3 | N2O5 |
| 3 | Cu(OH)2 | H2SO4 | CuSO4 |
| 4 | ZnO | Ca(OH)2 | K2O |
| 5 | SO2 | FeO | HC1 |
| 6 | CO2 | HC1 | Ca(OH)2 |
| 7 | NaCl | K2SO4 | H2S |
| 8 | H2SiO3 | SO3 | FeCl3 |
| 9 | K2CO3 | Na2O | Na3PO4 |
| 10 11 | CuO | P2O5 | NaOH |
4

 Получите свидетельство
Получите свидетельство Вход
Вход








































 УРОК НА ТЕМУ "Кислоты" (4.11 MB)
УРОК НА ТЕМУ "Кислоты" (4.11 MB)
 0
0 797
797 24
24 Нравится
0
Нравится
0



