Цель: образовательная:
Изучить химические свойства характерные для класса кислоты. Познакомить учащихся с электрохимическим рядом напряжения металлов, показать принцип работы с ним. Закрепить и обобщить знания учащихся об особенностях класса неорганических веществ – кислот.
Развивающая: продолжить формирование умений работать с лабораторным оборудованием и реактивами, делать обобщения, использовать учебную литературу.
Воспитательная: продолжить формирование умений работать в группах и формирование научного мировоззрения.
Метод обучения: словесный и сопутствующие ему практический и наглядный.
Тип урока: изучение нового материала.
Оборудование: ящички для проведения лабораторных опытов, пробирки, штативы для пробирок, спиртовки, стеклянные палочки, спички, держатели, химические стаканы, предметные стекла, древесина, ткань.
Реактивы: H2SO4( раствор и концентрированная), сахароза, лакмус, метиловый оранжевый, фенолфталеин, H2O, Zn, Al, Cu, CuO, NaOH, CuSO4, BaCl2.
Ход урока.
Организационный момент.
На прошлом уроке вы начали изучать тему «Кислоты», а точнее поговорили о составе и строении данного касса веществ. Безусловно слово «кислота» впервые вы услышали не на прошлом уроке. Я уверена, что это слово вам знакомо достаточно давно, вы знаете и любите аскорбиновую кислоту, вам известна лимонная кислота, придающая кислый вкус лимону, вы знаете о кислотах, используемых в аккумуляторах и много - много других кислот.
А на прошлом уроке вы узнали о строении и составе молекул кислот.
Давайте повторим то, что вы узнали :
Дайте определение классу кислот.
Исходя из определения выведите общую формулу кислот.
Кислот достаточно много, а можно ли их классифицировать.
Какие вы знаете классификации.
На какие группы делятся кислоты по составу ( приведите примеры).
На какие группы делятся кислоты по оснoвности (приведите примеры).
Существует ли общий принцип составления названий кислот или у каждой кислоты свое индивидуальное название.
(Далее работа с карточками, на которых записаны формулы кислот).
Изучением химических свойств кислот мы и займемся сегодня на уроке.
Запишите в тетради тему сегодняшнего урока «Химические свойства кислот».
1. Но прежде чем говорить о химических свойствах кислот, нам необходимо несколько слов сказать и о физических свойствах.
На демонстрационном столе представлены примеры кислот, вы видите, что по агрегатному состоянию все они жидкости. Однако есть одно исключение, кремниевая кислота по агрегатному состоянию напоминает желе. Цвет кислот – все кислоты бесцветные вещества.
Запах – большинство кислот не обладают запахом однако у некоторых представителей, запах резкий неприятный.
Вкус – вкус кислот заключается в названии всего класса «кислоты – кислые», чтобы убедится, что это действительно так, попробуйте таблетку аскорбиновой кислоты, которая выдана каждому на столе, кроме того проведем и профилактику гриппа.

Запись в тетради:
Физические свойства: а) жидкости (кроме кремниевой кислоты), б) без цвета,
в) без запаха, г) кислые на вкус.
Ну а теперь, наше внимание направлено на химические свойства
Химические свойства.
«Кислоты – едкие вещества, вызывающие сильнейшие ожоги, разрушают органические вещества» - данное высказывание можно часто услышать о кислотах. Так ли это?
Демонстрационные опыты: Надпись на деревянной дощечке.
Разрушение ткани. Я думаю, мы убедились, что кислоты действительно разрушают органические вещества. Запись в тетради: Кислоты разрушают органические вещества.
А как ведут себя кислоты с неорганическими веществами? Чтобы ответить на этот вопрос, вам всем предстоит на некоторое время стать исследователями. Вы все поделены на группы, каждой группе определена своя область исследования и инструкция, как его провести. В каждой группе есть инструктор, который знает по своей теме практически все и будет руководить работой каждой группы.
Необходимо точно по инструкции провести эксперимент, записать в тетради уравнения реакций, ответить на предложенные вопросы.
После окончания исследования один человек из группы рассказывает, что и как проводили, показывает результаты исследования, другой человек из группы записывает уравнение реакции на доске под цифрой, которая соответствует номеру вашего опыта.
К концу урока мы составим подробное описание химических свойств кислот, у каждого ученика оно должно быть в тетради.
Весь материал – смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход


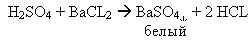 Таким образом, сегодня на уроке мы узнали, что кислоты взаимодействуют с металлами (до водорода), с основными оксидами, с основаниями, с солями, кроме того кислоты изменяют окраску индикаторов и разрушают органические вещества.
Таким образом, сегодня на уроке мы узнали, что кислоты взаимодействуют с металлами (до водорода), с основными оксидами, с основаниями, с солями, кроме того кислоты изменяют окраску индикаторов и разрушают органические вещества.








 Урок химии "Химические свойства кислот" (77.5 КB)
Урок химии "Химические свойства кислот" (77.5 КB)
 0
0 800
800 13
13 Нравится
0
Нравится
0









