Авторы урока: Онищенко Татьяна Борисовна
Предмет: химия
Класс: 9 «Б» класс
Продолжительность урока: 45 минут
Тема урока: Классификация солей.
Технология исследовательской деятельности
Метод: мини-исследование
Автор учебника: учебник «Химия, 8», О.С. Габриелян, М., Дрофа 2014 г.
Тип урока: Урок ознакомления с новым материалом.
Урок проводится семнадцатым в рамках изучения темы 6 «Растворение. Растворы, Свойства растворов электролитов» (35 ч).
На момент изучения темы данного урока обучающиеся знакомы с основными классами неорганических соединений, их составом, основными положениями теории электролитической диссоциации; умеют составлять реакции ионного обмена; пользоваться таблицей растворимости. Данный урок направлен на развитие имеющихся умений, отработку навыка классификации солей. Урок дает возможность повторить взаимодействие кислот и оснований с индикаторами, является пропедевтикой для пониманий генетической связи между классами неорганических веществ.
Цель урока: изучить классификацию солей в свете теории электролитической диссоциации.
Задачи урока: определить понятия «соли», «кислые соли», «средние соли», «основные соли»; познакомить с принципами классификации солей, обучить умению называть соли по формулам; продолжить развитие умения пользоваться таблицей растворимости, проводить химический эксперимент;
развитие умения устанавливать взаимосвязи между веществами, проведения наблюдений, оформления результатов своей работы, осуществлять обобщение и классификацию;
продолжить формирование положительной мотивации на восприятие нового материала, познавательной активности на уроке, умение обсуждать проблемные вопросы в группе и делать выводы.
Формируемые УУД:
Познавательные
Анализ информации.
Использование информации для решения учебной задачи.
Воспроизведение по памяти информации, необходимой для решения учебной задачи.
Презентация информации в наглядном и вербальном виде.
Классификация солей и их номенклатура.
Выделение существенных признаков объекта.
Формулировка вывода.
Установление связи между объектами.
Коммуникативные
Коммуникация.
Умение проявлять эмпатию.
Умение правильно выражать свои мысли письменно и устно.
Умение работать в группе, проводить контроль и взаимоконтроль.
Умение адекватно использовать речь, использовать речевые средства для решения различных коммуникативных задач.
Сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно.
Умение характеризовать качества, признаки объекта, относящие его к определенному классу.
Умение эффективно сотрудничать и способствовать продуктивной кооперации; интегрироваться в группу сверстников и строить продуктивное взаимодействие со сверстниками и взрослыми.
Регулятивные
Умение анализировать условия достижения цели на основе учета выделенных учителем ориентиров действия в новом учебном материале.
Самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности.
В диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Умение адекватно самостоятельно оценивать правильность выполнения действия и вносить необходимые коррективы в исполнение, как в конце действия, так и по ходу его реализации.
Умение осуществлять познавательную рефлексию в отношении действий по решению учебных и познавательных задач.
Личностные
Позитивная моральная самооценка, создание ситуации успешности в обучении. Способность к самооценке.
Умение вести диалог на основе равноправных отношений и взаимного уважения.
Оборудование: на столах учащихся: хим. реактивы, растворы хлорида натрия, сульфата алюминия, карбоната натрия, лакмуса, фенолфталеина, метилового оранжевого, штатив с пронумерованными пробирками, чистые листочки и карточки с заданиями для проведения проверочной работы, таблица с номенклатурой кислот и солей, таблица растворимости, периодическая система.
Ход урока:
Организационный этап:
Мы продолжаем изучение темы «Свойства растворов электролитов»
Вспомните, какие электролиты вы изучили.
Ответы учащихся: Кислоты, основания. Дают их определения.
1 слайд. На экране слова М.В. Ломоносова: “Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции”.
Учитель: Как отличить растворы кислот и оснований?
Ответы учащихся: с помощью реактивов-индикаторов.
Сегодня на уроке нам предстоит выполнить несколько химических опытов.
Вспомните правила по технике безопасности при выполнении лабораторной работы.
Задание: Исследовать с помощью двух индикаторов (по выбору) содержимое пробирок №1-3 (5 мин)
Записать в таблицу: выбранный индикатор, изменение его окраски в различных средах, выводы (определить кислотность среды в растворе:
щелочная, нейтральная, кислая)
| № пробирки | Индикатор | Изменение окраски индикатора | Кислотность среды в растворе |
| № 1 |
|
|
|
| № 2 |
|
|
|
| № 3 |
|
|
|
Индикаторы: лакмус, фенолфталеин, метиловый оранжевый
Учащиеся определяют, что в пробирке №1 кислая среда, в пробирке №2 среда щелочная. В пробирке №3 индикаторы окраску не меняли.
Вопрос: что там может быть? (создание проблемной ситуации и формулирование проблемы учениками)
Учащиеся выдвигают предположения, некоторые ошибочны.
Учитель просит назвать вещества, относящиеся к электролитам. Ответ: к электролитам относят кислоты, основания, соли.
Учащиеся выдвигают предположение, что в пробирке №3 раствор соли.
Учащиеся формулируют тему и задачу урока: рассмотреть состав и классификацию солей. (слайд 2)
Определение солей: Соли - это сложные вещества, состоящие из ионов металлов и кислотных остатков. (слайд 3)
Актуализация знаний
Работа по карточкам (выполняется с помощью раздаточного материала).
Цель: Усовершенствовать умения в составлении формул солей в соответствии со степенью окисления ионов металла и кислотного остатка, повторить номенклатуру солей.
Составьте формулы солей, образованных ионами и дайте их названия. (слайд 4) - 4 мин.
Задание для 1 ученика:
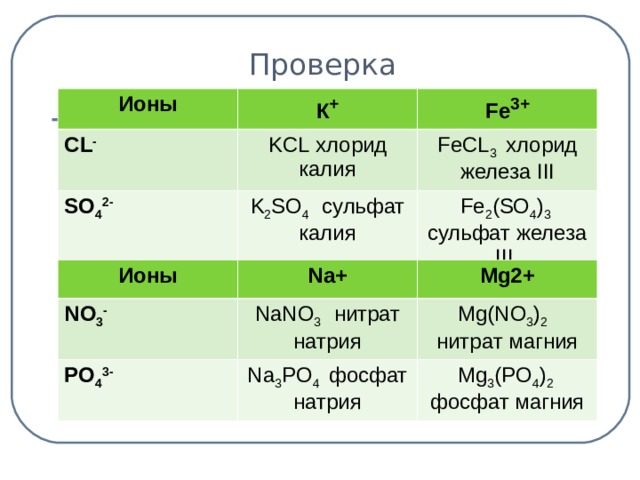
| Ионы | К+ | Fе 3+ |
| CL- |
|
|
| SO4 2- |
|
|
Задание для 2 ученика:
| Ионы | Na+ | Mg2+ |
| NO3- |
|
|
| РО4 3- |
|
|
Проверьте друг у друга правильность выполнения заданий, (слайд 6 )
При выполнении задания используйте данные таблицы «Номенклатура солей»
Раздаточный материал «Номенклатура солей» (слайд 5)
| Название и формула кислот | Кислотный остаток | Название солей | Примеры |
| Азотная HNO3 | NO3- | нитраты | Ca(NO3)2 нитрат кальция |
| Кремниевая H2SiO3 | SiO32- | силикаты | Na2SiO3 силикат натрия |
| Серная H2SO4 | SO42- | сульфаты | PbSO4 сульфат свинца |
| Угольная H2CO3
| CO32- | карбонаты | Na2CO3 карбонат натрия |
| Фосфорная H3PO4 | PO43- | фосфаты | AlPO4 фосфат алюминия |
| Бромоводородная HBr | Br- | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I- | иодиды | KI иодид калия |
| Сероводородная H2S | S2- | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl- | хлориды | NH4Cl хлорид аммония |
| Фтороводородная HF | F- | фториды | CaF2 фторид кальция |
Проверка: (слайд 6) – 4 мин.
| Ионы | К+ | Fe3+ |
| CL- | KCL хлорид калия | FeCL3 хлорид железа III |
| SO42- | K2SO4 cульфат калия | Fe2(SO4)3 сульфат железа III |
| Ионы | Na+ | Mg2+ |
| NO3- | NaNO3 нитрат натрия | Mg(NO3)2 нитрат магния |
| PO43- | Na3PO4 фосфат натрия | Mg3(PO4)2 фосфат магния |
Какие трудности вы испытывали? Что получилось? Что не получилось?
В неорганической химии великое множество солей. Каким образом мы можем их изучить?
Учащиеся отвечают, что надо разделить класс солей на группы, т.е. изучить классификацию солей.
Получение новых знаний
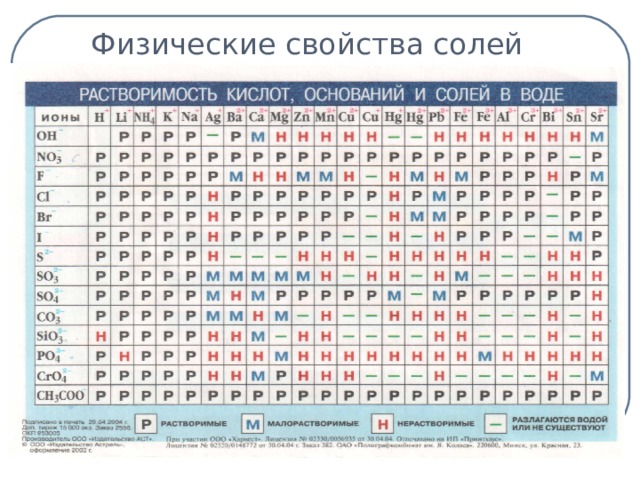
I классификация солей. По какому признаку? (слайд 7)
Учащиеся отвечают: по признаку растворимости.
Практическое задание (работа в парах). 4 мин.
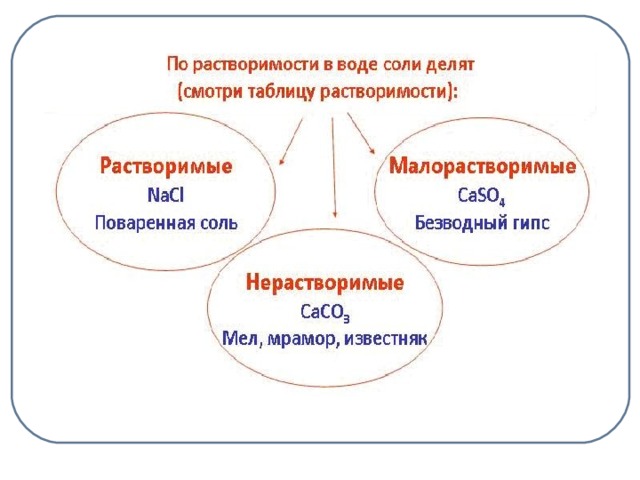
Растворить предложенные вам образцы солей и сделать выводы.
На столах стаканчики с солями: NaCL, CaSO4 , CaCO3.
Учащиеся делают выводы: NaCL – растворимая соль, CaCO3 – нерастворимая, а CaSO4 – малорастворимая. (слайд 8)
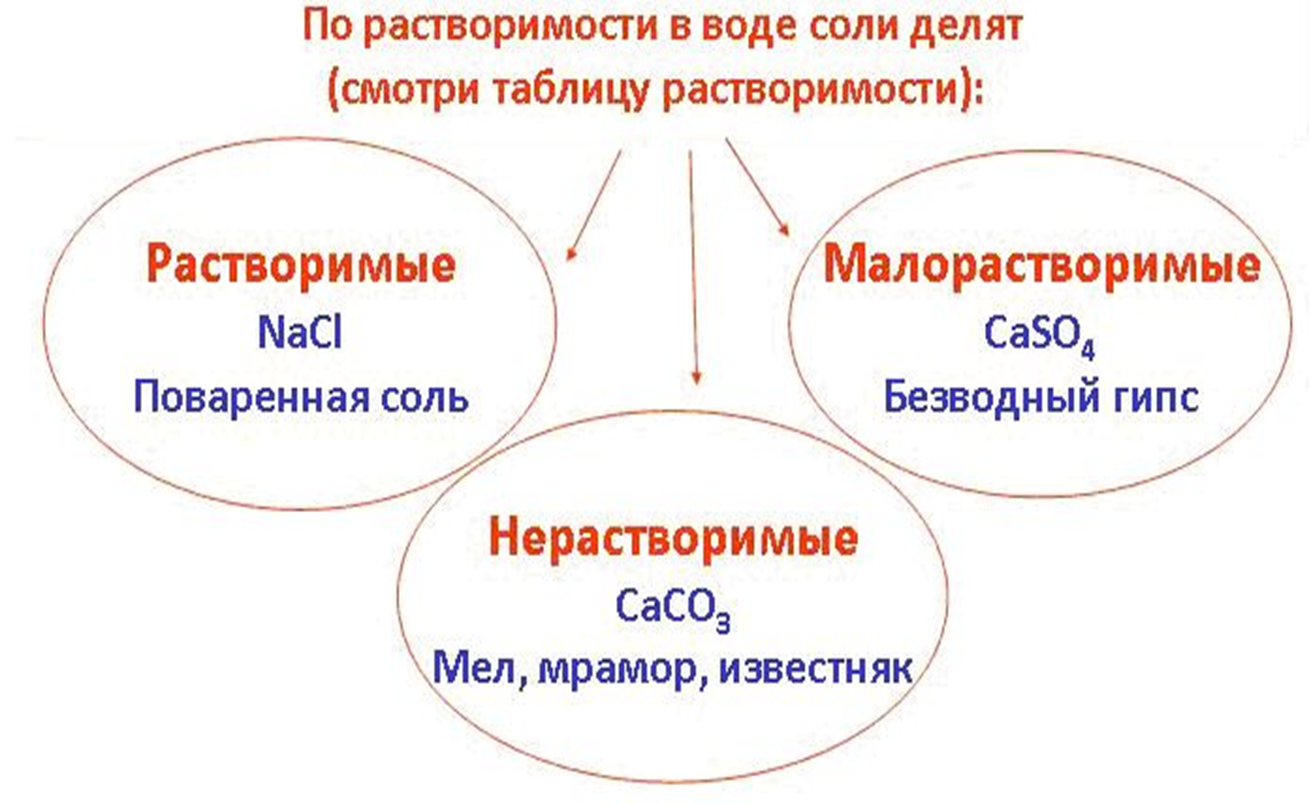
Таблица растворимости (слайд 6)
Поиск решения проблемы учениками
Следующее задание: Изучите предложенные вам схемы строения солей, выявите признак второй классификации, (слайды 9-10). (до 5 мин.) Беседа с использованием слайда:
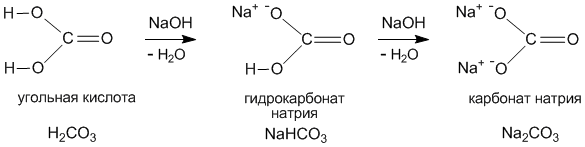
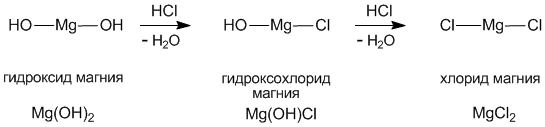
Учащиеся отвечают: Признак классификации – состав солей.
Задание на карточках. Сформулируйте определения с помощью незаконченных предложений. 3 мин.
| Соли | ||
| Средние | Кислые | Основные |
| Средние соли – это продукты __________________ замещения атомов водорода в кислоте на металл. Na2CO3 - карбонат натрия CuSO4 – сульфат меди (ІІ). Диссоциируют соли на катион металла и анион кислотного остатка: Na2CO3 → 2Na+ + CО32- | Кислые соли – это продукты _________замещения атомов _______в кислоте на металл. NaНCO3 – гидрокарбонат натрия КНSO4 – гидросульфат калия. Диссоциируют кислые соли следующим образом: NaНCO3 → Na+ + НCО3- | Основные соли – это продукты неполного замещения гидроксогруппы в ___________на кислотный остаток. СаОНСL – гидроксохлорид кальция (CuОН)2СО3 –гидроксокарбонат меди (ІІ). Диссоциируют основные соли следующим образом: СаОНСL → СаОН+ + СL- |
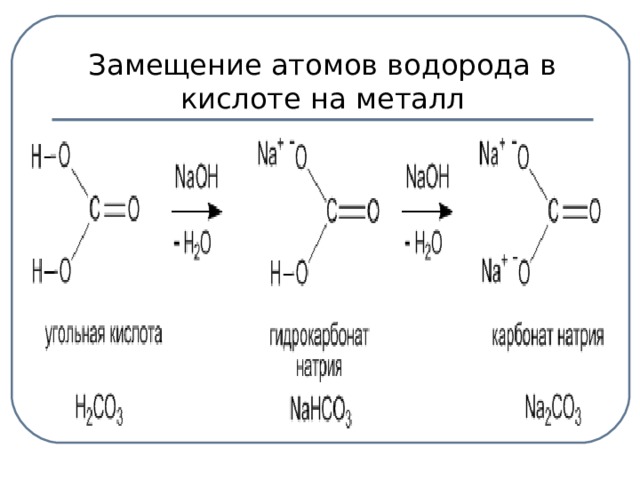
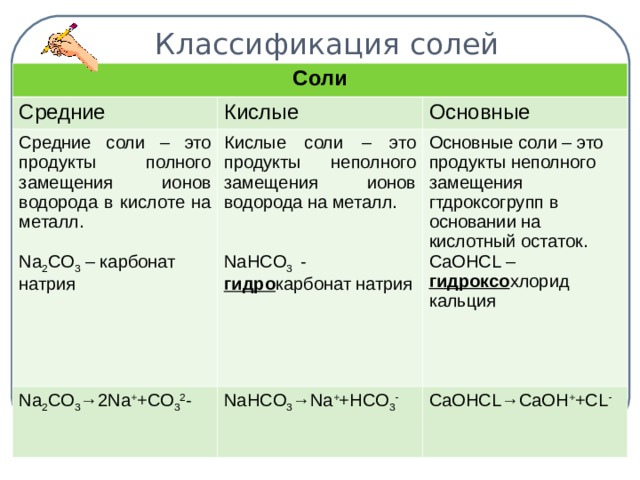
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл.
Кислые соли – это продукты неполного замещения атомов водорода на металл.
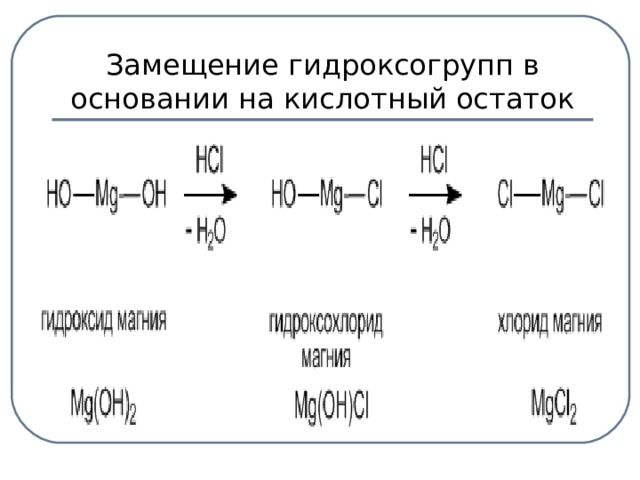
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Проверка (слайд 11 Классификация солей) – 3 мин.
| Соли | ||
| Средние | Кислые | Основные |
| Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Na2CO3 - карбонат натрия CuSO4 – сульфат меди (ІІ). Диссоциируют соли на катион металла и анион кислотного остатка: Na2CO3 → 2Na+ + CО32- | Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. NaНCO3 – гидрокарбонат натрия КНSO4 – гидросульфат калия. Диссоциируют кислые соли следующим образом: NaНCO3 → Na+ + НCО3- | Основные соли – это продукты неполного замещения гидроксогруппы в основании на кислотный остаток. СаОНСL – гидроксохлорид кальция (CuОН)2СО3 –гидроксокарбонат меди (ІІ). Диссоциируют основные соли следующим образом: СаОНСL → СаОН+ + СL- |
Формулируют вывод по достижении цели урока:
Мы повторили номенклатуру солей, познакомились с двумя классификациями солей – по растворимости и по составу.
КОС Тест по теме «Классификация солей»
1. Соли – это:
1) сложные вещества, состоящие из двух химических элементов, один из которых кислород
2) сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп
3) сложные вещества, состоящие из атомов металла и кислотного остатка
4) сложные вещества, состоящие из атомов водорода и кислотного остатка
2. Солью является следующее вещество:
1) SO2 2) Cu(OH)2 3) P2O5 4) Na2SO4
3. Соединение Fe(NO3)2 называется
1) карбонат железа (II)
2) нитрат железа (II)
3) нитрат железа
4) нитрат железа (III)
4. Сульфату свинца (II) соответствует формула
1) PbSO3 2) PbS 3) PbSO4 4) NiSO4
5.Установите соответствие между формулой соли и её названием. Ответ запишите в виде последовательности цифр:
А) BaCl2 1) фосфат натрия
Б) CuOHCl 2) карбонат калия
В) Na3PO4 3) силикат калия
Г) К2СO3 4)гидросульфат кальция
Д) Сa(HSO4)2 5) хлорид бария
6) гидроксохлорид меди
7) сульфат кальция
6.Установите соответствие между классом соли и формулой вещества (ответ запишите в виде последовательности цифр)
| Формула вещества | Класс соли |
| А) MgOHNO3 | 1.основная соль |
| Б) NaHSO3 | 2.средняя соль |
| В) CuCl2 | 3.кислая соль |
| Г) Ca3(PO4)3 |
|
| Д) ZnOHCl |
|
На работу отводится 7 минут. Осуществляется взаимопроверка, вносятся исправления, учащиеся выставляют оценки согласно критериям. На проверку – 2 мин.
Критерии оценок
«3» - 6-7 баллов;
«4» - правильно выбраны большинство заданий (8-9 баллов);
«5» - правильно выполнены задания, допускается 1-2 ошибки в задании №5.(10-12 баллов)
Учитель комментирует результаты данного вида работы.
Ответы:
1 – 3
2 – 4
3 – 2
4 - 3
5: А – 5, Б – 6, В – 1, Г – 2, Д – 4
6: 1 – А,Д, 2 – В, 3 - Б
С какими заданиями справились? (обсуждение 3 мин.)
- знание определения солей (№1)
- умение узнавать соли по составу среди сложных веществ (№2)
- умение называть соли по формулам (№3,4,5)
- умение классифицировать соли (№6)
Какие ошибки допустили?
Достигли ли мы цели? Какие задачи поставим на следующий урок?
Оцените свою работу на уроке.
Рефлексия
1. Теперь я знаю, что…
2. Теперь я знаю, как…
3. Теперь я умею…
В конце урока учитель подводит итог, высказывая свое мнение, выставляет оценки за практическую и теоретическую части (тест).
10

 Получите свидетельство
Получите свидетельство Вход
Вход

















 Урок химии "Классификация солей" (1.91 MB)
Урок химии "Классификация солей" (1.91 MB)
 0
0 701
701 9
9 Нравится
0
Нравится
0




