Задачи:
Образовательные:
Развивать у учащихся способность различать формулы оксидов, оснований, кислот и солей. Сформировать понятие о классе солей. Дать представление о классификации солей.
Познакомить со свойствами и применением солей. Показать значение солей в жизни человека
Развивающие: Развивать интерес к предмету, Развивать умение использовать химическую терминологию. Развивать мыслительные операции. Активизировать речевую и мыслительную деятельности учащихся. Развивать умения наблюдать и делать выводы.
Воспитательные: Прививать интерес к химии.
Оборудование:
Реактивы: нитрат бария, серная кислота, хлорид меди, гидроксид натрия, 2 железных гвоздя на каждый стол, карбонат натрия, хлорид натрия пробирки со штативом.
Сборник задач автор Темирбулатова АЕ Химия для 8 класса
На демонстрационном столе образцы:
1.мел (карбонат кальция)
2.сода техническая (карбонат натрия)
3.медный купорос (сульфат меди)
4.поваренная соль (хлорид натрия )
5. цветные соли (хрома, никеля, меди)
Ход урока
I. Организация класса. Проверка готовности к уроку
2. Проверка знаний. Тест по теме кислоты (два варианта по 5 вопросов)
II.Изучение нового материала
Учитель Мы продолжаем изучение основных классов неорганических соединений и выполняем упражнение
Третий лишний (итог подводит один ученик)
MgCI2 Na2O KNO3
HNO3 H2S NaHCO3
NaOH Cu(OH)2 Mg(OH)CI
CaCO3 CuO ZnCO3
4.Формулировка темы и целей урока (дети формулируют) Учитель уточняет тему урока.
Постановка учебной задачи. Чему мы должны научиться сегодня на уроке? (ученики сами определяли задачи урока)
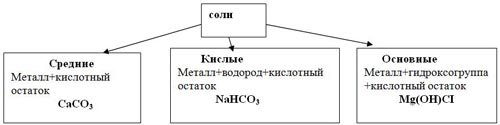
Классификация солей: примеры из упражнения третий лишний
Известняк-CaCO3 – металл + кислотный остаток.
Пищевая сода -NaHCO3- металл + водород + кислотный остаток.
Mg(OH)CI– металл + гидроксо группа + кислотный остаток.
Мы подошли с вами к классификации солей. кластер
III. Первичное закрепление
Фронтальная работа Стр 81 сборник № 4-119 (из перечня веществ выписать соли)
Ответ: Na2SO4 KCI KCIO3 MgCI2 FeS KMnO4
Эксперимент определить в одной из 3х пробирок раствор соли, кислоты, вода
С помощью индикатора можно определить только кислоту. (опережающее задание)
Эксперимент Как отличить: в каком сосуде находится вода, в каком раствор соли? (опережающее задание)
IV.Изучение нового материала
Физические свойства солей Так как соли очень важны, мы должны знать их свойства.
Рассмотрим физические свойства солей агрегатное состояние , (Обсуждаем цвет солей и растворимость в воде).
Химические свойства (1,2) ученик –«учитель» с демонстрацией опытов
- соль + кислота =др. соль + др. кислота Ba(NO3)2 + H2SO4 = (Д.О.)
- соль + щелочь = др. соль + др.основание CuCl2 + NaOH = (Д.О.)
3,4 лабораторная работа(под руководством учителя)
- соль1 + соль2 = соль3 + соль 4 CuSO4 + Na2CO3 = (Л.О.)
Вопрос: почему две соли взаимодействуют, а две другие соли – нет?
- соль + металл =др.соль + др. металл CuSO4 + Fe = (Л.О.)
NaCI + Fe= нет
Вопрос: Все ли металлы способны реагировать с растворами солей?
А теперь сели прямо, закрыли глаза, слушаем.
Валеологическая минута шум моря (приложение 1)
Какое отношение имеет данный фрагмент к теме урока?(морская вода содержит соли)
V.Изучение нового материала
Соли имеют большое практическое значение. (2 ученика делают обзор по приложению 2)
VI .Первичное закрепление
Выводы: (класс)зачитывается конспект с тетради по заголовкам.
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
По составу соли классифицируют на средние, кислые, основные.
Соли твердые вещества различного цвета и различной растворимости в воде.
Соли реагируют с кислотами, щелочами, солями, если выпадает осадок, выделяется газ.
Соли широко распространены в природе, человек их использует в своей жизни.
VII. Закрепление Упражнение 4-142 4-143 Выводы: (класс)
- СuS + HCl =
- Cu(NO3)2 + Mg =
- MgCl2 + Zn=
- MgCl2 + NaOH =
- NaHCO3 + HCl =
- AgNO3 + NaCl =
VIII. Итоги урока оценки
Домашнее задание: п.п. 44-48 повтор оксиды, основания, кислоты, соли повторить п 13 (комментарий)
Рефлексия.
Приложения:

 Получите свидетельство
Получите свидетельство Вход
Вход











 Cоли (14.45 MB)
Cоли (14.45 MB)
 0
0 631
631 234
234 Нравится
0
Нравится
0


