
Содержание
I. Пояснительная записка…………………………………………………………3
II. Общая характеристика учебного предмета…………………………………9
III. Описание места учебного предмета в учебном плане…………………..11
IV. Содержание учебного предмета………………………………………….12
V. Календарно-тематическое планирование………………………………… 16
VI. Описание учебно-методического и материально-технического обеспечения образовательного процесса………………………………………26
VII. Требования к уровню подготовки учащихся…………………………..32
I. Пояснительная записка
Рабочая программа по химии для 11 класса составлена в соответствии с федеральным компонентом государственного образовательного стандарта основного общего образования, утвержденным приказом Минобразования РФ № 1089 от 5 марта 2004 года, на основе программы курса химии автора Н.Н.Гара с внесенными изменениями, не противоречащими требованиям стандарта среднего общего образования по химии и обеспечена УМК авторов Г.Е.Рудзитис, Ф.Г.Фельдман.
Рабочая программа включает разделы: пояснительная записка; общая характеристика учебного предмета; описание места учебного предмета в учебном плане; содержание учебного предмета; календарно-тематическое планирование; описание учебно-методического и материально-технического обеспечения образовательного процесса; требования к уровню подготовки учащихся.
Основными нормативными документами, обеспечивающими реализацию программы, являются следующие:
Федеральный компонент государственного стандарта общего образования (Приказ МО РФ от 05.03.2004 № 1089).
Федеральный базисный учебный план для общеобразовательных учреждений РФ (Приказ МО РФ от 09.03.2004 № 1312).
Примерные программы по химии, разработанные в соответствии с государственными образовательными стандартами 2004 г.
Химия.10-11 классы: программы для общеобразовательных учреждений к комплекту учебников авт.Г.Е.Рудзитиса,Ф.Г.Фельдмана. Автор Н.Н.Гара - М.: Просвещение, 2011.
Санитарно-эпидемиологические правила и нормативы СанПиН 2.4.2.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях», зарегистрированные в Минюсте России 03 марта 2011 года, регистрационный номер 19993.
Приказ Министерства образования и науки Российской Федерации от 31.03.2014 г. № 253 «Об утверждении федерального перечня учебников, рекомендованных к использованию при реализации имеющих государственную аккредитацию образовательных программ начального общего, основного общего, среднего общего образования».
Основная образовательная программа МКОУ «Быковская СОШ» среднего общего образования.
Учебный план МКОУ «Быковская СОШ» на 2014-2015 уч.год.
Химия, как одна из основополагающих областей естествознания, является неотъемлемой частью образования школьников. Изучая химию, учащиеся узнают о материальном единстве всех веществ окружающего мира, обусловленности свойств веществ их составом и строением, познаваемости и предсказуемости химических явлений. Изучение свойств веществ и их превращений способствует развитию логического мышления, а практическая работа с веществами (лабораторные опыты) – трудолюбию, аккуратности и собранности. На примере химии учащиеся получают представления о методах познания, характерных для естественных наук (экспериментальном и теоретическом).
Особое значение имеет воспитание отношения к химии как к элементу общечеловеческой культуры. Школьники должны научиться химически грамотно использовать вещества и материалы, применяемые в быту, сельском хозяйстве и на производстве, решать практические задачи повседневной жизни, предупреждать явления, наносящие вред здоровью человека и окружающей среде.
Изучение химии в старшей школе на базовом уровне направлено:
• на освоение знаний о химической составляющей естественно-научной картины мира, о важнейших химических понятиях, законах и теориях;
• на овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, для оценки роли химии в развитии современных технологий и получении новых материалов;
• на развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
• на воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
• на применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Данная программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета «химия» в старшей школе на базовом уровне являются: умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения и оценки результата); использование элементов причинно-следственного и структурно-функционального анализа; определение сущностных характеристик изучаемого объекта; умение развернуто обосновывать суждения, давать определения, приводить доказательства; оценивание и корректировка своего поведения в окружающей среде; выполнение в практической деятельности и в повседневной жизни экологических требований; использование мультимедийных ресурсов и компьютерных технологий для обработки, передачи, систематизации информации, создания баз данных, презентации результатов познавательной и практической деятельности.
Рабочая программа ориентирована на использование учебно -методического комплекта авторов Г.Е.Рудзитис, Ф.Г.Фельдман. Выбор данного УМК обусловлен тем, что является доступным и учитывает психологические особенности подростков. Материал тщательно отобран для базового изучения химии и имеет логическую последовательность. В основе учебного материала лежит системно-деятельностный подход, что отражает современный взгляд на предмет. Входящий в УМК учебник «Химия. Основы общей химии.11 класс. Базовый уровень/ Рудзитис Г.Е., Фельдман Ф.Г.- 15-е изд.- М.: Просвещение, 2013г.» входит в федеральный перечень учебников, рекомендованных к использованию при реализации имеющих государственную аккредитацию образовательных программ начального общего, основного общего, среднего общего образования, утвержденный приказом Министерства образования и науки Российской Федерации от 31.03.2014 г. № 253 (порядковый номер 1.3.5.3.4.2.). Учебник имеет гриф «Рекомендовано Министерством образования и науки Российской Федерации».
Рабочая программа составлена на основе авторской программы «Химия.10-11 классы: программы для общеобразовательных учреждений к комплекту учебников авт.Г.Е.Рудзитиса,Ф.Г.Фельдмана. Автор Н.Н.Гара - М.: Просвещение, 2011» и с учетом Примерной программы среднего (полного) общего образования по химии (базовый уровень), разработанной в соответствии с ФКГОС. Дополнительный час в неделю, добавленный за счет компонента ОУ, предполагает более полное изучение теоретического материала по предмету в соответствии с авторской программой, а также увеличение времени для практических работ 2, 3, 4, 5 с 1 часа до 2-х часов.
Авторская программа предполагает на изучение материала 70 часов в год, 2 часа в неделю (из расчета 35 учебных недель) по программе (4 часа – резервное время). С учетом 34 недель обучения время изучения предмета составит 68 часов. Распределение часов по темам произведено, в целом, по авторской программе. Запланировано для проведения контрольных работ - 4 часа, практических работ - 9 часов (практические работы 2-5 рассчитаны на 2 часа каждая). Резервное время (9 часов - 2 часа = 7 часов) используется следующим образом:
В соответствии с Примерной программой включена тема Научные методы познания веществ и химических явлений, 1 час.
В тему 4 добавлено 2 часа для изучения окислительно-восстановительных реакций и гидролиза, традиционно вызывающих затруднения у учащихся.
В тему 6 добавлен 1 час для изучения окислительных свойств азотной и серной кислот.
В тему 7 добавлено 2 часа для проведения итогового контроля.
Формулировка названий разделов и тем – соответствует авторской программе.
| №п\п | Наименование раздела (темы), главы | Кол-во часов в авторской программе | Кол-во часов в рабочей программе | Обоснование |
|
| Методы познания в химии | - | 1 | В соответствии с Примерной программой включена тема «Научные методы познания веществ и химических явлений», 1 час. |
|
| Теоретические основы химии |
|
|
|
| 1 | Важнейшие химические понятия и законы | 3 | 3 | --------------------------------- |
| 2
| Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атомов | 4 | 4 | --------------------------------- |
| 3
| Строение вещества | 8 | 8 | -------------------------------- |
| 4 | Химические реакции | 13 | 15 | 2 ч добавлено для изучения окислительно-восстановительных реакций и гидролиза, традиционно вызывающих затруднения у учащихся |
|
| Неорганическая химия |
|
|
|
| 5 | Металлы | 13 | 13 | ____________________ |
| 6 | Неметаллы | 8 | 9 | добавлен 1 час для изучения окислительных свойств азотной и серной кислот |
| 7 | Генетическая связь неорганических и органических веществ. Практикум | 12 | 12 | ____________________ |
|
| Резерв/ Повторение | 7 | 3 | Часы используются для повторения и систематизации изученного материала |
| ИТОГО: | 70 | 68 |
|
Практическая часть курса химии в 11 классе спланирована в соответствии с материальными возможностями кабинета, целесообразностью использования времени урока и включает 5 практических и 6 лабораторных работ.
| Примерная программа (базовый уровень) | Авторская программа | Рабочая программа |
| Лабораторные опыты Проведение реакций ионного обмена для характеристики свойств электролитов. | Лабораторные опыты. Проведение реакций ионного обмена для характеристики свойств электролитов.
| Лабораторный опыт 1 Проведение реакций ионного обмена для характеристики свойств электролитов |
| Лабораторные опыты Определение характера среды раствора с помощью универсального индикатора. |
| Лабораторный опыт 2 Определение характера среды раствора с помощью универсального индикатора. |
| Лабораторные опыты Знакомство с образцами металлов и их рудами (работа с коллекциями). | Лабораторные опыты Знакомство с образцами металлов и их рудами (работа с коллекциями). | Лабораторный опыт 3 Знакомство с образцами металлов и их рудами
|
| Лабораторные опыты Взаимодействие цинка и железа с растворами кислот и щелочей. | Лабораторные опыты. Взаимодействие цинка и железа с растворами кислот и щелочей.
| Лабораторный опыт 4 Взаимодействие цинка и железа с растворами кислот и щелочей
|
| Лабораторные опыты Знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями). | Лабораторные опыты. Знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями).
| Лабораторный опыт 5 Знакомство с образцами неметаллов и их природными соединениями
|
| Лабораторные опыты Распознавание хлоридов и сульфатов.
| Лабораторные опыты. Распознавание хлоридов, сульфатов, карбонатов | Лабораторный опыт 6 Распознавание хлоридов, сульфатов, карбонатов |
|
| Практическая работа. Влияние различных факторов на скорость химической реакции. | Практическая работа 1 Влияние различных факторов на скорость химической реакции |
| Практическое занятие Решение экспериментальных задач по теме «Металлы и неметаллы». |
| Практическая работа 2 Решение экспериментальных задач по теме «Металлы и неметаллы». |
| Практическое занятие Идентификация неорганических соединений.
| Практикум: решение экспериментальных задач по неорганической химии | Практическая работа 3 Решение экспериментальных задач по неорганической химии |
| Практическое занятие Получение, собирание и распознавание газов. | Практикум: получение, собирание и распознавание газов; | Практическая работа 4 Получение, собирание и распознавание газов |
|
| Практикум: решение практических расчетных задач | Практическая работа 5 Решение практических расчетных задач |
|
| Практическая работа. Приготовление растворов с заданной молярной концентрацией. |
|
|
| Практикум: решение экспериментальных задач по органической химии; | 10 класс |
|
| Практикум: решение экспериментальных задач по определению пластмасс и волокон. | 10 класс |
Приоритетными формами организации учебного процесса являются уроки изучения нового материала, уроки закрепления знаний, комбинированные уроки, уроки обобщения и систематизации знаний, урок-практикум, контрольно-обобщающий урок, урок контроля знаний. При организации процесса обучения в рамках данной программы предполагается применением следующих педагогических технологий обучения: технология критического мышления, технология развивающего обучения с элементами коррекционного обучения, для ряда учеников возможно применение технологии проблемного обучения. Внеурочная деятельность по предмету предусматривается в форме игр, викторин, олимпиад, конкурсов, турниров, проектной деятельности и пр.
Контроль уровня усвоения материала осуществляется по результатам выполнения обучающимися самостоятельных работ, практических работ, контрольных работ, решения расчетных задач, тестовых заданий.
Осуществляется текущий, промежуточный, итоговый контроль. Основным объектом текущего контроля будут умения и навыки, полученные при изучении темы. В процессе текущего контроля используются задания, характерные для формирования практических умений и навыков, индивидуальный и фронтальный опрос, вопросы с кратким или развернутым ответом, практические задания, тесты. Промежуточный контроль проводится после занятий, посвященных какой-либо теме или блоку. Объектом контроля в этом случае будут умения объяснять причинно-следственные связи явлений, используя различные источники, а также опираясь на знания, полученные в этой теме. Формы тематического и итогового контроля – тесты и традиционные контрольные работы. Итоговый контроль призван выявить конечный уровень обученности за весь курс , выполняет оценочную функцию, основан на тестовых заданиях разного уровня.
II. Общая характеристика учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии. Поэтому весь теоретический материал курса химии для старшей школы структурирован по пяти блокам: Методы познания в химии; Теоретические основы химии; Неорганическая химия; Органическая химия; Химия и жизнь.
Содержание этих учебных блоков в авторских программах структурируется по темам и детализируется с учетом авторских концепций, но направлено на достижение целей химического образования в старшей школе.
Ведущая роль в раскрытии содержания курса химии 11 класса принадлежит электронной теории, периодическому закону и системе химических элементов как наиболее общим научным основам химии.
В данном курсе систематизируются, обобщаются и углубляются знания о ранее изученных теориях и законах химической науки, химических процессах и производствах. В этом учащимся помогают различные наглядные схемы и таблицы, которые позволяют выделить самое главное, самое существенное.
Содержание этих разделов химии раскрывается во взаимосвязи органических и неорганических веществ.
Особое внимание уделено химическому эксперименту, который является основой формирования теоретических знаний. В конце курса выделены три практических занятия обобщающего характера: решение экспериментальных задач по органической и неорганической химии, получение, собирание и распознавание газов.
Цель и задачи изучения курса химии:
1) сформировать у обучающихся умения видеть и понимать ценность образования, значимость химического знания для каждого человека независимо от его профессиональной деятельности; умения различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
2) сформировать у обучающихся целостного представления о мире и роли химии в создании современной естественно-научной картины мира; умения объяснять объекты и процессы окружающей действительности — природной, социальной, культурной, технической среды, используя для этого химические знания;
3) приобрести обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков (ключевых компетентностей), имеющих универсальное значение для различных видов деятельности: решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни.
Ведущая роль в раскрытии содержания курса химии 11 класса принадлежит электронной теории, периодическому закону и системе химических элементов как наиболее общим научным основам химии. В данном курсе систематизируются, обобщаются и углубляются знания о ранее изученных теориях и законах химической науки, химических процессах и производствах. В этом учащимся помогают различные наглядные схемы и таблицы, которые позволяют выделить самое главное, самое существенное. Содержание разделов химии раскрывается во взаимосвязи органических и неорганических веществ.
Особое внимание уделено химическому эксперименту, который является основой формирования теоретических знаний.
III. Описание места учебного предмета в учебном плане
Учебный предмет «Химия» относится к предметной области «Естественнонаучные предметы».
В соответствии с федеральным базисным учебным планом для общеобразовательных учреждений РФ (Приказ МО РФ от 09.03.2004 № 1312) на преподавание курса химии в 11 классе отведен 1 час в неделю.
В соответствии с учебным планом МКОУ «Быковская СОШ» на 2014-2015 уч.год из компонента общеобразовательного учреждения добавлен 1 час. В соответствии с годовым календарным учебным графиком МКОУ «Быковская СОШ» на 2014- 2015 уч.год продолжительность учебного года в 11 классе – 34 недели. Таким образом, данная программа рассчитана на преподавание курса химии в 11 классе в объеме 2 часа в неделю, или 68 часов учебных часов.
Программой предусмотрено проведение: контрольных работ - 4 ;
практических работ – 5, четыре из которых представляют собой практикум в конце учебного года и предусматривают решение экспериментальных задач по неорганической химии; решение экспериментальных задач по органической химии; решение практических расчетных задач; получение, собирание и распознавание газов.
| Полугодие | Кол-во практических работ
| Кол-во контрольных работ |
| I | 1 | 1 |
| II | 4 (по 2 часа) | 3 |
| ИТОГО: | 5 | 4 |
В соответствии с календарным учебным графиком МКОУ «Быковская СОШ» на 2014-2015 уч.год в конце учебного года проводится итоговая контрольная работа с целью контроля за освоением программы.
IV. Содержание учебного предмета
МЕТОДЫ ПОЗНАНИЯ В ХИМИИ ( 1 ч)
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тема 1. Важнейшие химические понятия и законы (3 ч)
Атом. Химический элемент. Изотопы. Простые и сложные вещества.
Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях, закон постоянства состава. Вещества молекулярного и немолекулярного строения.
Тема 2. Периодический закон и периодическая система
химических элементов Д. И. Менделеева
на основе учения о строении атомов (4 ч)
Атомные орбитали, s-, p-, d- и f-электроны. Особенности размещения электронов по орбиталям в атомах малых и больших периодов. Энергетические уровни, подуровни. Связь периодического закона и периодической системы химических элементов с теорией строения атомов. Короткий и длинный варианты таблицы химических элементов. Положение в периодической системе химических элементов Д. И. Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов.
Валентность и валентные возможности атомов. Периодическое изменение валентности и размеров атомов.
Расчетные задачи. Вычисления массы, объема или количества вещества по известной массе, объему или количеству вещества одного из вступивших в реакцию или получившихся в результате реакции.
Тема 3. Строение вещества (8 ч)
Химическая связь. Виды и механизмы образования химической связи. Ионная связь. Катионы и анионы. Ковалентная неполярная связь. Ковалентная полярная связь. Электроотрицательность. Степень окисления. Металлическая связь. Водородная связь. Пространственное строение молекул неорганических и органических веществ.
Типы кристаллических решеток и свойства веществ.
Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия.
Дисперсные системы. Истинные растворы. Способы выражения концентрации растворов: массовая доля растворенного вещества,молярная концентрация. Коллоидные растворы. Золи, гели.
Демонстрации. Модели ионных, атомных, молекулярных и металлических кристаллических решеток. Модели молекул изомеров, гомологов. Знакомство с образцами пищевых, косметических, биологических и медицинских золей и гелей.
Расчетные задачи. Вычисление массы (количества вещества, объема) продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества.
Тема 4. Химические реакции (15 ч)
Классификация химических реакций в неорганической и органической химии.
Скорость реакции, ее зависимость от различных факторов. Закон действующих масс. Энергия активации. Катализ и катализаторы. Обратимость реакций. Химическое равновесие. Смещение равновесия под действием различных факторов. Принцип Ле Шателье. Производство серной кислоты контактным способом.
Электролитическая диссоциация. Сильные и слабые электролиты. Кислотно-основные взаимодействия в растворах. Среда водных растворов: кислая, нейтральная, щелочная. Ионное произведение воды. Водородный показатель (pH) раствора.
Гидролиз органических и неорганических соединений.
Демонстрации. Зависимость скорости реакции от концентрации и температуры. Разложение пероксида водорода в присутствии катализатора.
Лабораторные опыты. Проведение реакций ионного обмена для характеристики свойств электролитов. Определение среды раствора с помощью универсального индикатора.
Практическая работа. Влияние различных факторов на скорость химической реакции.
Расчетные задачи. Вычисления массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 5. Металлы (13 ч)
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Общие свойства металлов. Электрохимический ряд напряжений металлов. Общие способы получения металлов. Электролиз растворов и расплавов. Понятие о коррозии металлов. Способы защиты от коррозии.
Обзор металлов главных подгрупп (А-групп) периодической системы химических элементов.
Обзор металлов побочных подгрупп (Б-групп) периодической системы химических элементов (медь, цинк, титан, хром, железо, никель,платина).
Сплавы металлов.
Оксиды и гидроксиды металлов.
Демонстрации. Ознакомление с образцами металлов и их соединений. Взаимодействие щелочных и щелочноземельных металлов с водой.
Лабораторные опыты. Взаимодействие цинка и железа с растворами кислот и щелочей. Знакомство с образцами металлов и их рудами (работа с коллекциями).
Расчетные задачи. Расчеты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного.
Тема 6. Неметаллы (9 ч)
Обзор свойств неметаллов. Окислительно-восстановительные свойства типичных неметаллов. Оксиды неметаллов и кислородсодержащие кислоты. Водородные соединения неметаллов.
Демонстрации. Образцы неметаллов. Образцы оксидов неметаллов и кислородсодержащих кислот. Горение серы, фосфора, железа, магния в кислороде.
Лабораторные опыты. Знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями). Распознавание хлоридов, сульфатов, карбонатов.
Тема 7. Генетическая связь неорганических и органических веществ. Практикум (12 ч)
Генетическая связь неорганических и органических веществ.
Практикум: Решение экспериментальных задач по теме «Металлы и неметаллы».решение экспериментальных задач по неорганической химии; решение практических расчетных задач; получение, собирание и распознавание газов.
ПОВТОРЕНИЕ ( 3 ч)
Учебно-тематический план
| № | Наименование раздела, главы | Кол-во часов | Кол-во п.р. | Кол-во к.р. |
|
| Методы познания в химии | 1 |
|
|
|
| Теоретические основы химии |
|
|
|
| 1 | Важнейшие химические понятия и законы | 3 |
|
|
| 2 | Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атомов | 4 |
|
|
| 3 | Строение вещества | 8 |
|
|
| 4 | Химические реакции | 15 | 1 | 1 |
|
| Неорганическая химия |
|
|
|
| 5 | Металлы | 13 |
| 1 |
| 6. | Неметаллы | 9 |
| 1 |
| 7. | Генетическая связь неорганических и органических веществ. Практикум | 12 | 4 (по 2 ч) |
|
|
| Резерв/ Повторение | 3 |
| 1 |
| Итого | 68 | 5 | 4 |
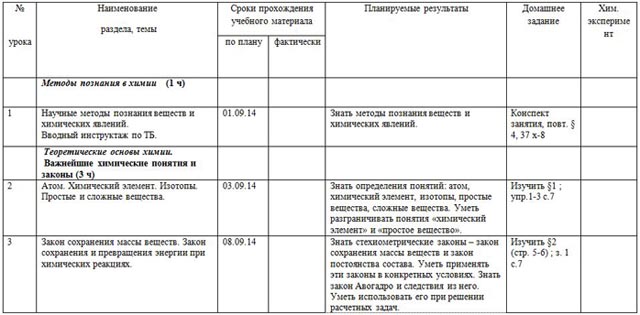
V. Календарно-тематическое планирование
Базовый уровень, 68 часов (2 часа в неделю)
| № урока
| Наименование раздела, темы | Сроки прохождения учебного материала | Планируемые результаты | Домашнее задание | Хим. эксперимент |
| по плану | фактически |
|
| Методы познания в химии (1 ч) |
|
|
|
|
|
| 1 | Научные методы познания веществ и химических явлений. Вводный инструктаж по ТБ. | 01.09.14 |
| Знать методы познания веществ и химических явлений. | Конспект занятия, повт. § 4, 37 х-8 |
|
|
| Теоретические основы химии. Важнейшие химические понятия и законы (3 ч) |
|
|
|
|
|
| 2 | Атом. Химический элемент. Изотопы. Простые и сложные вещества. | 03.09.14 |
| Знать определения понятий: атом, химический элемент, изотопы, простые вещества, сложные вещества. Уметь разграничивать понятия «химический элемент» и «простое вещество». | Изучить §1 ; упр.1-3 с.7 |
|
| 3 | Закон сохранения массы веществ. Закон сохранения и превращения энергии при химических реакциях. | 08.09.14 |
| Знать стехиометрические законы – закон сохранения массы веществ и закон постоянства состава. Уметь применять эти законы в конкретных условиях. Знать закон Авогадро и следствия из него. Уметь использовать его при решении расчетных задач. | Изучить §2 (стр. 5-6) ; з. 1 с.7 |
|
| 4 | Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. | 10.09.14 |
| Знать стехиометрические законы – закон сохранения массы веществ и закон постоянства состава. Уметь применять эти законы в конкретных условиях. Знать закон Авогадро и следствия из него. Уметь использовать его при решении | Изучить §2 (стр. 6-7) ; з. 2 с.7 |
|
|
| Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атома(4 ч) |
|
|
|
|
|
| 5 | Строение электронных оболочек атомов химических элементов | 15.09.14 |
| Знать определения понятий: орбиталь, энергетические уровни, энергетические подуровни, спин; форму электронных орбиталей. Уметь определять максимально возможное число электронов на энергетическом уровне, характеризовать порядок заполнения электронами уровней и подуровней в атомах, записывать электронные формулы атомов. | Изучить §3 (стр.8-13); ДМ т2,р1,в1 |
|
| 6 | Строение электронных оболочек атомов химических элементов | 17.09.14 |
| Изучить §3 (стр.13-14); ДМ т2,р1,в3 |
|
| 7 | Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов | 22.09.14 |
| Уметь объяснять двойственность химических свойств водорода (окислитель и восстановитель) на основе строения его атома. | Изучить § 4 ; ДМ т2,р1,в4; з.1 с.23 | РРЗ Вычисления массы, объема или количества вещества по известной массе, объему или количеству вещества одного из вступивших в реакцию или получившихся в результате реакции. |
| 8 | Валентность. Валентные возможности и размеры атомов химических элементов | 24.09.14 |
| Знать определение валентности с точки зрения теории химической связи. Уметь составлять графические схемы строения внешних электронных слоев атомов, иллюстрирующие валентные возможности атомов P, N, S, O, объяснять пятивалентность фосфора и четырехвалентность азота, характеризовать изменения радиусов атомов ХЭ по периодам и А-группам ПС. | Изучить §5 ( стр.17-23); з. 3-4 стр.23 |
|
|
| Строение вещества ( 8 ч) |
|
|
|
|
|
| 9 | Виды и механизмы образования химической связи | 29.09.14 |
| Уметь использовать ряд электроотрицательности для сравнения ЭО элементов по периодам и А-группам ПСХЭ, уметь объяснять механизмы образования ковалентной и ионной связей. | Изучить § 6 (стр.24-27); в.1-4 стр. 41 |
|
| 10 | Характеристики химической связи | 01.10.14 |
| Знать о количественные характеристики химической связи: энергию связи, длину связи, свойства ковалентной связи: насыщаемость, направленность, типы ковалентной связи: σ –связь и π -связь. | Повт. § 6; конспект занятия |
|
| 11 | Пространственное строение молекул неорганических и органических веществ | 06.10.14 |
| Знать виды гибридизации атомных орбиталей (sp-, sp2- и sp3-гибридизация), зависимость пространственного строения молекул от вида гибридизации (линейная, треугольная и тетраэдрическая форма молекул). | Изучить § 7; упр. 5-6 стр. 41 |
|
| 12 | Типы кристаллических решеток и свойства веществ | 08.10.14 |
| Уметь объяснять зависимость свойств вещества от типа кристаллической решетки. | Изучить § 8 ; ДМ т3,р1 в1 | Д Модели кристаллических решеток |
| 13 | Причины многообразия веществ | 13.10.14 |
| Знать причины многообразия веществ. Уметь объяснять многообразие веществ. | Изучить § 9; з.2 стр. 41; ДМ т3,р1,в3 | Д Модели изомеров, гомологов |
| 14 | Дисперсные системы | 15.10.14 |
| Уметь разъяснять смысл понятия «дисперсная система», характеризовать свойства различных видов дисперсных систем, указывать причины коагуляции коллоидов и значение этого явления. | Изучить § 10(стр.35-41) ; з.3-4 стр.42 | Д Знакомство с образцами пищевых, косметических, биологических и медицинских золей и гелей.
|
| 15 | Решение расчетных задач | 20.10.14 |
| Уметь решать задачи на приготовление раствора с заданной массовой долей растворенного вещества и раствора определенной молярной концентрации. | Повт. § 10; ДМ т3,р2,в2 | РРЗ Вычисление массы (количества вещества, объема) продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества.
|
| 16 | Повторение, обобщение и систематизация изученного материала по темам «Важнейшие химические понятия и законы», «Периодический закон и ПСХЭ на основе учения о строении атомов», «Строение вещества» | 22.10.14 |
| Повторить, обобщить и систематизировать знания по темам «Важнейшие химические понятия и законы», «Периодический закон и ПСХЭ на основе учения о строении атомов», «Строение вещества» | Повт. § 1-10; ДМ ИР в1 стр.91 |
|
|
| Химические реакции ( 15 ч = 13+2) |
|
|
|
|
|
| 17 | Сущность и классификация химических реакций | 27.10.14 |
| Знать признаки классификации химических реакций. Уметь объяснять сущность химических реакций, составлять уравнения химических реакций, относящихся к определенному типу. | Изучить § 11 (стр.43-47); з.1-2 стр.48 |
|
| 18 | Окислительно-восстановительные реакции | 29.10.14 |
| Знать сущность процессов окисления и восстановления. Уметь составлять уравнения окислительно-восстановительных реакций, расставлять коэффициенты методом электронного баланса. | Повт. § 11; ДМ т4, р1, в1 |
|
| 19 | Окислительно-восстановительные реакции. | 10.11.14 |
| Конспект занятия; ДМ т4, р1, в3 |
|
| 20 | Скорость химических реакций. Закон действующих масс. Катализ и катализаторы. | 12.11.14 |
| Знать определение скорости химической реакции. Иметь представление об энергии активации. Уметь объяснять действие факторов, влияющих на скорость реакции, значение применения катализаторов и ингибиторов на практике. | Изучить § 12 (стр.49-55); з.1-2 стр. 63 | Д Зависимость скорости реакции от концентрации и температуры. Д Разложение пероксида водорода в присутствии катализатора |
| 21 | Практическая работа № 1 . Влияние различных факторов на скорость химической реакции. Инструктаж по ТБ. | 17.11.14 |
|
| Повт. § 12; | ТБ Практическая работа 1 (СТР.76) |
| 22 | Химическое равновесие. Принцип Ле Шателье. | 19.11.14 |
| Знать определение состояния химического равновесия, формулировку принципа Ле Шателье, условия смещения химического равновесия . | Изучить § 13 (стр.56-58); з.3 стр.63 |
|
| 23 | Производство серной кислоты контактным способом | 24.11.14 |
| Уметь объяснять на примере производства серной кислоты способы смещения химического равновесия, использование основных принципов химического производства. | Изучить §14 (стр. 58-62); з.4 стр.63 | РРЗ Вычисления массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей. |
| 24 | Электролитическая диссоциация. Сильные и слабые электролиты. | 26.11.14 |
| Знать механизм электролитической диссоциации веществ с ионной и ковалентной полярной связью, определения кислот, оснований и солей с точки зрения представлений об электролитической диссоциации. Уметь составлять полные и сокращенные ионные уравнения реакций, характеризующих основные свойства важнейших классов неорганических соединений. | Изучить § 15 -16(стр. 63-66); з.3 стр.68 |
|
| 25 | Реакции ионного обмена | 01.12.14 |
| Изучить § 17 (стр.68-70); з.1-2 стр.74 | Лабораторный опыт 1 Проведение реакций ионного обмена для характеристики свойств электролитов |
| 26 | Среда водных растворов. Водородный показатель (pН) раствора. | 03.12.14 |
| Знать значение рН среды водных растворов кислот и щелочей. Уметь определять реакцию среды растворов при помощи индикаторов. | Изучить § 16 (стр.66-68); ДМ т4,р3, в1 | Лабораторный опыт 2 Определение характера среды раствора с помощью универсального индикатора.
|
| 27 | Гидролиз органических и неорганических соединений | 08.12.14 |
| Знать определение гидролиза. Уметь составлять уравнения реакций гидролиза сложных эфиров, жиров, углеводов, белков, солей, определять реакцию среды раствора при растворении соли в воде. | Изучить § 18 (стр.70-73);з.3-4 стр.74 |
|
| 28 | Гидролиз органических и неорганических соединений | 10.12.14 |
| Повт. § 18; ДМ т4,р4,в1 |
|
| 29 | Повторение, обобщение и систематизация изученного материала по теме «Химические реакции». Решение расчетных задач | 15.12.14 |
| Повторить, обобщить и систематизировать знания по теме «Химические реакции» .Решение расчетных задач изученных типов | Повт.§ 11-18; ДМ ИР в1 стр.102 |
|
| 30 | Повторение, обобщение и систематизация знаний по разделу «Теоретические основы химии» | 17.12.14 |
| Повторить, обобщить и систематизировать знания по разделу «Теоретические основы химии», решение расчетных задач | Повт. § 1- 18; подг. к к.р. |
|
| 31 | Контрольная работа № 1 по разделу «Теоретические основы химии» | 22.12.14 |
| Контроль знаний по разделу «Теоретические основы химии» |
|
|
|
| Неорганическая химия Металлы ( 13 ч )
|
|
|
|
|
|
| 32 | Анализ контрольной работы № 1. Общая характеристика металлов | 24.12.14 |
| Знать положение металлов в ПСХЭ, особенности строения их атомов. уметь характеризовать общие свойства металлов и разъяснять их на основе представлений о металлической связи и металлической кристаллической решетке. | Изучить конспект урока; стр.77-79; з.1 стр.89 | РРЗ Расчеты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного.
|
| 33 | Химические свойства металлов | 12.01.15 |
| Знать химические свойства металлов. Уметь объяснять активность металлов, используя электрохимический ряд напряжений металлов. | Изучить конспект урока | Д Взаимодействие щелочных и щелочноземельных металлов с водой |
| 34 | Общие способы получения металлов | 14.01.15 |
| Знать общие способы получения металлов. Уметь иллюстрировать способы получения металлов примерами и раскрывать экологические проблемы, связанные с производственными процессами. | Изучить § 19 (стр.79); ДМ т5.р1,в1 | Лабораторный опыт 3 Знакомство с образцами металлов и их рудами |
| 35 | Электролиз растворов и расплавов веществ | 19.01.15 |
| Знать способ получения металлов электролизом растворов и расплавов солей, процессы, происходящие на катоде и аноде, применение электролиза. Уметь составлять суммарное уравнение реакции электролиза. | Изучить § 19 (стр.80-84); з.2-3 стр.89 |
|
| 36 | Понятие о коррозии металлов. Способы защиты от коррозии. | 21.01.15 |
| Знать определение коррозии и сущность этого процесса, способы защиты металлов от коррозии. Уметь различать химическую и электрохимическую коррозию. | Изучить § 20 ( стр.84-88); з.4-5 стр. 89 |
|
| 37 | Металлы главных подгрупп (А-групп) ПСХЭ. | 26.01.15 |
| Знать свойства металлов IA-IIA-групп и алюминия. Уметь характеризовать их общие и специфические свойства, составлять соответствующие уравнения реакций. | Изучить § 21 ( стр.89-93); з.1 стр.98 |
|
| 38 | Металлы главных подгрупп (А-групп) ПСХЭ | 28.01.15 |
| Изучить § 21 (стр. 94-97) ; з.2 стр.98 |
|
| 39 | Металлы побочных подгрупп (Б-групп) ПСХЭ | 02.02.15 |
| Знать положение меди, хрома и железа в ПСХЭ, особенности строения их атомов, физические и химические свойства, применение. Уметь составлять уравнения химических реакций, характеризующих свойства этих металлов. | Изучить § 22 (стр.98-99); з.1 стр.118 | Лабораторный опыт 4 Взаимодействие цинка и железа с растворами кислот и щелочей
|
| 40 | Металлы побочных подгрупп(Б-групп) ПСХЭ | 04.02.15 |
| § 23-27; з.1-4 стр.118 |
| 41 | Сплавы металлов | 09.02.15 |
| Знать состав чугуна и стали, области применения сплавов. | Изучить § 28 ( стр.111-113); |
|
| 42 | Оксиды и гидроксиды металлов | 11.02.15 |
| Знать свойства оксидов и гидроксидов металлов IA-IIIA-групп. Уметь объяснять тенденцию изменения свойств оксидов и гидроксидов по периодам и А-группам ПСХЭ. Знать наиболее типичные степени окисления атомов меди, хрома и железа в оксидах и гидроксидах. Уметь объяснять тенденцию изменения свойств оксидов и гидроксидов одного ХЭ с повышением СО его атома, записывать молекулярные и ионные уравнения химических реакций, подтверждающие кислотно-основные свойства оксидов и гидроксидов металлов. | Изучить § 29 (стр.115-117); з.6 стр.118 |
|
| 43 | Повторение, обобщение и систематизация изученного материала по теме «Металлы» | 16.02.15 |
| Повторить, обобщить и систематизировать знания по теме «Металлы» | Повт. § 19-29; ДМ ИР,т5, в1, стр.118 |
|
| 44 | Контрольная работа № 2 по теме «Металлы» | 18.02.15 |
| Контроль знаний по теме «Металлы» |
|
|
|
| Неметаллы ( 9 ч) |
|
|
|
|
|
| 45 | Анализ контрольной работы № 2. Общая характеристика неметаллов | 25.02.15 |
| Знать положение неметаллов в ПСХЭ, общие и специфические черты строения их атомов. уметь объяснять зависимость свойств простых веществ-неметаллов от вида химической связи и типа кристаллической решетки, записывать уравнения химических реакций, характеризующих свойства неметаллов, объяснять их на основе представлений об окислительно-восстановительных процессах. | Изучить § 30 (стр.119-123); з.1 стр.138 | Д Горение серы, фосфора, железа магния в кислороде Лабораторный опыт 5 Знакомство с образцами неметаллов и их природными соединениями |
| 46 | Водородные соединения неметаллов | 02.03.15 |
| Знать закономерности изменения кислотно-основных свойств водородных соединений неметаллов по периоду и А-группам ПСХЭ. Уметь составлять формулы водородных соединений неметаллов на основании строения атома неметалла и его электроотрицательности, кратко описывать физические и химические свойства водородных соединений неметаллов 2-го и 3-го периодов. | Изучить § 32 (стр. 135-137); з.3 стр. 138 |
|
| 47 | Оксиды неметаллов | 04.03.15 |
| Знать классификацию оксидов и кислот, тенденцию изменения свойств оксидов неметаллов и тенденцию изменения силы кислородсодержащих кислот по периодам и группам. Уметь составлять формулы высших оксидов неметаллов и формулы кислородсодержащих и бескислородных кислот, записывать молекулярные и ионные уравнения реакций, характеризующих общие свойства кислотных оксидов и кислородсодержащих кислот | Изучить § 31 (стр. 128-129); ДМ т6, р1, в1 |
|
| 48 | Кислородсодержащие кислоты | 09.03.15 |
| Изучить § 31 (стр. 130-135); з.2 стр. 138 |
|
| 49 | Окислительные свойства азотной и серной кислот | 11.03.15 |
| Уметь характеризовать окислительные свойства серной и азотной кислот, подтверждая их уравнениями химических реакций. | Повт. § 31; ДМ т6, р2, в1 |
|
| 50 | Окислительные свойства азотной и серной кислот | 16.03.15 |
| Повт. § 31; ДМ т6, р2, в3 |
|
| 51 | Решение качественных и расчетных задач | 18.03.15 |
| Решение задач изученных типов | ДМ стр. 133-134 з.27-36 | РРЗ |
| 52 | Систематизация знаний по теме «Неметаллы» | 01.04.15 |
| Обобщение, систематизация и коррекция знаний по теме «Неметаллы» | Повт. § 30-31; подг. к к.р. | Лабораторный опыт 6 Распознавание хлоридов, сульфатов, карбонатов |
| 53 | Контрольная работа № 3 по теме «Неметаллы» | 06.04.15 |
| Контроль знаний по теме «Неметаллы» |
|
|
|
| Генетическая связь неорганических и органических веществ. Практикум. Повторение (12 ч+ 3 ч) |
|
|
|
|
|
| 54 | Анализ контрольной работы № 3. Генетическая связь неорганических и органических веществ | 08.04.15 |
| Уметь доказывать взаимосвязь неорганических и органических соединений, составлять соответствующие уравнения химических реакций, объяснять их на основе теории электролитической диссоциации и представлений об окислительно-восстановительных процессах. | Изучить § 33 (стр.139-140); упр. стр.143 а) |
|
| 55 | Генетическая связь неорганических и органических веществ | 13.04.15 |
| Повт. § 33 ; упр. стр.143 б) |
|
| 56-57 | Практическая работа № 2. Решение экспериментальных задач по теме «Металлы и неметаллы». Инструктаж по ТБ. | 15.04.15 20.04.15 |
| Уметь составлять план решения экспериментальной задачи, подбирать реактивы и оборудование, собирать простейшие приборы, объяснять решение экспериментальных задач, в которых требуется: а) получить заданные неорганические и органические вещества, собрать их или выделить из раствора, рассчитать практический выход полученного вещества; б) определить с помощью характерных реакций каждое из двух-трех предложенных неорганических и органических веществ; в) провести реакции, подтверждающие качественный состав веществ. | Оформить ПР | ТБ Практическая работа 2 |
| 58-59 | Практическая работа № 3. Решение экспериментальных задач по неорганической химии. Инструктаж по ТБ. | 22.04.15 27.04.15 |
| Оформить ПР | ТБ Практическая работа 3 (стр.144) |
| 60-61 | Практическая работа № 4. Решение практических расчетных задач. Инструктаж по ТБ. | 29.04.15 04.05.15 |
| Оформить ПР | ТБ Практическая работа 4 (стр.145) |
| 62-63 | Практическая работа № 5. Получение, собирание и распознавание газов Инструктаж по ТБ. | 06.05.15 11.05.15
|
| Оформить ПР | ТБ Практическая работа 5 (стр.145) |
| 64 | Бытовая химическая грамотность | 13.05.15 |
| Знать правила пользования веществами, используемыми в быту. Соблюдать бытовую химическую грамотность. | Изучить § 34 (стр.141-143) |
|
| 65 | Повторение, обобщение и систематизация изученного материала по общей химии | 18.05.15 |
| Обобщить, систематизировать и провести коррекцию знаний по курсу общей химии | Повт. § 1-33; ДМ ИР, в1, стр. 135 |
|
| 66 | Итоговая контрольная работа № 4 | 20.05.15 |
| Контроль и коррекция знаний |
|
|
| 67 | Анализ итоговой контрольной работы № 4. Повторение, обобщение и систематизация изученного материала по общей химии | 22.05.15 |
| Обобщить, систематизировать и провести коррекцию знаний по курсу общей химии | ДМ ИР, в4, стр 135-136 |
|
| 68 | Повторение, обобщение и систематизация изученного материала по общей химии. Работа с заданиями части А,В,С КИМов. |
|
| Обобщить, систематизировать и провести коррекцию знаний по курсу общей химии |
|
|
VI. Описание учебно-методического и материально-технического обеспечения образовательного процесса
Оснащение кабинета химии включает оборудование, рабочие места для учащихся и учителя, технические и мультимедийные средства обучения.
Оборудование по химии включает: натуральные объекты (коллекции минералов, горных пород и др.); химические реактивы и материалы; химическая лабораторная посуда, аппараты, приборы; учебные пособия на печатной основе (демонстрационные печатные таблицы, дидактический материал); модели кристаллических решеток; экранно-звуковые средства обучения (видеофильмы, транспаранты), в том числе пособия на дисках; технические средства обучения; учебно-методическую литературу для учителя и учащихся.
Специфика курса химии требует использования оборудования для ознакомления учащихся с методами химической науки. Поэтому лабораторный инструментарий, оборудование для проведения наблюдений и постановки опытов, соответствующие инструкции есть в кабинете. Имеется аптечка с необходимым перечнем медрепаратов.
В рамках обучения большое место отводится электронным пособиям, которые позволяют обеспечить программированное управление процессом обучения , конкретизировать учебный материал, систематизировать и закрепить знания и умения учащихся, проконтролировать их усвоение в ходе урока и по окончании изучения темы, курса. Учащиеся могут пройти тренинг в выполнении различных типов заданий, которые используются для промежуточного и итогового контроля знаний, на ЕГЭ.
Использование ТСО на уроках регламентируется гигиеническими нормативами. Так, продолжительность демонстрации экранных средств обучения на уроке не превышает 20—25 мин, а в течение недели таких уроков может быть не более шести.
Каждое средство обучения обладает определенными возможностями и дополняет другие средства, не заменяя их полностью. Поэтому целесообразно комплексное использование средств обучения, сочетание которых усиливает всестороннее воздействие на учащихся, способствует созданию проблемной ситуации и исследовательскому поиску ее решения, развитию умственной деятельности учащихся, самостоятельности, выработке необходимых умений и навыков.
Учебно-методическое и материально-техническое обеспечение образовательного процесса целесообразнее систематизировать по следующим разделам.
Книгопечатная продукция
Список основной литературы:
Рудзитис, Г. Е. Химия. Основы общей химии. 11 класс: учеб. для общеобразоват. учреждений : базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. - 12-е изд. - М. : Просвещение, 2009,- 159 с. : ил.
Дополнительная литература для учителя:
Гара Н.Н. Химия. Методическое пособие для учителя . Уроки в 11 классе: пособие для учителей общеобразовательных учреждений. – Москва «Просвещение», 2009 – 96с.
Гара Н.Н. Химия. Контрольные и проверочные работы. 10 – 11 классы / Н.Н.Гара. – М.: Дрофа, 2004 г.
Химия.10-11 классы: программы для общеобразовательных учреждений к комплекту учебников авт.Г.Е.Рудзитиса,Ф.Г.Фельдмана. Автор Н.Н.Гара - М.: Просвещение, 2011.
Химия в таблицах и схемах.Издание 2-е.СПб.:ООО «Виктория плюс», 2013.- 96 с.
Химия в школе: научно – методический журнал.- М.: Российская академия образования; изд – во «Центрхимэкспресс». – 2005 – 2014.
Дополнительная литература для учащихся:
Гара Н.Н., Габрусева Н.И. Химия. Задачник с «помощником». 10-11 классы - М.: Просвещение, 2009г.
Кузьменко, И. Е. Тесты по химии. 8-11 классы : учебное пособие / Н. Е. Кузьменко, В. Ерёмин. - М. : Экзамен, 2006.
Радецкий.А.М. Химия. Дидактический материал .10-11 классов: пособие для учителей общеобразовательных учреждений -М.: Просвещение, 2011.- 144 с.
Самое полное издание типовых вариантов реальных заданий ЕГЭ.2014.Химия/ав.-сост. А.С.Корощенко, М.Г.снастина.- М.:Астрель,2013.-187 с.- (ФИПИ).
Савин, Г. А. Олимпиадные задания по органической химии. 10-11 классы / Г. А. Савин. - Волгоград : Учитель, 2004.
Савин, Г. А. Олимпиадные задания по неорганической химии. 9-10 классы / Г. А. Савин. - Волгоград : Учитель, 2003.
Репетитор по химии/ под ред. А.С.Егорова.- Ростов-на-Дону: Феникс, 2010.-762 с.
Химия в таблицах и схемах. Издание 2-е.СПб.:ООО «Виктория плюс», 2013.- 96 с.
Печатные пособия
Таблицы постоянного экспонирования «Периодическая система химических элементов Д.И.Менделеева», «Таблица растворимости кислот, оснований и солей», «Электрохимический ряд напряжений металлов», «Качественные реакции на катионы и анионы», «Классификация веществ».
Комплект портретов для кабинета химии -1 экз.
Комплект учебных таблиц по химии. Раздел «Неорганическая химия» .Серия «Современные наглядные пособия», 2003 г.
Комплект учебных таблиц по биологии. Раздел «Общая химия» .Серия «Современные наглядные пособия», 2003 г.
Компьютерные и ИКТ-средства
Большая энциклопедия Кирилла и Мефодия, 2007.
Электронное приложение к учебнику «Химия -11», разработчик ЗАО «Образование – Медиа»
1С: Репетитор. Химия. Общая и неорганическая. 10-11 класс (учебное электронное издание), Республиканский мультимедиа центр, 2004.
www.edios.ru- Эйдос - центр дистанционного образования.
www.km.ru/education- учебные материалы и словари на сайте «Кирилл и Мефодий».
Технические средства
Учебно-практическое и учебно-лабораторное оборудование
Перечень необходимого оборудования, реактивов для практических и лабораторных работ:
| № рабо ты | Тема | Оборудование | Реактивы | Инструкция |
| ПР 1 | Влияние различных факторов на скорость химической реакции | 11 пробирок, спиртовка, спички, держалка | Zn, HCl 1:3, HCl 1:10, Mg, Cu, CH3COOH, мел кусочками и порошком, | С 76 №1,2,3,4 |
| ЛО 1 | Проведение реакций ионного обмена для характеристики свойств электролитов | 6 пробирок | CuSO4, KOH, NiNO3, Na2S, K2CO3, HCl Na2SO3, H2SO4 NaOH, H2SO4 HNO3, KOH |
|
| ЛО 2 | Определение характера среды раствора с помощью универсального индикатора. | 6 пробирок, лакмусовая бумага, шкала, стеклянная палочка, стакан с водой | HCl, CH3COOH, AlCl3, NaCl, Na2CO3, NaOH | С. 75 |
| ЛО 3 | Знакомство с образцами металлов и их рудами | Коллекция «Минералы и горные породы» «Металлы», «Редкие металлы» |
|
|
| ЛО 4 | Взаимодействие цинка и железа с растворами кислот и щелочей | 4 пробирки | Zn, Fe, NaOH, HCl |
|
| ЛО 5 | Знакомство с образцами неметаллов и их природными соединениями | Образцы неметаллов |
|
|
| ЛО 6 | Распознавание хлоридов, сульфатов, карбонатов | 6 пробирок | NaCl, HCl, AgNO3 Na2SO4, H2SO4,Ba(NO3)2 Na2CO3, CaCO3, HCl |
|
| ПР 2 | Решение экспериментальных задач по теме «Металлы и неметаллы». | MgCO3→MgCl2→Mg(OH)2→MgSO4 Установить, является ли выданная соль хлоридом, иодидом или сульфатом 4 пробирки | MgCO3, HCl, NaOH, H2SO4 KI, AgNO3, Ba(NO3)2, |
|
| ПР 3 | Решение экспериментальных задач по неорганической химии | Спиртовка, спички, держалка, стакан с водой, шпатель, 6 пробирок | Cмесь KCl и FeSO4, AgNO3, NaOH Na2SO4, Na2S, Na2SO3, Ba(NO3)2, CuCl2, HCl Fe | С 144 № 1 № 4а № 5a |
| ПР 4 | Решение практических расчетных задач | Весы с разновесами, шпатель, 4 пробирки | 1,5г порошка Al, H2SO4 5 мл H2SO4, NaOH 3,25 г Zn, HCl 5 мл NaOH, H2SO4 | С 145 |
| ПР5 | Получение, собирание и распознавание газов | Штатив, 4 пробирки с газоотводной трубкой, кристаллизатор с водой, стакан с раствором лакмуса, стакан с известковой водой, спиртовка, держалка, спички, пустые пробирки, лакмусовая бумага, стакан с водой | Zn, HCl, CaCO3, HCl, Ca(OH)2, KMnO4, NH4Cl | С 145 Вар 1 №1 № 2 Вар 2 № 1 № 2 |
VII. Требования к уровню подготовки учащихся
В результате изучения химии на базовом уровне учащийся 11 класса должен
знать/понимать:
• важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
• основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
• важнейшие вещества и материалы: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
уметь:
• называть изученные вещества по тривиальной или международной номенклатуре;
• определять валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
• характеризовать элементы малых периодов по их положению в периодической системе Д. И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
• объяснять зависимость свойств веществ от их состава и строения, природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
• выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
• проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, интернет-ресурсов);
• использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
• объяснения химических явлений, происходящих в природе, быту и на производстве;
• определения возможности протекания химических превращений в различных условиях и оценки их последствий;
• экологически грамотного поведения в окружающей среде;
• оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
• безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
• приготовления растворов заданной концентрации в быту и на производстве;
• критической оценки достоверности химической информации, поступающей из разных источников.
Лист корректировки рабочей программы
| № урока | Тема урока, дата | Причина изменений в программе | Способ корректировки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ
Критерии оценивания
Оценка устного ответа учащихся
Отметка "5" ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
3. Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры устной речи.
Отметка "4":
1. Знание всего изученного программного материала.
2. Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры устной речи.
Отметка "3" (уровень представлений, сочетающихся с элементами научных понятий):
1. Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
2. Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры устной речи.
Отметка "2":
1. Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
2. Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры устной речи.
Оценка выполнения практических работ
Отметка "5" ставится, если ученик:
1. Правильно определил цель опыта.
2. Выполнил работу в полном объеме с соблюдением необходимой последовательности проведения опытов и измерений.
3. Самостоятельно и рационально выбрал и подготовил для опыта необходимое оборудование, все опыты провел в условиях и режимах, обеспечивающих получение результатов и выводов с наибольшей точностью.
4. Научно грамотно, логично описал наблюдения и сформулировал выводы из опыта. В представленном отчете правильно и аккуратно выполнил все записи, таблицы, рисунки, графики, вычисления и сделал выводы.
5. Проявляет организационно-трудовые умения (поддерживает чистоту рабочего места и порядок на столе, экономно использует расходные материалы).
6. Эксперимент осуществляет по плану с учетом техники безопасности и правил работы с материалами и оборудованием.
Отметка "4" ставится, если ученик:
1. Опыт проводил в условиях, не обеспечивающих достаточной точности измерений.
2. Или было допущено два-три недочета.
3. Или не более одной негрубой ошибки и одного недочета.
4. Или эксперимент проведен не полностью.
5. Или в описании наблюдений из опыта допустил неточности, выводы сделал неполные.
Отметка "3" ставится, если ученик:
1. Правильно определил цель опыта; работу выполняет правильно не менее чем наполовину, однако объём выполненной части таков, что позволяет получить правильные результаты и выводы по основным, принципиально важным задачам работы.
2. Или подбор оборудования, объектов, материалов, а также работы по началу опыта провел с помощью учителя; или в ходе проведения опыта и измерений были допущены ошибки в описании наблюдений, формулировании выводов.
3. Опыт проводился в нерациональных условиях, что привело к получению результатов с большей погрешностью; или в отчёте были допущены в общей сложности не более двух ошибок (в записях единиц, измерениях, в вычислениях, графиках, таблицах, схемах, и т.д.) не принципиального для данной работы характера, но повлиявших на результат выполнения.
4. Допускает грубую ошибку в ходе эксперимента (в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с материалами и оборудованием), которая исправляется по требованию учителя.
Отметка "2" ставится, если ученик:
1. Не определил самостоятельно цель опыта; выполнил работу не полностью, не подготовил нужное оборудование и объем выполненной части работы не позволяет сделать правильных выводов.
2. Или опыты, измерения, вычисления, наблюдения производились неправильно.
3. Или в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке "3".
4. Допускает две (и более) грубые ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые не может исправить даже по требованию учителя.
Оценка самостоятельных письменных работ
Отметка "5" ставится, если ученик:
1. Выполнил работу без ошибок и недочетов.
2. Допустил не более одного недочета.
Отметка "4" ставится, если ученик выполнил работу полностью, но допустил в ней:
1. Не более одной негрубой ошибки и одного недочета.
2. Или не более двух недочетов.
Отметка "3" ставится, если ученик правильно выполнил не менее 2/3 работы или допустил:
1. Не более двух грубых ошибок.
2. Или не более одной грубой и одной негрубой ошибки и одного недочета.
3. Или не более двух-трех негрубых ошибок.
4. Или одной негрубой ошибки и трех недочетов.
5. Или при отсутствии ошибок, но при наличии четырех-пяти недочетов.
Отметка "2" ставится, если ученик:
1. Допустил число ошибок и недочетов превосходящее норму, при которой может быть выставлена оценка "3".
2. Или если правильно выполнил менее половины работы.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или не выполнена.
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении; задача не решена.
Оценка выполнения тестовых заданий
Отметка «5»: учащийся выполнил тестовые задания на 91 – 100%.
Отметка «4»: учащийся выполнил тестовые задания на 71 – 90%.
Отметка «3»: учащийся выполнил тестовые задания на 51 – 70%.
Отметка «2»: учащийся выполнил тестовые задания менее чем на 51%.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие отметки за полугодие, год.
6

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа учебного предмета "Химия" для 11 класса (0.26 MB)
Рабочая программа учебного предмета "Химия" для 11 класса (0.26 MB)
 0
0 2937
2937 632
632 Нравится
0
Нравится
0



