«Рассмотрено» «Согласовано» «Утверждено»
Руководитель МО Заместитель Директор МБОУ
_______/ Сисина Г. А. / директора по УВР СОШ №4 г. Агрыз
Протокол № _____ от МБОУ СОШ №4 г. Агрыз ______/ Тимирашева Н.В./
«___»_________ 2014 г. _______/ Сорокина В.П. / Приказ № ____ от
«___» _________2014 г. «___» _________2014 г.
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа №4
г.Агрыз Агрызского муниципального района РТ
РАБОЧАЯ ПРОГРАММА ПО ХИМИИ
8 КЛАСС
Учитель: Хабибова Елена Васильевна
Рассмотрено на заседании
педагогического совета
протокол № _______ от
«___» __________2014 г.
2014-2015 учебный год
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа по предмету «Химия» для 8 класса составлена на основе:
- Федерального компонента государственного образовательного стандарта основного общего образования по биологии утвержденного приказом Минобразования России «Об утверждении федерального компонента государственных стандартов начального общего, основного общего, среднего (полного) общего образования» от 5 марта 2004 года № 1089;
- Примерной программы основного общего образования по химии (Письмо МО и Н РФ от 7 июля 2005 г. № 03-1263 «О примерных программах по учебным предметам федерального базисного учебного плана»);
- Инструктивно-методических писем Министерства образования и науки Республики Татарстан № 1532/9 от 12.03.09 «Об особенностях преподавания химии в условиях перехода на компетентностный подход», № 250/7 от 18.01.2007 г. «О преподавании учебного предмета «Химия» в условиях введения государственного образовательного стандарта общего образования»;
- Программы по химии для общеобразовательных школ, 8 класс, автор О.С. Габриелян.
Согласно учебному плану школы на изучение химии на ступени основного общего образования в 8 классе отводится 2 часа в неделю, 70 часов в год.
Изучение химии в 8 классе направлено на достижение следующих целей:
- освоение важнейших знаний об основных понятиях и законах химии, химической символике;
- овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
- развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
- воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций:
- ученик должен знать:
• важнейшие химические понятия: вещество, химический элемент, атом, молекула, атомная и молекулярная масса, ион, аллотропия, изотопы, химическая связь, валентность, степень окисления, моль, молярная масса, молярный объём, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, скорость химической реакции, катализ;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
• основные теории химии: химической связи электролитической диссоциации;
• важнейшие вещества и материалы: основные металлы, оксиды, кислоты, щёлочи;
- ученик должен уметь:
• называть изученные вещества по «тривиальной» или международной номенклатуре;
• определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединениях;
• характеризовать: элементы малых периодов по их положению в ПСХЭ; общие химические свойства металлов, неметаллов, основных классов неорганических соединений;
• объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической);
• выполнять химический эксперимент по распознаванию важнейших неорганических веществ;
• проводить самостоятельный поиск химической информации с использованием различных источников;
• использовать приобретённые знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту, на производстве;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими веществами, лабораторным оборудованием.
Выполнение данной программы предусматривает использование следующих технологий, форм и методов преподавания химии: личностно-ориентированное обучение, проектная, ИКТ, технология тестирования, самостоятельное изучение основной и дополнительной литературы, проблемное обучение, экспериментальные задания, написание и защита рефератов и др.
При преподавании используются: классноурочная система, практические занятия, применение мультимедийного материала, решение экспериментальных задач.
В рабочей программе предусмотрена система форм контроля уровня достижений учащихся и критерии оценки. Контроль знаний, умений и навыков учащихся - важнейший этап учебного процесса, выполняющий обучающую, проверочную, воспитательную и корректирующую функции. В структуре программы проверочные средства находятся в логической связи с содержанием учебного материала. Реализация механизма оценки уровня обученности предполагает систематизацию и обобщение знаний, закрепление умений и навыков; проверку уровня усвоения знаний и овладения умениями и навыками, заданными как планируемые результаты обучения. Они представляются в виде требований к подготовке учащихся.
Для контроля уровня достижений учащихся используются такие виды и формы контроля как текущий, тематический, итоговый контроль; формы контроля: дифференцированный индивидуальный письменный опрос, тестирование, диктант, письменные домашние задания, компьютерный контроль и т.д.), анализ творческих, исследовательских работ, результатов выполнения диагностических заданий учебного пособия или рабочей тетради.
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций:
- ученик должен знать:
• химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
• важнейшие химические понятия: вещество, химический элемент, атом, молекула, атомная и молекулярная масса, ион, аллотропия, изотопы, химическая связь, валентность, степень окисления, моль, молярная масса, молярный объём, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, скорость химической реакции, катализ;
• основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
- ученик должен уметь:
• называть изученные вещества по «тривиальной» или международной номенклатуре;
• определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединениях;
• характеризовать: элементы малых периодов по их положению в Периодической системе химических элементов Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических соединений;
• составлять: формулы неорганических соединений; схемы строения атомов первых 20 элементов периодической системы; уравнения химических реакций;
• объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической);
• обращаться с химической посудой и лабораторным оборудованием;
• вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества; объем и массу по количеству вещества, объему или массе реагентов или продуктов реакции;
• выполнять химический эксперимент по распознаванию важнейших неорганических веществ;
• проводить самостоятельный поиск химической информации с использованием различных источников;
• использовать приобретённые знания и умения в практической деятельности и повседневной жизни для:
- объяснения химических явлений, происходящих в природе, быту, на производстве;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с лабораторным оборудованием.
Рабочая программа по химии в 8 классе включает в себя следующее содержание:
МЕТОДЫ ПОЗНАНИЯ ВЕЩЕСТВ И ХИМИЧЕСКИХ ЯВЛЕНИЙ
Химия как часть естествознания. Химия – наука о веществах, их строении, свойствах и превращениях.
Наблюдение, описание, измерение, эксперимент, моделирование. Понятие о химическом анализе и синтезе.
Проведение расчетов на основе формул и уравнений реакций: 1) массовой доли химического элемента в веществе; 2) массовой доли растворенного вещества в растворе; 3) количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции.
ВЕЩЕСТВО
Атомы и молекулы. Химический элемент. Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава.
Относительные атомная и молекулярная массы. Атомная единица массы. Количество вещества, моль. Молярная масса. Молярный объем.
Чистые вещества и смеси веществ. Природные смеси: воздух, природный газ, нефть, природные воды.
Качественный и количественный состав вещества. Простые вещества (металлы и неметаллы). Сложные вещества (органические и неорганические). Основные классы неорганических веществ.
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы.
Строение атома. Ядро (протоны, нейтроны) и электроны. Изотопы. Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева.
Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная и неполярная), ионная, металлическая. Понятие о валентности и степени окисления. Составление формул соединений по валентности (или степени окисления).
Вещества в твердом, жидком и газообразном состоянии. Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная и металлическая).
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция. Условия и признаки химических реакций. Сохранение массы веществ при химических реакциях.
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления химических элементов; поглощению или выделению энергии. Понятие о скорости химических реакций. Катализаторы.
Электролитическая диссоциация веществ в водных растворах. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей. Реакции ионного обмена.
Окислительно-восстановительные реакции. Окислитель и восстановитель.
ЭКСПЕРИМЕНТАЛЬНЫЕ ОСНОВЫ ХИМИИ
Правила работы в школьной лаборатории. Лабораторная посуда и оборудование. Правила безопасности.
Разделение смесей. Очистка веществ. Фильтрование.
Взвешивание. Приготовление растворов. Получение кристаллов солей. Проведение химических реакций в растворах.
Нагревательные устройства. Проведение химических реакций при нагревании.
ХИМИЯ И ЖИЗНЬ
Человек в мире веществ, материалов и химических реакций.
Химическое загрязнение окружающей среды и его последствия.
Критерии и нормы оценочной деятельности.
Оценка “5” ставится в случае:
1. Знания, понимания, глубины усвоения обучающимся всего объёма программного материала.
2. Умения выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать межпредметные и внутрипредметные связи, творчески применяет полученные знания в незнакомой ситуации.
3. Отсутствие ошибок и недочётов при воспроизведении изученного материала, при устных ответах устранение отдельных неточностей с помощью дополнительных вопросов учителя, соблюдение культуры письменной и устной речи, правил оформления письменных работ.
Оценка “4”:
1. Знание всего изученного программного материала.
2. Умений выделять главные положения в изученном материале, на основании фактов и примеров обобщать, делать выводы, устанавливать внутрипредметные связи, применять полученные знания на практике.
3. Незначительные (негрубые) ошибки и недочёты при воспроизведении изученного материала, соблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка “3” (уровень представлений, сочетающихся с элементами научных понятий):
1. Знание и усвоение материала на уровне минимальных требований программы, затруднение при самостоятельном воспроизведении, необходимость незначительной помощи преподавателя.
2. Умение работать на уровне воспроизведения, затруднения при ответах на видоизменённые вопросы.
3. Наличие грубой ошибки, нескольких негрубых при воспроизведении изученного материала, незначительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Оценка “2”:
1. Знание и усвоение материала на уровне ниже минимальных требований программы, отдельные представления об изученном материале.
2. Отсутствие умений работать на уровне воспроизведения, затруднения при ответах на стандартные вопросы.
3. Наличие нескольких грубых ошибок, большого числа негрубых при воспроизведении изученного материала, значительное несоблюдение основных правил культуры письменной и устной речи, правил оформления письменных работ.
Программа по предмету «Химия» выполняется в полном объеме. Уроки, приходящиеся на праздничные дни, проводятся за счет объединения часов, отведенных на обобщение и повторение изученного.
Учебно-тематическое планирование по химии
Количество часов:
Всего 70 часов; в неделю 2 часа.
Плановых контрольных уроков 4.
Учебно-методическая литература:
1. Габриелян О. С. Химия. 8 класс: учеб. для общеобразоват. учреждений / О. С. Габриелян. – 12-е изд., стереотип. – М.: Дрофа, 2007. – 267 с.
2. Габриелян О. С., Яшунова А. В. Рабочая тетрадь. 8 кл. К учебнику О. С. Габриеляна «Химия. 8». — М.: Дрофа, 2010.
3. Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2007.
4. Химия. 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна
5. Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О.С. Габриеляна. – М.: ВАКО, 2007 .
6. Ковалевская Н.Б. Химия. 8 класс (в таблицах). – М.: «ИЗДАТ-ШКОЛА», 2007.
Распределение часов по разделам:
| № | Наименование темы | Количество часов | Из них |
| Практические работы | Контрольные работы |
| 1 | Методы познания веществ и химических явлений | 1 |
|
|
| 2 | Вещество | 31 | 3
| № 1, 2 |
| 3 | Химическая реакция | 26 |
| № 3 |
| 4 | Химия и жизнь | 4 |
|
|
|
| Повторение | 8 |
| № 4 |
| ИТОГО: | 70 | 3 | 4 |
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
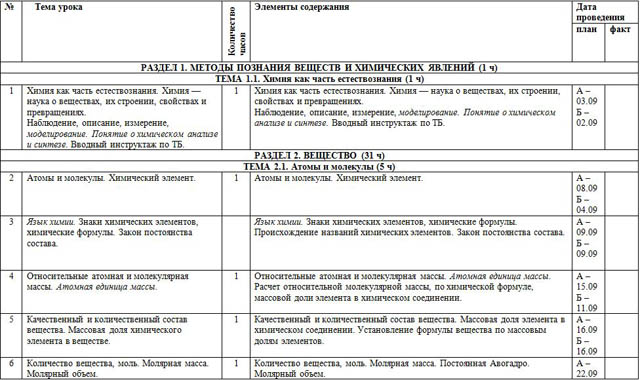
| №
| Тема урока | Количество часов | Элементы содержания | Дата проведения |
| план | факт |
| РАЗДЕЛ 1. МЕТОДЫ ПОЗНАНИЯ ВЕЩЕСТВ И ХИМИЧЕСКИХ ЯВЛЕНИЙ (1 ч) |
| ТЕМА 1.1. Химия как часть естествознания (1 ч) |
| 1 | Химия как часть естествознания. Химия — наука о веществах, их строении, свойствах и превращениях.
Наблюдение, описание, измерение, моделирование. Понятие о химическом анализе и синтезе. Вводный инструктаж по ТБ. | 1 | Химия как часть естествознания. Химия — наука о веществах, их строении, свойствах и превращениях.
Наблюдение, описание, измерение, моделирование. Понятие о химическом анализе и синтезе. Вводный инструктаж по ТБ. | А – 03.09 Б – 02.09 |
|
| РАЗДЕЛ 2. ВЕЩЕСТВО (31 ч) |
| ТЕМА 2.1. Атомы и молекулы (5 ч) |
| 2 | Атомы и молекулы. Химический элемент. | 1 | Атомы и молекулы. Химический элемент. | А – 08.09 Б – 04.09 |
|
| 3 | Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава. |
| Язык химии. Знаки химических элементов, химические формулы. Происхождение названий химических элементов. Закон постоянства состава.
| А – 09.09 Б – 09.09
|
|
| 4 | Относительные атомная и молекулярная массы. Атомная единица массы. | 1 | Относительные атомная и молекулярная массы. Атомная единица массы. Расчет относительной молекулярной массы, по химической формуле, массовой доли элемента в химическом соединении. | А – 15.09 Б – 11.09 |
|
| 5 | Качественный и количественный состав вещества. Массовая доля химического элемента в веществе. | 1 | Качественный и количественный состав вещества. Массовая доля элемента в химическом соединении. Установление формулы вещества по массовым долям элементов. | А – 16.09 Б – 16.09 |
|
| 6 | Количество вещества, моль. Молярная масса. Молярный объем. | 1 | Количество вещества, моль. Молярная масса. Постоянная Авогадро. Молярный объем. | А – 22.09 Б – 18.09 |
|
| ТЕМА 2.2. Периодический закон и периодическая система химических элементов Д.И. Менделеева (1 ч) |
| 7 | Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы. | 1 | Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы. | А – 23.09 Б – 23.09 |
|
| ТЕМА 2.3. Строение атома и молекул (10 ч) |
| 8 | Строение атома. Ядро (протоны, нейтроны) и электроны. | 1 | Строение атома. Ядро (протоны, нейтроны) и электроны. Модели строения атома. Доказательства строения атома: опыты Резерфорда, Бора. Взаимосвязь понятий: протон, нейтрон, массовое число. | А – 29.09 Б – 25.09 |
|
| 9 | Изотопы. | 1 | Изотопы. Изменение в составе ядер атомов химических элементов. Ядерные процессы. Превращения элемента. Изотопы как разновидность атомов одного химического элемента. | А – 30.09 Б – 30.09
|
|
| 10 | Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева. | 1 | Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева. Понятие о завершенном и незавершенном электронных уровнях. Распределение электронов в атомах по энергетическим уровням, периодическое изменение. Группы и периоды периодической системы. Физический смысл порядкового номера элемента, номера группы, номер периода. | А – 06.10 Б – 02.10 |
|
| 11 | Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная и неполярная), ионная, металлическая. Понятие о валентности и степени окисления. | 1 | Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная и неполярная), ионная, металлическая. Понятие о валентности и степени окисления. | А – 07.10 Б – 07.10 |
|
| 12 | Ковалентная неполярная химическая связь. | 1 | Ковалентная неполярная связь. Схемы образования 2-х атомных молекул (H2, Cl2, S2, N2). Электронные и структурные формулы. Кратность химической связи. | А – 13.10 Б – 09.10 |
|
| 13 | Ковалентная полярная химическая связь. | 1 | Ковалентная полярная связь. Понятие «электроотрицательность» (ЭО). Частичный заряд. Электронные и структурные формулы. | А – 14.10 Б – 14.10 |
|
| 14 | Ионная химическая связь. | 1 | Ионная связь. Понятие иона, ионной связи. Ионы, образованные атомами металлов и неметаллов. Схемы образования ионных соединений. Коэффициенты и индексы. | А – 20.10 Б – 16.10 |
|
| 15 | Металлическая химическая связь. | 1 | Металлическая химическая связь. | А – 21.10 Б – 21.10 |
|
| 16 | Повторение разделов «Методы познания веществ», «Вещество». | 1 | Материал по разделам «Методы познания веществ», «Вещество». | А – 27.10 Б – 23.10 |
|
| 17 | Контрольная работа № 1 по теме «Методы познания веществ. Вещество». | 1 |
| А – 28.10 Б – 28.10 |
|
| ТЕМА 2.4. Простые и сложные вещества (15 ч) |
| 18 | Простые и сложные вещества. | 1 | Простые и сложные вещества. | А – 10.11 Б – 30.10 |
|
| 19 | Простые вещества - металлы. | 1 | Простые вещества - металлы. Характеристика положения металлов в Периодической системе Д.И,Менделеева. Строение атомов металлов. Металлическая химическая связь. Общие физические свойства металлов. | А – 11.11 Б – 11.11 |
|
| 20 | Простые вещества – неметаллы. | 1 | Простые вещества – неметаллы. Положения неметаллов в Периодической системе Д.И.Менделеева. Строение атомов. Ковалентная связь. Общие физические свойства неметаллов. Понятие аллотропии. | А – 17.11 Б – 13.11 |
|
| 21 | Основные классы неорганических соединений. Оксиды и летучие водородные соединения. | 1 | Основные классы неорганических веществ. Оксиды и летучие водородные соединения. Состав, название и составление формул оксидов и водородных соединений, их классификация. Представители. | А – 18.11 Б – 18.11 |
|
| 22 | Основания. | 1 | Основания. Состав и название оснований, их классификация. Представители. Ионы. Катионы и анионы. Определение характера среды. Индикаторы. | А – 24.11 Б – 20.11 |
|
| 23 | Кислоты. | 1 | Кислоты. Состав и название кислот, их классификация. Представители. Кислотные остатки и основность кислот. Определение характера среды. Индикаторы. | А – 25.11 Б – 25.11 |
|
| 24 | Соли. | 1 | Соли. Состав и название солей. Представители. Соли – как производные кислот и оснований. Составление формул по степени окисления. | А – 01.12 Б – 27.11 |
|
| 25 | Вещества в твердом, жидком и газообразном состоянии. | 1 | Вещества в твердом, жидком и газообразном состоянии. | А – 02.12 Б – 02.12 |
|
| 26 | Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная и металлическая). | 1 | Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная и металлическая). | А – 08.12 Б – 04.12 |
|
| 27 | Чистые вещества и смеси веществ. Природные смеси: воздух, природный газ, нефть, природные воды. | 1 | Чистые вещества и смеси веществ. Природные смеси: воздух, природный газ, нефть, природные воды. | А – 09.12 Б – 09.12 |
|
| 28 | Повторение темы «Простые и сложные вещества». | 1 | Простые и сложные вещества | А – 15.12 Б – 11.12 |
|
| 29 | Контрольная работа № 2 по теме «Простые и сложные вещества». | 1 | Простые и сложные вещества | А – 16.12 Б – 16.12 |
|
| 30 | Практическая работа № 1: «Правила работы в школьной лаборатории. Лабораторная посуда и оборудование. Правила безопасности. Нагревательные устройства. Проведение химических реакций при нагревании». | 1 | Правила работы в школьной лаборатории. Лабораторная посуда и оборудование. Правила безопасности. Нагревательные устройства. Проведение химических реакций при нагревании. | А – 22.12 Б – 18.12 |
|
| 31 | Разделение смесей. Очистка веществ. Фильтрование. Практическая работа № 2: «Очистка загрязненной поваренной соли». | 1 | Разделение смесей. Очистка веществ. Фильтрование. | А – 23.12 Б – 23.12 |
|
| 32 | Проведение расчетов на основе формул и уравнений реакций: 1) массовой доли химического элемента в веществе; 2) массовой доли растворенного вещества в растворе; 3) количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. | 1 | Проведение расчетов на основе формул и уравнений реакций реакций: 1) массовой доли химического элемента в веществе; 2) массовой доли растворенного вещества в растворе; 3) количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Массовая и объемная доля компонентов смеси. | А – 12.01 Б – 25.12 |
|
| 33 | Взвешивание. Приготовление растворов. Получение кристаллов солей. Проведение химических реакций в растворах. Практическая работа № 3: «Приготовление раствора с заданной массовой долей растворенного вещества». | 1 | Взвешивание. Приготовление растворов. Получение кристаллов солей. Проведение химических реакций в растворах.
| А – 13.01 Б – 13.01 |
|
| РАЗДЕЛ 3. ХИМИЧЕСКАЯ РЕАКЦИЯ (26 ч) |
| ТЕМА 3.1. Условия и признаки химических реакций (26 ч) |
| 34 | Химическая реакция. Условия и признаки химических реакций.
| 1 | Химическая реакция. Условия и признаки химических реакций. | А – 19.01 Б – 15.01 |
|
| 35 | Понятие о химическом уравнении как об условной записи химической реакции с помощью химических формул. Значение индексов и коэффициентов. | 1 | Понятие о химическом уравнении как об условной записи химической реакции с помощью химических формул. Значение индексов и коэффициентов. | А – 20.01 Б – 20.01 |
|
| 36 | Сохранение массы веществ при химических реакциях. Составление уравнений химических реакций. | 1 | Сохранение массы веществ при химических реакциях. Закон сохранения массы веществ. Составление уравнений химических реакции. | А – 26.01 Б – 22.01 |
|
| 37 | Решение задач по теме «Расчеты по химическим уравнениям». | 1 | Вычисления по химическим уравнениям массы, объема или количества одного из продуктов реакции по массе исходного вещества. | А – 27.01 Б – 27.01 |
|
| 38 | Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления химических элементов; поглощению или выделению энергии. | 1 | Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления химических элементов; поглощению или выделению энергии. | А –02.02 Б – 29.01 |
|
| 39
| Понятие о скорости химических реакций. Катализаторы. | 1 | Понятие о скорости химических реакций. Катализаторы. | А – 03.02 Б – 03.02 |
|
| 40 | Реакции разложения. | 1 | Реакции разложения. Составление уравнений реакций. | А – 09.02 Б – 05.02 |
|
| 41 | Реакции соединения. | 1 | Реакции соединения. Составление уравнений реакций Каталитические и некаталитические реакции, обратимые и необратимые реакции. | А – 10.02 Б – 10.02 |
|
| 42 | Реакции замещения. | 1 | Реакции замещения. Составление уравнений реакций. Ряд активности металлов. Условия взаимодействия металлов с растворами кислот и солей. | А – 16.02 Б – 12.02 |
|
| 43 | Реакции обмена. | 1 | Реакции обмена. Составление уравнений реакций. Реакции нейтрализации. Условия протекания реакций обмена в растворах до конца. | А – 17.02 Б – 17.02 |
|
| 44 | Типы химических реакций на примере свойств воды. | 1 | Типы химических реакций на примере свойств воды. Вода и ее свойства. | А – 24.02 Б – 19.02 |
|
| 45 | Растворение как физико-химический процесс. Растворимость веществ. | 1 | Растворение как физико-химический процесс. Растворимость веществ. | А – 24.02 Б – 24.02 |
|
| 46 | Электролитическая диссоциация веществ в водных растворах. Электролиты и неэлектролиты. Ионы. Катионы и анионы. | 1 | Электролитическая диссоциация веществ в водных растворах. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Основные положения электролитической диссоциации. | А – 02.03 Б – 26.02 |
|
| 47 | Реакции ионного обмена.
| 1 | Реакции ионного обмена.
| А – 03.03 Б – 03.03 |
|
| 48 | Повторение темы «Условия и признаки химических реакций». | 1 | Условия и признаки химических реакций. | А – 09.03 Б – 05.03 |
|
| 49 | Контрольная работа № 3 по теме «Условия и признаки химических реакций». | 1 | Условия и признаки химических реакций. | А – 10.03 Б – 10.03 |
|
| 50 | Электролитическая диссоциация кислот, щелочей и солей. | 1 | Электролитическая диссоциация кислот, щелочей и солей. | А – 16.03 Б – 12.03 |
|
| 51 | Кислоты, их классификация и свойства. | 1 | Кислоты, их классификация и свойства. Химические свойства кислот. Условия протекания типичных реакций кислот. | А – 17.03 Б – 17.03 |
|
| 52 | Основания, их классификация и свойства. | 1 | Классификация оснований. Химические свойства оснований. | А – 06.04 Б – 19.03 |
|
| 53 | Оксиды, их классификация и свойства. | 1 | Классификация оксидов. Химические свойства оксидов. Условия протекания реакций. | А – 07.04 Б – 02.04 |
|
| 54 | Соли, их классификация и свойства. | 1 | Классификация солей. Диссоциация различных групп солей. Химические свойства солей. 2 правила ряда напряжений металлов. Условия протекания реакций солей. | А – 13.04 Б – 07.04 |
|
| 55 | Генетическая связь между классами неорганических веществ. | 1 | Генетическая связь между классами неорганических веществ. | А – 14.04 Б – 09.04 |
|
| 56 | Решение задач на тему «Генетическая связь между классами неорганических веществ». | 1 | Генетическая связь между классами неорганических веществ. Цепочки превращений между классами веществ. | А – 20.04 Б – 14.04 |
|
| 57 | Окислительно-восстановительные реакции. | 1 | Окислительно-восстановительные реакции. Окислитель и восстановитель. | А – 21.04 Б – 16.04 |
|
| 58 | Решение задач на тему «Окислительно-восстановительные реакции». | 1 | Окислительно-восстановительные реакции. Окислитель, восстановитель, окисление, восстановление. Электронный баланс. | А – 27.04 Б – 21.04 |
|
| РАЗДЕЛ 4. ХИМИЯ И ЖИЗНЬ (4 ч) |
| ТЕМА 4.1. Человек в мире веществ, материалов и химических реакций (4 ч) |
| 59 | Человек в мире веществ, материалов и химических реакций.
| 1 | Человек в мире веществ, материалов и химических реакций.
| А – 28.04 Б – 23.04 |
|
| 60 | Химическое загрязнение окружающей среды и его последствия. | 1 | Химическое загрязнение окружающей среды и его последствия. | А – 04.05 Б – 28.04 |
|
| 61 | Охрана окружающей среды. | 1 | Охрана окружающей среды. | А – 05.05 Б – 30.04 |
|
| 62 | Проблемы безопасного использования веществ и химических реакций в повседневной жизни. | 1 | Проблемы безопасного использования веществ и химических реакций в повседневной жизни. | А – 11.05 Б – 05.05 |
|
| ПОВТОРЕНИЕ (8 ч) |
| 63 | Повторение тем «Химия как часть естествознания», «Атомы и молекулы». | 1 | Базовые понятия (Стандарт). | А – 12.05 Б – 07.05 |
|
| 64 | Повторение темы «Периодический закон и периодическая система Д. И. Менделеева». | 1 | Базовые понятия (Стандарт). | А – 12.05 Б – 12.05 |
|
| 65 | Повторение темы «Строение атома и молекул». | 1 | Базовые понятия (Стандарт). | А – 18.05 Б – 14.05 |
|
| 66 | Повторение темы «Простые и сложные вещества». | 1 | Базовые понятия (Стандарт). | А – 18.05 Б – 19.05 |
|
| 67 | Повторение темы «Условия и признаки химических реакций». | 1 | Базовые понятия (Стандарт). | А – 19.05 Б – 21.05 |
|
| 68 | Повторение темы «Химия и жизнь». | 1 | Базовые понятия (Стандарт). | А – 19.05 Б – 21.05 |
|
| 69 | Итоговая контрольная работа по курсу «Химия. 8 класс». | 1 | Базовые понятия (Стандарт). | А – 25.05 Б – 26.05 |
|
| 70 | Обобщающий урок по курсу «Химия. 8 класс». | 1 | Базовые понятия (Стандарт). | А – 26.05 Б – 28.05 |
|
Список литературы:
1. Габриелян О. С., Яшунова А. В. Рабочая тетрадь. 8 кл. К учебнику О. С. Габриеляна «Химия. 8». — М.: Дрофа, 2010.
2. Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2007.
3. Химия. 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна
4. Горковенко М.Ю. Химия. 8 класс: Поурочные разработки к учебникам О.С. Габриеляна. – М.: ВАКО, 2007 .
5. Ковалевская Н.Б. Химия. 8 класс (в таблицах). – М.: «ИЗДАТ-ШКОЛА», 2007.
6. http://www.edu.ru/
7. http://www.kokch.kts.ru/cdo/
8. http://teacher.fio.ru
9. http://www.encyclopedia.ru/
10. http://1september. ru.
11. http://mega.km.ru
12. http://www.hemi.nsu.ru
13. http://lib.inorg.chem.msu.ru
14. http://chit.ssau.ru
15. http://chemistry.ru
16. http://www.ege.edu.ru
17. www.chem.km.ru

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии 8 класс (61.68 КB)
Рабочая программа по химии 8 класс (61.68 КB)
 0
0 679
679 11
11 Нравится
0
Нравится
0


