Муниципальное бюджетное образовательное учреждение
«Платово – Ивановская основная общеобразовательная школа
Родионово – Несветайского района Ростовской области
«Рассмотрена и рекомендована» «Согласовано» «Утверждаю»:
К применению Педагогическим Советом МБОУ «Платово – Ивановская ООШ» директор МБОУ
Руководитель РМО Протокол № ___ от «_____» ____________ 2014 г «Платово – Ивановская ООШ»
Учителей химии и биологии: зам. директора УР: ________/И. М. Ушанева/ ______/Е. А. Козорезова/
_____________/И. И. Сухарева/ Приказ № ______
Протокол № _____ от «_____»___________ 2014 г.
От «___» ________ 2014 г.
РАБОЧАЯ ПРОГРАММА
по химии
для 9 класса
Учебник «Химия» 68 часов (2 часа в неделю)
Автор: О. С. Габриелян
Базовый курс
Срок реализации программы: 2014 – 2015 учебный год (1 год)
Составитель: Мамаева Лариса Сергеевна
Рабочая программа по химии 9 класс
(2 часа в неделю, всего 68 часов,
УМК О.С.Габриеляна
Пояснительная записка
Рабочая программа разработана на основе авторской программы О.С.Габриеляна, соответствующей Федеральному компоненту Государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений / О.С.Габриелян. – 2-е издание, переработанное и дополненное – М.: Дрофа, 2013.).
Авторской программе соответствует учебник: «Химия 9 класс» О.С.Габриелян - рекомендовано Министерством образования и науки РФ / 10-е издание, переработанное – М.: Дрофа, 2013 г.
Исходными документами для составления рабочей программы явились:
Закон РФ «Об образовании» № 122 – ФЗ в последней редакции от 29. 12.2012 г.
Федеральный базисный учебный план для среднего (полного) общего образования, утвержденный приказом Министерства образования, утвержденный приказом Министерства образования РФ № 1312 от 05. 03. 2004 г.
Федеральный компонент государственного стандарта общего образования, утвержденный приказом Министерства образования РФ № 1089 от 05. 03. 2004 г.
Обязательный минимум основного общего образования по химии.
Сборник нормативных документов.
Приказ министерства образования РО № 503 от 05.08.2014 года о признании, утратившим силу приказа Минобразования РО от № 610 14.07.2011 года «Об утверждении примерного регионального положения рабочей программе учебных курсов, предметов, дисциплин (модулей)».
Положение о рабочей программе учебных предметов МБОУ «Платово – Ивановская ООШ» на 2014 – 2015 учебный год.
Примерная программа по химии. Химия 8 – 9 кл.
Федеральный перечень учебников, рекомендованных министерством РФ на 2014 – 2015 учебный год.
Учебный план МБОУ «Платово – Ивановская ООШ» на 2014 – 2015 уч. год.
Устав МБОУ «Платово – Ивановская ООШ» Родионово – Несветайского района Ростовской области.
Изучение химии на ступени основного общего образования направлено на достижение следующих цели:
изучение состава, строения, свойств химических элементов- представителей отдельных групп главных подгрупп периодической системы элементов Д.И.Менделеева, их соединений и применения.
Задачи курса:
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
ОБЩАЯ ХАРАКТЕРИСТИКА КУРСА
Программа курса построена на концентрической концепции. Особенность программы состоит в том, что она позволяет сохранить высокий теоретический уровень и сделать обучение максимально развивающим. Поэтому весь теоретический материал курса химии рассматривается на первом году обучения (8 класс), что позволяет учащимся более осознанно и глубоко изучить фактический материал – химию элементов и их соединений. Такое построение программы даёт возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов в 9 классе.
Содержание курса составляет основу для раскрытия важных мировоззренческих идей, таких, как материальное единство веществ природы, их генетическая связь, развитие форм от сравнительно простых до наиболее сложных, входящих в состав организмов; обусловленность свойств веществ их составом и строением, применения веществ их свойствами; единство природы химических связей и способов их преобразования при химических превращениях; познаваемость сущности химических превращений современными научными методами.
Курс включает в себя основы общей и неорганической химии, а также краткие сведения об органических веществах. В программе названы основные разделы курса, для каждого из них перечислены подлежащие изучению вопросы, виды расчетов, химический эксперимент (демонстрации, лабораторные опыты, практические работы).
Срок реализации рабочей программы 1 год
Уровень программы - базовый. Учитывая продолжительность учебного года (34 недели), планирование составлено на 68 часов в год. Объем учебной нагрузки согласно учебного плана школы на 2014/2015 учебный год 2 часа в неделю. Количество часов в неделю на изучение предмета согласно программе - 2 часа. Количество часов из федерального компонента БУП – 2 часа в неделю.
Место учебного предмета в учебном плане
Особенностью содержания курса «Химия» являются то, что в базисном учебном (образовательном) плане этот предмет появляется последним в ряду изучения естественнонаучных дисциплин. Данная необходимость освоения объясняется тем, что школьники должны обладать не только определенным запасом предварительных естественнонаучных знаний, но и достаточно хорошо развитым абстрактным мышлением. Учащимися уже накоплены знания по смежным дисциплинам цикла: биологии, физики, математики, географии, сформировались умения анализировать, вести наблюдения, сравнивать объекты наблюдения.
В соответствии с учебным планом на изучение химии в 9 классе отводится 2 часа в неделю, 68 часов в год, при нормативной продолжительности учебного года 34 учебных недели.
Программой предусмотрено проведение:
контрольных работ – 5,
практических работ – 6
лабораторных опытов – 16
демонстраций - 25
Срок реализации программы – один учебный год
Обоснование выбора УМК для реализации рабочей учебной программы.
Авторской программе соответствует учебник: «Химия 9 класс».
О.С.Габриелян - рекомендовано Министерством образования и науки РФ / 10-е издание, переработанное – М.: Дрофа, 2011.
Данный учебно-методический комплект, обеспечивающий реализацию программы - это целостная система, в ее состав входят учебная программа и учебник для учащихся.
Учебники данного автора включены в Федеральный перечень учебников, рекомендованных (допущенных) Министерством образования и науки Российской Федерации к использованию в образовательном процессе в общеобразовательных учреждениях, на текущий учебный год.
Рекомендуемая литература по учебной дисциплине подразделяется на основную и дополнительную. Перечень основной литературы включает издания, содержание которых конкретизирует знания обучаемых по основным вопросам, изложенным в программе.
Дополнительный список соответствует рекомендуемым автором учебной программы.
Решению задач воспитания у учащихся интереса к знаниям, самостоятельности, критичности мышления, трудолюбия и добросовестности при обучении химии служат разнообразные методы и организационные формы, как традиционно утвердившиеся в школьной практике, так и нетрадиционные, появившиеся в опыте передовых учителей.
При изучении курса целесообразно использовать исторический подход к раскрытию понятий, законов и теорий, показывая, как возникают и решаются противоречия, как совершаются открытия учеными, каковы их судьбы и жизненные позиции.
В содержании курса химии 9 класса вначале обобщенно раскрыты сведения о свойствах классов веществ – металлов и неметаллов, а затем подробно освещены свойства щелочных и щелочноземельных металлов и галогенов.
Наряду с этим в курсе раскрываются также и свойства отдельных важных в народнохозяйственном отношении веществ. Заканчивается курс кратким знакомством с органическими соединениями, в основе отбора которых лежит идея генетического развития органических веществ от углеводородов до биополимеров (белков и углеводов).
Значительное место в содержании курса отводится химическому эксперименту. Он открывает возможность формировать у учащихся специальные предметные умения работать с веществами, выполнять простые химические опыты, учит школьников безопасному и экологически грамотному общению с веществами в быту и на производстве. Практические работы объединены в два практикума (3+3 работы), которые служат не только средством закрепления умений и навыков, но также и средством контроля за качеством их сформированности.
Контроль за уровнем знаний учащихся предусматривает проведение лабораторных, практических, самостоятельных, тестовых и контрольных работ. По темам: «Металлы», «Неметаллы», «Органические соединения» и «Обобщение знаний по химии за курс основной школы» предусмотрены контрольные работы.
Данная рабочая программа может быть реализована при использовании традиционной технологии обучения, а также элементов других современных образовательных технологий, передовых форм и методов обучения, таких как проблемный метод, развивающее обучение, компьютерные технологии, тестовый контроль знаний и др. в зависимости от склонностей, потребностей, возможностей и способностей каждого конкретного ребёнка
Рабочая программа построена с учетом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6-9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ.
Формы и методы, технологии обучения.
Реализация данной программы рассчитана на использование традиционных технологий образования, а так же методов современных образовательных технологий. С использованием следующих форм работы, таких как лекция, беседа, рассказ, инструктаж, демонстрация, упражнения, решение задач, работа с текстом.
Методов: проблемный метод, проектный метод, развивающее обучение, информационно-комуникативные методы, объяснительно-иллюстративный метод; репродуктивный метод; метод проблемного изложения; частично поисковый, или эвристический, метод; исследовательский метод.
Концепции, заложенные в содержании учебного материала.
Рабочая программа по химии построена на основе концентрического подхода. Это достигается путем вычленения укрупненной дидактической единицы. В программе учитывается реализация межпредметных связей с курсом физики 6-9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ. Количество часов на каждую тему определено в соответствии с контингентом обучающихся данного класса.
В рабочей программе нашли отражение цели и задачи изучения химии на ступени основного общего образования, изложенные в пояснительной записке Примерной программы по химии. В ней так же заложены возможности предусмотренного стандартом формирования у обучающихся общеучебных умений и навыков, универсальных способах деятельности и ключевых компетенций. Принципы отбора основного и дополнительного содержания связаны с преемственностью целей образования на различных ступенях и уровнях обучения, логикой внутрипредметных связей, а так же возрастными особенностями учащихся.
Курс 9 класса начинается темой «Повторение основных вопросов курса 8 – го класса и введение в курс 9 – го класса». В которой обобщаются вопросы курса 8 класса и дается понятие об основных классах неорганических веществ, типах химических реакций, видах химической связи, степени окисления и составления окислительно – восстановительных реакций. На изучение этой темы отводится 4 часа.
В теме «Общая характеристика химических элементов» рассматривается характеристика элемента на основании его положения в ПСХЭ Д. И. Менделеева, говорится об амфотерных оксидах и гидроксидах, изучается периодический закон и периодическая система химических элементов (ПСХЭ) Д. И. Менделеева. Завершается изучение данной темы диагностической контрольной работой. На изучение этой темы отводится 5 часов.
В теме «Металлы» (20 часов) рассматриваются общие свойства химических элементов металлов, групп щелочных и щелочно-земельных металлов, в теме «Неметаллы» (25 часов) - подгруппы кислорода, галогенов, азота и углерода. Учащиеся получают представление о наиболее важных в народно-хозяйственном отношении веществ.
Сокращено число часов:
- на повторение « Основных вопросов курса химии 8 класса и введение в курс 9 класса» на 2 часа за счет исключения темы «Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления и восстановления», т. к. этот материал частично включен в тему «Генетические ряды металла и неметалла» и повторяется при дальнейшем изучении курса химии 9 класса.
-на тему 6 «Повторение основных вопросов курса химии 9 класса» с 4 часов до 2 часов.
Из авторской программы исключена часть учебного материала, который отсутствует в обязательном минимуме содержания основных образовательных программ для основной школы, также исключены некоторые демонстрационные опыты и лабораторные работы из-за недостатка времени на их выполнение при 2 часах в неделю, так как авторская программа предусматривает 2/3 часа в неделю.
5. В тему «Неметаллы» включен урок «Кислород», т.к. этот материал входит в обязательный минимум содержания основных образовательных программ.
При изучении учебного материала химии элементов повторяются, развиваются и обобщаются полученные в 8 классе основные понятия, законы и теории курса. Затем подлежит изучению тема «Знакомство с органическими веществами». На её изучение отводится 10 часов. Оканчивается курс темой «Повторение основных вопросов курса химии 9 класса». На неё отводится 2 часа. Один час отводится на итоговую контрольную работу за курс 9 класса.
В ходе изучения курса большое внимание уделяется формированию практических умений и навыков. Планирование содержит 6 практических работ
При решении расчетных задач продолжается формирование умения решать расчетные задачи изученных типов и новых типов - вычисление массовой доли выхода и задачи на избыток и недостаток, комбинированных задач и задач повышенной сложности.
Учебный предмет изучается в 9 классе, рассчитан на 34 учебных недели 68 часов (2 часа в неделю), в том числе на практические работы – 6 , лабораторные опыты – 16, контрольные работы – 5, демонстраций – 25, контрольных работ – 5.
Корректировка домашних заданий может производиться с учетом пробелов в знаниях учащихся, климатических условий и других объективных причин.
Тематическое планирование по химии, 9 класс,
(2 часа в неделю, всего 68 часов) 34 рабочие недели
УМК О.С.Габриеляна.
| № п/п | Наименование темы | Всего часов | Из них | Сроки проведения |
| Практические работы | Лабораторные работы | Демонстрации | Контрольные работы |
| 1 | Повторение основных вопросов курса 8 класса и введение в курс 9 класс класса | 4 |
|
|
|
|
|
| 2 | Тема 1. Общая характеристика химических элементов.
| 5 |
|
|
| Диагностическая № 1 |
|
| 3 | Тема 2. Металлы | 20 | №1. Осуществление цепочки химических превращений. № 2. Получение и свойства соединений металлов. № 3. Экспериментальные задачи по распознаванию и получению веществ. | 6 | 7 | № 2 |
|
| 4 | Тема 3. Неметаллы | 26 | № 4. Экспериментальные задачи по теме: «Подгруппа кислорода» № 5. Экспериментальные задачи по теме: «Подгруппы азота и углерода». № 6. Получение, собирание и распознавание газов. | 9 | 18 | № 3 |
|
| 5 | Тема 5. Первоначальные сведения об органических веществах. | 10 |
| 2 | 6 | № 4 |
|
| 6 | Тема 6. Повторение основных вопросов курса химии 9 класса | 2 |
|
|
| № 5 |
|
|
|
|
| ИТОГО: 6 ПРАКТИЧЕСКИХ РАБОТ, 17 Л. О, 25 ДЕМОНСТРАЦИЯ 5 КОНТРОЛЬНЫХ РАБОТ |
|
68 часов.
Содержание тем учебного курса химии 9 класса
по программе О.С. Габриеляна на 2ч в неделю.(68 часов)
Повторение основных вопросов курса 8 класса и введение в курс 9 класса
(4 ч)
Основные классы неорганических веществ. Типы химических реакций: реакция разложения, реакция соединения, реакция замещения., реакция обмена, эндо – и экзотермические реакции. Виды химической связи: ковалентная: полярная и неполярная, ионная, металлическая. Степень окисления. Изменение степени окисления. Составление окислительно – восстановительных реакций.
Тема 1. Общая характеристика химических элементов (5 часов).
Характеристика элемента по его положению в периодической системе химических элементов Д.И.Менделеева. Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления – восстановления. Генетические ряды металла и неметалла.
Понятие о переходных элементах Амфотерность. Генетический ряд переходного
элемента.
Периодический закон и периодическая система химических элементов
Д.И.Менделеева в свете учения о строении атома. Их значение.
Решение задач на определение доли выхода продукта реакции от теоретически
возможного.
Тема1. Металлы(20ч)
Положение металлов в периодической системе химических элементов Д.И.
Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь.
Общие физические свойства металлов. Сплавы, их свойства и значение. Химические свойства металлов как восстановителей. Электрохимический ряд напряжений металлов и его использование для характеристики химических свойств конкретных металлов.
Способы получения металлов: пиро-, гидро- и электрометаллургия. Коррозия металлов и способы борьбы с ней.
Общая характеристика щелочных металлов. Металлы в природе. Общие способы
их получения. Строение атомов. Щелочные металлов – простые вещества, их физические и химические свойства. Важнейшие соединения щелочных металлов – оксиды, гидроксиды, соли (хлориды, карбонаты, сульфаты, нитраты), их свойства и применение в народном хозяйстве. Калийные удобрения.
Общая характеристика элементов главной подгруппы II группы. Строение атомов.
Щелочноземельные металлы – простые вещества, их физические и химические свойства.
Важнейшие соединения щелочноземельных металлов – оксиды, гидроксиды, соли
(хлориды, карбонаты, нитраты, сульфаты и фосфаты) их свойства и применение в
народном хозяйстве.
Алюминий. Строение атома, физические и химические свойства простого
вещества. Соединения алюминия – оксид и гидроксид, их амфотерный характер.
Важнейшие соли алюминия. Применение алюминия и его соединений.
Железо. Строение атома, физические и химические свойства простого вещества.
Генетические ряды Fe2+ и Fe3+
. Качественные реакции на Fe2+ и Fe3+
. Важнейшие соли железа. Значение железа, его соединений и сплавов в природе и народном хозяйстве. Демонстрации. Образцы щелочных и щелочноземельных металлов. Образцы сплавов. Взаимодействие натрия, лития и кальция с водой. Взаимодействие натрия и магния с кислородом. Взаимодействие металлов с неметаллами. Получение гидроксидов железа (II) и (III).
Лабораторные опыты.
1. Ознакомление с образцами металлов.
2. ознакомление с образцами различных сплавов.
3. Взаимодействие металлов с растворами кислот и солей.
4. Ознакомление с образцами природных соединений: а) натрия; б) кальция; в)
алюминия; г) железа.
5. Получение гидроксида алюминия и его взаимодействие с растворами кислот и
щелочей
6. Качественные реакции на ионы Fe2+ и Fe3+ .
Демонстрации.
Взаимодействие металлов с неметаллами.
Образцы сплавов. Коллекция руд, металлов, полезные ископаемые.
Образцы щелочных металлов.
Взаимодействие натрия, лития с водой; натрия с кислородом.
Взаимодействие кальция с водой; магния с кислородом.
Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей.
Получение гидроксидов железа (II) (III).
Тема 2. Практикум№1. Свойства металлов и их соединений (3ч)
1. Осуществление цепочки химических превращений металлов.
2. Получение и свойства соединений металлов.
3. Экспериментальные задачи по распознаванию и получению веществ.
Тема 3. Неметаллы(27ч)
Общая характеристика неметаллов: положение в периодической системе Д.И.
Менделеева, особенности строения атомов, электроотрицательность как мера
«неметалличности», ряд электроотрицательности. Кристаллическое строение неметаллов- простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл», «неметалл».
Водород. Положение в периодической системе Д.И. Менделеева. Строение атома
и молекулы. Физические и химические свойства водорода, его получение и применение.
Общая характеристика галогенов. Строение атомов. Простые вещества, их
физические и химические свойства. Основные соединения галогенов (галогеноводороды и галогениды), их свойства. Качественная реакция на хлорид-ион. Краткие сведения о хлоре, броме, фторе и иоде. Применение галогенов и их соединений в народном хозяйстве.
Сера. Строение атома, аллотропия, свойства и применение ромбической серы.
Оксиды серы (IV) и (VI), их получение, свойства и применение. Сероводородная и сернистая кислоты. Серная кислота и ее соли, их применение в народном хозяйстве.
Кислород. Строение атома, аллотропия, свойства и применение кислорода.
Азот. Строение атома и молекулы, свойства простого вещества. Аммиак,
строение, свойства, получение и применение. Соли аммония, их свойства и
применение. Оксиды азота (II) и (IV). Азотная кислота, ее свойства и применение.
Нитраты и нитриты, проблема их содержания в сельскохозяйственной продукции.
Азотные удобрения.
Фосфор. Строение атома, аллотропия, свойства белого и красного фосфора, их
применение. Основные соединения: оксид фосфора (V), ортофосфорная кислота и
фосфаты. Фосфорные удобрения.
Углерод. Строение атома, аллотропия, свойства аллотропных модификаций,
применение. Оксиды углерода (II) и (IV), их свойства и применение. Качественная реакция на углекислый газ. Карбонаты: кальцит, сода, поташ, их значение в природе и жизни человека. Качественная реакция на карбонат-ион.
Кремний. Строение атома, кристаллический кремния, его свойства и применение.
Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Понятие о силикатной промышленности.
Демонстрации.
Коллекция образцов неметаллов в различных агрегатных состояниях.
Образцы галогенов – простых веществ. (йодокрахмальная проба – крахмальный клейстер и спиртовая настойка йода).
Получение хлороводорода и его растворение в воде. Образцы природных соединений.
Получение кислорода и его взаимодействие с простыми веществами.
Взаимодействие серы с металлами и кислородом.
Взаимодействие разбавленной серной кислоты с металлами, оксидами металлов, растворимыми и нерастворимыми гидроксидами металлов.
Получение, собирание и распознавание аммиака.
Взаимодействие конц. азотной кислоты с медью.
Образцы природных соединений фосфора. Получение белого фосфора из красного.
Образцы природных соединений углерода..
Получение, собирание, распознавание углекислого газа.
Образцы природных соединений кремния. Образцы стекла, керамики, цемента.
Образцы нефти, каменного угля, продуктов их переработки, горение углеводородов и обнаружение продуктов их горения.
Образцы спиртов.
Образцы кислот (муравьиной, уксусной, стеариновой).
Качественные реакции на белки.
Качественная реакция на крахмал.
Образцы изделий из полиэтилена.
Лабораторные опыты.
7. Качественная реакция на хлорид-ион.
8. Знакомство с образцами природных оксидов, солей, кислородсодержащих кислот.
9. Знакомство с образцами природных соединений серы.
10. Распознавание сульфат – иона.
11. Распознавание катиона аммония.
12. Качественная реакция на карбонат – ион.
13. Ознакомление с природными силикатами.
14. Ознакомление с продукцией силикатной промышленности.
15. Взаимодействие крахмала с йодом.
Тема 4. Практикум №2. Свойства неметаллов и их соединений (3ч)
4. Решение экспериментальных задач по теме «Подгруппа кислорода».
5. Решение экспериментальных задач по теме «Подгруппы азота и углерода».
6. Получение, собирание и распознавание газов
Тема 5. Первоначальные сведения об органических веществах (10 ч)
Вещества органические и неорганические, относительность понятия «органические вещества». Причины многообразия органических соединений. Химическое строение органических соединений. Молекулярные и структурные формулы органических веществ.
Метан и этан: строение молекул. Горение метана и этана. Дегидрирование этана.
Применение метана.
Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Реакции полимеризации этилена. Полиэтилен и его значение.
Понятие о предельных одноатомных спиртах на примерах метанола и этанола.
Трехатомный спирт — глицерин.
Понятие об альдегидах на примере уксусного альдегида. Окисление альдегида в
кислоту.
Одноосновные предельные карбоновые кислоты на примере уксусной кислоты. Ее
свойства и применение. Стеариновая кислота как представитель жирных карбоновых кислот.
Реакции этерификации и понятие о сложных эфирах. Жиры как сложные эфиры
глицерина и жирных кислот.
Понятие об аминокислотах. Реакции поликонденсации. Белки, их строение и
биологическая роль.
Понятие об углеводах. Глюкоза, ее свойства и значение. Крахмал и целлюлоза (в
сравнении), их биологическая роль.
Лабораторные опыты.
16. Изготовление моделей молекул углеводородов.
Тема 6. Обобщение знаний по химии за курс основной школы (8ч.)
Физический смысл порядкового номера элемента в периодической системе
химических элементов Д. И. Менделеева, номеров периода и группы. Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов. Значение периодического закона.
Типы химических связей и типы кристаллических решеток. Взаимосвязь строения
и свойств веществ.
Классификация химических реакций по различным признакам (число и состав
реагирующих и образующихся веществ; тепловой эффект; использование катализатора; направление; изменение степеней окисления атомов).
Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла,
неметалла и переходного металла. Оксиды (основные, амфотерные и кислотные),
гидроксиды (основания, амфотерные гидроксиды и кислоты) и соли: состав,
классификация и общие химические свойства в свете теории электролитической
диссоциации и представлений о процессах окисления-восстановления.
Развернутый учебно – тематический план
Химия 9 класс. Автор О. С. Габриелян.
| № | Тема | Количество часов | В том числе |
| Демонстрации | Лабораторные опыты | Практические работы | Контрольные работы |
| 1 | Повторение основных вопросов курса 8 класса и введение в курс 9 класса | 4 |
|
|
|
|
| 2 | Общая характеристика химических элементов | 5 |
|
|
| 1 |
| 3 | Металлы | 20 | 7 | 6 | 3 | 1 |
| 4 | Неметаллы | 27 | 18 | 9 | 3 | 1 |
| 5 | Представление об органических веществах | 10 |
| 1 |
| 1 |
| 6 | Повторение основных вопросов химии 9 класса | 2 |
|
|
| 1 |
|
| итого | 68 | 25 | 16 | 6 | 5 |
Итого: 68 часов, 5 контрольных работ, 6 практических работ, 17 лабораторных опытов, 25 демонстраций.
Требования к уровню подготовки учеников:
В результате изучения химии ученик должен
знать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
определять: состав веществ по их формулам; принадлежность веществ к определенному классу соединений; валентность и степень окисления элементов в соединениях;
составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов периодической системы; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю растворенного вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде, школьной лаборатории и в быту.
Обязательный минимум содержания основной образовательной программы по химии
Методы познания веществ и химических явлений
Химия как часть естествознания. Химия - наука о веществах, их строении, свойствах и превращениях.
Наблюдение, описание, измерение, эксперимент, МОДЕЛИРОВАНИЕ. ПОНЯТИЕ О ХИМИЧЕСКОМ АНАЛИЗЕ И СИНТЕЗЕ.
Экспериментальное изучение химических свойств неорганических и органических веществ.
Проведение расчетов на основе формул и уравнений реакций: 1) массовой доли химического элемента в веществе; 2) массовой доли растворенного вещества в растворе; 3) количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции.
Вещество
Атомы и молекулы. Химический элемент. ЯЗЫК ХИМИИ. Знаки химических элементов, химические формулы. Закон постоянства состава.
Относительные атомная и молекулярная массы. АТОМНАЯ ЕДИНИЦА МАССЫ. Количество вещества, моль. Молярная масса. Молярный объем.
Чистые вещества и смеси веществ. Природные смеси: ВОЗДУХ, ПРИРОДНЫЙ ГАЗ, НЕФТЬ, ПРИРОДНЫЕ ВОДЫ.
Качественный и количественный состав вещества. Простые и сложные вещества. Основные классы неорганических веществ.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Группы и периоды Периодической системы.
Строение атома. Ядро (протоны, нейтроны) и электроны. Изотопы. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева.
Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная и неполярная), ионная, металлическая. Понятие о валентности и степени окисления.
Вещества в твердом, жидком и газообразном состоянии. Кристаллические и АМОРФНЫЕ вещества. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК (АТОМНАЯ, МОЛЕКУЛЯРНАЯ, ИОННАЯ И МЕТАЛЛИЧЕСКАЯ).
Химическая реакция
Химическая реакция. Условия и признаки химических реакций. Сохранение массы веществ при химических реакциях.
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления химических элементов; поглощению или выделению энергии. ПОНЯТИЕ О СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ. КАТАЛИЗАТОРЫ.
Электролитическая диссоциация веществ в водных растворах. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей. Реакции ионного обмена.
Окислительно-восстановительные реакции. Окислитель и восстановитель.
Элементарные основы неорганической химии
Свойства простых веществ (металлов и неметаллов), оксидов, оснований, кислот, солей.
Водород. Водородные соединения неметаллов. Кислород. Озон. Вода.
Галогены. Галогеноводородные кислоты и их соли.
Сера. Оксиды серы. Серная, СЕРНИСТАЯ И СЕРОВОДОРОДНАЯ кислоты и их соли.
Азот. Аммиак. Соли аммония. Оксиды азота. Азотная кислота и ее соли.
Фосфор. Оксид фосфора. Ортофосфорная кислота и ее соли.
Углерод. Алмаз, графит. Угарный и углекислый газы. Угольная кислота и ее соли.
Кремний. Оксид кремния. Кремниевая кислота. СИЛИКАТЫ.
Щелочные и щелочно-земельные металлы и их соединения.
Алюминий. АМФОТЕРНОСТЬ ОКСИДА И ГИДРОКСИДА.
Железо. Оксиды, ГИДРОКСИДЫ И СОЛИ железа.
Первоначальные представления об органических веществах
Первоначальные сведения о строении органических веществ.
Углеводороды: метан, этан, этилен.
Спирты (метанол, этанол, глицерин) и карбоновые кислоты (уксусная, стеариновая) как представители кислородсодержащих органических соединений.
Биологически важные вещества: жиры, углеводы, белки.
ПРЕДСТАВЛЕНИЯ О ПОЛИМЕРАХ НА ПРИМЕРЕ ПОЛИЭТИЛЕНА.
Экспериментальные основы химии
Правила работы в школьной лаборатории. Лабораторная посуда и оборудование. Правила безопасности.
Разделение смесей. Очистка веществ. Фильтрование.
Взвешивание. Приготовление растворов. Получение кристаллов солей. Проведение химических реакций в растворах.
НАГРЕВАТЕЛЬНЫЕ УСТРОЙСТВА. ПРОВЕДЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ ПРИ НАГРЕВАНИИ.
Методы анализа веществ. Качественные реакции на газообразные вещества и ионы в растворе. Определение характера среды. Индикаторы.
Получение газообразных веществ.
Химия и жизнь
Человек в мире веществ, материалов и химических реакций.
ХИМИЯ И ЗДОРОВЬЕ. ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ; ПРОБЛЕМЫ, СВЯЗАННЫЕ С ИХ ПРИМЕНЕНИЕМ.
ХИМИЯ И ПИЩА. КАЛОРИЙНОСТЬ ЖИРОВ, БЕЛКОВ И УГЛЕВОДОВ. КОНСЕРВАНТЫ ПИЩЕВЫХ ПРОДУКТОВ (ПОВАРЕННАЯ СОЛЬ, УКСУСНАЯ КИСЛОТА).
ХИМИЧЕСКИЕ ВЕЩЕСТВА КАК СТРОИТЕЛЬНЫЕ И ПОДЕЛОЧНЫЕ МАТЕРИАЛЫ (МЕЛ, МРАМОР, ИЗВЕСТНЯК, СТЕКЛО, ЦЕМЕНТ).
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ. НЕФТЬ И ПРИРОДНЫЙ ГАЗ, ИХ ПРИМЕНЕНИЕ.
Химическое загрязнение окружающей среды и его последствия.
Проблемы безопасного использования веществ и химических реакций в повседневной жизни. ТОКСИЧНЫЕ, ГОРЮЧИЕ И ВЗРЫВООПАСНЫЕ ВЕЩЕСТВА. БЫТОВАЯ ХИМИЧЕСКАЯ ГРАМОТНОСТЬ.
Контроль уровня обучения
Устный ответ
Оценка «5» - ответ полный, правильный, самостоятельный, материал изложен в определенной логической последовательности.
Оценка «4» - ответ полный и правильный, материал изложен в определенной логической последовательности, допущены две-три несущественные ошибки, исправленные по требованию учителя.
Оценка «3» - ответ полный, но допущены существенные ошибки или ответ неполный.
Оценка «2» - ученик не понимает основное содержание учебного материала или допустил существенные ошибки, которые не может исправить даже при наводящих вопросах учителя.
Расчетные задачи
Оценка «5» - в логическом рассуждении нет ошибок, задача решена рациональным способом.
Оценка «4» - в рассуждении нет ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Оценка «3» - в рассуждении нет ошибок, но допущена ошибка в математических расчетах.
Оценка «2» - имеются ошибки в рассуждениях и расчетах.
Экспериментальные задачи
Оценка «5» - правильно составлен план решения, подобраны реактивы, дано полное объяснение и сделаны выводы.
Оценка «4» - правильно составлен план решения, подобраны реактивы, при этом допущено не более двух ошибок (несущественных) в объяснении и выводах.
Оценка «3» - правильно составлен план решения, подобраны реактивы, допущена существенная ошибка в объяснении и выводах.
Оценка «2» -допущены две и более ошибки в плане решения, в подборе реактивов, выводах.
Практическая работа
Оценка «5» - работа выполнена полностью, правильно сделаны наблюдения и выводы, эксперимент осуществлен по плану, с учетом техники безопасности, поддерживается чистота рабочего места, экономно расходуются реактивы.
Оценка «4» - работа выполнена полностью, правильно сделаны наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Оценка «3» - работа выполнена не менее чем на половину или допущены существенные ошибка в ходе эксперимента, в объяснении, в оформлении работы, но исправляются по требованию учителя.
Оценка «2» - допущены две или более существенные ошибки, учащийся не может их исправить даже по требованию учителя.
Контрольная работа
Оценка «5» - работа выполнена полностью, возможна несущественная ошибка.
Оценка «4» - работа выполнена полностью, допущено не более двух несущественных ошибок.
Оценка «3» - работа выполнена не менее чем наполовину, допущена одна существенная или две несущественные ошибки.
Оценка «2» - работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
Учебно-методическое обеспечение:
Учебно-методический комплект
Примерная программа основного общего образования по химии (базовый уровень);
Авторская программа О.С.Габриеляна, соответствующая Федеральному компоненту Государственного стандарта общего образования и допущенная Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений / О.С.Габриелян. – 7-е издание, переработанное и дополненное – М.: Дрофа, 2010г.).
Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 9 к л.: Методическое пособие. — М.: Дрофа, 2002—2003.
Химия. 9 к л.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 9» / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2009г.
Габриелян О. С., Остроумов И. Г. Изучаем химию в 9 к л.: Дидактические материалы. — М.: Блик плюс, 2009г.
Габриелян О. С., Яшукова А. В. Рабочая тетрадь. 9 к л. К учебнику О. С. Габриеляна «Химия. 9». — М.: Дрофа, 2010г.
Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2009г.
Литература для учителя:
Программа О.С.Габриеляна «Программа курса химии для 8-11 классов общеобразовательных школ», М.: «Дрофа», 2010г
О.С.Габриелян «Примерное тематическое планирование уроков химии», 2006г
О.С.Габриелян «Настольная книга учителя химии», М., «Блик и К», 2007г
Литература для учащихся:
О.С.Габриелян «Химия, 9 класс», М., 2009 г
О.С.Габриелян «Мы изучаем химию, 9 класс», М., 2009г
Дополнительная литература:
Энциклопедический словарь юного химика.
Дидактический материал.
Медиаресурсы:
Единые образовательные ресурсы с сайта www. school-coolection.edu.ru
(единой коллекции образовательных ресурсов)
CD «Неорганическая химия», издательство «Учитель»
CD «Органическая химия», издательство «Учитель»
CD «Общая химия», издательство «Учитель»
CD «Химия элементов», издательство «Учитель»
Химия. Просвещение «Неорганическая химия»,. 8 класс. (на 2-х дисках)
Химия (8-11 класс). Виртуальная лаборатория (учебное электронное издание)
СD «Химия 8-11 класс», Библиотека электронных наглядных пособий.
CD Самоучитель «Химия для всех» (8-11 класс)
CD «Химия в школе. Минеральные вещества», электронные тесты.
CD «Тренажер по химии, тесты для подготовки к экзаменам», 2 шт.
Материально-техническое и информационно-техническое обеспечение:
Специализированный класс химии (лаборантская, вытяжной шкаф, специализированные столы, немеловая доска).
Стенды:
-«Периодическая система Д.И. Менделеева»
-«Таблица растворимости»
-«Классификация неорганических веществ»
-«Основные единицы измерения в системе СИ»
-«Индикаторы»
-«Техника безопасности»
-Портреты ученых-химиков
3. Химическое оборудование и реактивы.
4. Противопожарная сигнализация.
5. Интерактивное оборудование компьютерного класса, интернет ресурсы и CD диски.
Согласовано:
Заместитель директора по УВР:
_________/И. М. Ушанёва/
«_____» __________ 2014 год
График проведения лабораторных опытов по химии в 9 классе
| № лабораторного опыта | Название лабораторного опыта | Дата проведения |
| 1. | Ознакомление с образцами металлов
|
|
| 2. | Ознакомление с образцами различных сплавов |
|
| 3. | Взаимодействие металлов с растворами кислот и солей. |
|
| 4. | Ознакомление с образцами природных соединений: натрия, кальция, алюминия, железа. |
|
| 5. | Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей. |
|
| 6. | Качественные реакции на ионы Fe2+ Fe3+
|
|
| 7. | Качественная реакция на хлорид – ион.
|
|
| 8. | Знакомство с образцами природных оксидов, солей, кислородсодержащих кислот. |
|
| 9. | Знакомство с образцами природных соединений серы. |
|
| 10. | Распознавание сульфат – иона.
|
|
| 11. | Распознавание катиона аммония.
|
|
| 12. | Качественная реакция на карбонат – ион
|
|
| 13. | Ознакомление с природными силикатами
|
|
| 14. | Ознакомление с продукцией силикатной промышленности |
|
| 15. | Взаимодействие крахмала с йодом
|
|
| 16. | Изготовление моделей молекул углеводородов. |
|
Итого: 16 лабораторных опытов
График проведения демонстрационных опытов в 9 классе
| № демонстрации | Тема демонстрации | Дата проведения |
| 1. | Взаимодействие металлов с неметаллами. |
|
| 2. | Образцы сплавов. Коллекция руд, металлов, полезных ископаемых. |
|
| 3. | Образцы щелочных металлов |
|
| 4. | Взаимодействие натрия, лития с водой, натрия с кислородом. |
|
| 5. | Взаимодействие кальция с водой; магния с кислородом. |
|
| 6. | Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей. |
|
| 7. | Получение гидроксидов железа (II) (III) |
|
| 8. | Коллекция образцов неметаллов в различных агрегатных состояниях. |
|
| 9. | Образцы галогенов- простых веществ.(йодокрахмальная проба – крахмальный клейстер и спиртовая настойка йода) |
|
| 10. | Получение хлороводорода и его растворение в воде. Образцы природных соединений. |
|
| 11. | Получение кислорода и его взаимодействие с простыми веществами. |
|
| 12. | Взаимодействие серы с металлами и кислородом. |
|
| 13. | Взаимодействие разбавленной серной кислоты с металлами, оксидами металлов, растворимыми и нерастворимыми гидроксидами металлов |
|
| 14. | Получение, собирание и распознавание аммиака. |
|
| 15. | Взаимодействие конц. азотной кислоты с медью. |
|
| 16. | Образцы природных соединений фосфора.. Получение белого фосфора из красного. |
|
| 17. | Образцы природных соединений |
|
| 18. | Получение, собирание, распознавание углекислого газа. |
|
| 19. | Образцы природных соединений кремния. Образцы стекла, керамики, цемента. |
|
| 20. | Образцы нефти, каменного угля, продуктов их переработки, горение углеводородов и обнаружение продуктов их горения |
|
| 21. | Образцы спиртов. |
|
| 22. | Образцы кислот (муравьиной, уксусной, стеариновой) |
|
| 23. | Качественные реакции на белки |
|
| 24. | Качественная реакция на крахмал |
|
| 25. | Образцы изделий из полиэтилена |
|
Итого: 25 демонстраций.
График проведения практических работ по химии в 9 классе
| № практической работы | Название практической работы | Дата проведения |
| 1. | №1. Осуществление цепочки химических превращений. |
|
| 2 |
№ 2. Получение и свойства соединений металлов. |
|
| 3 |
№ 3. Экспериментальные задачи по распознаванию и получению веществ. |
|
| 4 | № 4. Экспериментальные задачи по теме: «Подгруппа кислорода» |
|
| 5 |
№ 5. Экспериментальные задачи по теме: «Подгруппы азота и углерода».
|
|
| 6 | № 6. Получение, собирание и распознавание газов. |
|
|
Итого – 6 практических работ |
График контрольных работ по химии в 9 классе
| № контрольной работы | Тема контрольной работы | Дата проведения |
| 1. | Диагностическая контрольная работа за курс 8 класса |
|
| 2. | Металлы |
|
| 3. | Неметаллы |
|
| 4. | Органические соединения |
|
| 5. | Итоговая контрольная работа за курс химии 9 класса |
|
Итого – 5 контрольных работ
КАЛЕНДАРНО – ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
ПО КУРСУ ХИМИИ
9 КЛАСС. Автор – О. С. Габриелян
| № урока | Дата | Тема урока | Кол –во часов | Практические работы, лабораторные опыты, демонстрации | Виды деятельности на уроке | Форма контроля знаний | Примерное Домашнее задание
|
| По плану | По факту |
| Глава № 1 «Повторение основных вопросов курса 8 класса и введение в курс 9 класса» ( 4 часа) |
| 1/1 |
|
| Основные классы неорганических веществ.
| 1 |
| Решение кроссворда «Классы неорганических соединений», тест, самостоятельная работа с учебником | Фронтальный опрос | Конспект |
| 2/2 |
|
| Типы химических реакций.
| 1 |
| Заполнение таблицы «Типы химических реакций». тест | Фронтальный опрос | конспект |
| 3/3 |
|
| Виды химической связи
| 1 |
| Заполнение таблицы, составление конспекта «Виды химической связи», тест | Фронтальный опрос, проверочная работа | Повторить конспект |
| 4/4 |
|
| Степень окисления. Изменение степени окисления. Составление ОВР.
| 1 |
| Работа с карточками – заданиями, тест | Текущий | Повторить конспект, задание по карточкам |
| Тема 1 «Общая характеристика химических элементов» (5 часов) |
| 5/1 |
|
| Характеристика элемента на основании его положения в ПСХЭ.
| 1 |
| Работа с ПСХЭ Д. И. Менделеева, работа с карточками – заданиями | Текущий, работа в парах | П. 1 стр. 8, № 5 |
| 6-7/ 2-3 |
|
| Характеристика элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
| 2 |
| Работа с ПСХЭ . Д. И. Менделеева, работа с карточками - заданиями | Самостоятельная работа | П. 2, упр. 2, 3 б |
| 8/4 |
|
| Периодический закон и ПСХЭ.
| 1 |
| Фронтальный опрос, индивидуальный опрос по карточкам – заданиям, работа в парах Работа с таблицей на стр. 14, 15, 17, 18. |
| П. 3, конспект, упр. 4, подготовиться к диагностической контрольной работе |
| 9/5 |
|
| Диагностическая контрольная работа за курс 8 класса | 1 | Контрольная работа за курс 8 класса |
| Тестовая контрольная работа | Повторить конспекты |
| Тема № 2 «Металлы» (20 часов)
|
|
|
|
| 10/1 |
|
| Положение металлов в периодической системе Д.И.Менделеева. Общие физические свойства металлов.
| 1 |
| Работа с ПСХЭ Д. Менделеева Л. О. № 1 «Ознакомление с образцами металлов» Демонстрация № 1 «Взаимодействие металлов с неметаллами» | Тест | П. 4, 5, упр. 1 устно стр. 29 |
| 11/2 |
|
| Сплавы. |
1
| Л. О.№ 2 «Ознакомление с образцами различных сплавов» Демонстрация № 2 «Образцы сплавов. Коллекция руд, металлов, полезных ископаемых» | Работа с карточками – заданиями, работа по заполнению таблицы «Физические свойства металлов» Работа с таблицей № 4 стр. 35, № 5 стр. 36 – 37
| Фронтальный опрос |
Подготовка рефератов, сообщений, докладов, §6-7, стр. 38 №2 |
| 12- 13/ 3-4 |
|
| Химические свойства металлов. Электрохимический ряд напряжений металлов.
| 2 | Л. О. № 3 «Взаимодействие металлов с растворами кислот и солей» | Работа по заполнению таблицы «химические и физические свойства металлов» Работа с электрохимическим рядом напряжений металлов. Работа по схемам химических уравнений стр. 39 – 41. | Самостоятельная работа по теме: «Сплавы» | П.8, стр. 41, упр. 2 |
| 14/5 |
|
| Металлы в природе, общие способы получения металлов.
| 1 |
| Работа с ПСХЭ Д. И. Менделеева Работа по заполнению таблицы «Способы получения металлов» Составление конспекта «Металлы в природе» Л. О. № 4 «Ознакомление с образцами природных соединений: натрия, кальция, алюминия, железа» Работа с рис. 14 «Самородки» рис. 15 «Минералы». Работа с коллекцией минералов, рис. 16 | Сообщения, химический диктант, самостоятельная работа на 10 минут | П. 9,упр. 4. |
| 15/6 |
|
| Общие понятия о коррозии металлов.
| 1 |
| Работа по составлению конспекта «Коррозия металлов» Работа с рис. 17 «Влияние условий окружающей среды на коррозию металлов», рис. 18 «Электрохимическая коррозия металлов при контакте металлов в электропроводной среде» | Текущий, | П. 10, упр. 1 – 4 |
| 16-17/ 7-8 |
|
| Щелочные металлы и их соединения.
| 2 | Демонстрация № 3 «Образцы щелочных металлов» Демонстрация № 4 «Взаимодействие натрия, лития с водой, натрия с кислородом» | Работа с ПСХЭ Д. И. Менделеева по составлению конспекта «щелочные металлы», Работа с рис 20 «Хранение щелочных металлов и их физические свойства» Работа с рис. 21 «Плотности и температуры плавления ЩМ» рис. 22 «Взаимодействие натрия с водой и собирание водорода методом вытеснения воздуха» Работа с рис. 23 «Взаимодействие калия с водой» Работа с рис. 24 «Применение хлорида натрия» | Химический диктант, фронтальный опрос | П. 11, упр. 1 б. |
| 18- 19 (9-10) |
|
| Щелочноземельные металлы и их соединения.
| 2 |
Демонстрация № 5 «Взаимодействие кальция с водой, магния с кислородом» | работа с рис. 25 «Взаимодействие с водой ЩМ» работа с ПСХЭ Д. И. Менделеева. Работа с рис. 26 «Гашение извести» работа с рис. 27 « Природные соединения кальция» работа с рис. 28 «Скульптуры»
| Тест, фронтальный опрос | П.12, упр.2, 5. |
| 20/11 |
|
| Алюминий.
| 1
| Л. О. № 5 «Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей» Демонстрация № 6 «Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей» | Работа с ПСХЭ Д. И. Менделеева. Работа с рис. 29 «Восстановление алюминием железа из его оксида» Рис. 30 «Схема электролизной установки для получения Аl» работа с рис. 31 «Основные области применения Аl его сплавов»
| Тест, карточки – задания, химическое лото | П. 13, упр. 8. |
| 21/12 |
|
| Соединения алюминия.
| 1 |
| Работа с рис. 32 «Природные соединения Аl» , рис. 33 «Получение гидроксида алюминия», рис. 34 «Химические свойства гидроксида алюминия» | Тест, фронтальный опрос | П. 13, упр.1 – 3, 4 |
| 22/13 |
|
| Железо, его строение, физические и химические свойства.
| 1 | Л. О № 6 «Качественные реакции на ионы железа (II) и (III) Демонстрация № 7 «Получение гидроксидов железа (II) (III)» | Работа с ПСХЭ Д. И. Менделеева, работа с рис. 3 5 «Качественная реакция на ионы железа» Работа со схемами на стр. 79.
| Тест, химический диктант | П. 14, упр.4., подготовиться к выполнению практической работы № 1. |
| 23/14 |
|
| Т. Б. Практическая работа № 1 «Осуществление цепочки химических превращений»
Правила техники безопасности | 1 | Практическая работа № 1 «Осуществление цепочки химических превращений» | Работа в парах по выполнению и оформлению практической работы с помощью инструктивной карточки.
| отчет о выполнении практической работы | КОНСПЕКТ |
| 24/15 |
|
| Генетические ряды железа (II) и железа (III). Важнейшие соли железа.
| 1 | Работа по карточкам заданиям по составлению генетической связи железа (II) и (III) Демонстрация № 8«Коллекция образцов неметаллов в различных агрегатных состояниях» | Работа в группах, парах и индивидуально. Работа с карточками – заданиями
| Отчет в тетради о решении химических уравнений | П. 14 № 4, 5, 6 на стр. 78 – 82, подготовиться к практической работе № 2. |
| 25/16 |
|
| Т. Б. Практическая работа №2. Получение и свойства соединений металлов.
Правила техники безопасности | 1 | Практическая работа № 2 «Получение и свойства соединений металлов» | Работа в парах по выполнению и оформлению практической работы с помощью инструктивной карточки | Отчет о выполнении практической работы | Конспект, подготовиться к практической работе № 3. |
| 26/17 |
|
| Т. Б. Практическая работа № 3. Экспериментальные задачи по распознаванию и получению веществ
| 1 | Практическая работа № 3 «Экспериментальные задачи по распознаванию и получению веществ» | Работа в парах по выполнению и оформлению практической работы | отчет о выполнении практической работы | Конспект |
| 27/18 |
|
| Обобщение и систематизация знаний по теме.
| 1 | . | Сообщения и презентации на тему: «Металлы» | Фронтальный опрос, презентации | Повторить с П. 5 – П. 14 |
| 28/19 |
|
| Контрольная работа № 2 по теме «Металлы»
Тематический контроль знаний | 1 | Контрольная работа | Тестовая текущая контрольная работа | Контрольный тест | Повторить с П. 4 по П.14. |
| 29/20 |
|
| Анализ результатов контрольной работы | 1 |
| Работа с учебником, работа с ПСХЭ Д. И. Менделеева |
|
|
|
Тема № 3 «Неметаллы» (26 часов) |
| |
|
| 30/1 |
|
| Неметаллы: атомы и простые вещества. Воздух. Кислород. Озон. | 1 |
| Работа с ПСХЭ Д. И. Менделеева, работа с рис. 37 «Положение хим. элементов – неметаллов в ПСХЭ» Работа с рис. 38 «Озонатор» Работа с таблицей № 6 на стр. 91. Работа с рис. 39 «Перегонка жидкого воздуха» |
| П. 15, 16 упр. 3.б) в) |
| 31/2 |
|
| Водород, его физические и химические свойства.
| 1 |
| Работа с рис. 43 «Получение водорода взаимодействием соляной кислоты и цинка и собирание водорода метом вытеснения воздуха» Работа с рис. 44 «Получение водорода взаимодействием кальция с водой и собирание водорода методом вытеснения воды» Работа с рис. 45 «Взаимодействие оксида меди (II) с водородом. Работа с рис. 46 «Применение водорода» Работа с рис. 46 «Приборы, используемые для лабораторного получения водорода» | Тест, проверочная работа по химическим терминам и понятиям | П. 17, упр.4 |
| 33/3 |
|
| Галогены.
| 1
| Л. О. № 7 «Качественная реакция на хлорид – ион» | Работа с таблицей 7 на стр. 105, работа с рис. 48 «Температуры плавления и кипения галогенов» работа с рис. 49 «Длина связи в молекулах галогенов» работа с ПС ХЭ работа со схемами уравнений на стр. 107 – 108 | Тест, фронтальный опрос | П. 18, стр. 109, № 1. |
| 34/4 |
|
| Соединения галогенов.
| 1 | Демонстрация № 9 «Образцы галогенов – простых веществ» | Работа с рис. 51 «Растворение хлороводорода в воде», Работа с рис. 52 «Получение хлороводорода» Работа с рис. 53 «Применение соляной кислоты» работа с рис. 54 «Качественные реакции на галогенид – ионы», с рис. 55, рис. 56, рис. 57, рис. 58, рис. 59 | тест | П. 19, упр.3, 4 стр. 115 |
| 35/5 |
|
| Получение галогенов. Биологическое значение и применение галогенов и их соединений.
.
| 1 |
Демонстрация № 10 «Получение хлороводорода и его растворение в воде. Образцы природных соединений» | Работа с рис. 60 «Модель лабораторной установки для электролиза» Работа с рис. 61 «Получение хлора лабораторным способом» Работа с рис. 62 «Применение хлора и его соединений»
| Фронтальный опрос, тест | П. 20, подготовить сообщение о значении галогенов и их соединений |
| 36/6 |
|
| Кислород.
| 1
| Л. О. № 8 «Знакомство с образцами природных оксидов солей, кислородсодержащих кислот» Демонстрация № 11«Получение кислорода и его взаимодействие с простыми веществами» | Работа с ПСХЭ Д. И. Менделеева, работа с рис. 63 «Распространение химических элементов в земной коре (по массе)» работа с рис. 64 «Газообмен в легких и тканях» Работа с рис. 65 «Фотосинтез» Работа с рис. 68 «Применение кислорода» Работа с рис. 69 «Хранение кислорода» Работа с рис. 66 «Образование современной атмосферы» Работа с рис. 67 «Круговорот кислорода в природе» | Текущий контроль – опрос, по учебнику стр. 129 № 1,2, 8 | П.21, упр.3, 4 |
| 37/7 |
|
| Сера и ее соединения.
| 1 | Л. О. № 9 «Знакомство с образцами природных соединений серы» Демонстрация № 12 «Взаимодействие серы с металлами и кислородом» | Работа по созданию модели молекулы серы (рис. 70) рис. 71 «Взаимопревращения аллотропных модификаций серы» работа с таблицей 8 «Сера в в природе» Работа с рис. 72 «Сера – основное сырье для производства серной кислоты», рис. 73 «Эксикатор – прибор для осушения веществ» Рис. 74 «Обугливание серной кислоты» рис. 75 «Качественная реакция на сульфат – ион», рис. 76 «Применение серной кислоты» Рис. 77 «Доля расхода серной кислоты на различные нужды промышленного производства»
| Текущий контроль, самостоятельная работа 4-5 человек, фронтальный опрос | П. 22, 23, составить конспект П. 22 и П. 23. |
| 38/8 |
|
| Серная кислота. Окислительные свойства серной кислоты.
. | 1 | Л. О. № 10. «Распознавание сульфат – иона» Демонстрация № 13 «Взаимодействие разбавленной серной кислоты с металлами, оксидами металлов, растворимыми и нерастворимы гидроксидами металлов»
| Составление хим. уравнений Рис. 74 «Обугливание серной кислоты» рис. 75 «Качественная реакция на сульфат – ион», рис. 76 «Применение серной кислоты» Рис. 77 «Доля расхода серной кислоты на различные нужды промышленного производства».
| Тест, презентация- опрос |
П. 23, стр. 141 № 3, 8. |
| 39/9 |
|
| Решение задач и упражнений. Обобщение и систематизация знаний по теме.
| 1 |
| Решение задач по теме: «Кислород и сера» | Самостоятельная работа | Повторить П. 21 - 23 |
| 40/10 |
|
| Азот.
| 1
|
| Работа с рис. 78 « Взаимодействие азота с кислородом в природе при грозах» работа с ПС ХЭ, работа с рис. 80 «Круговорот азота в природе» Составление хим. уравнений | тест | П. 24, упр.4 |
| 41/11 |
|
| Аммиак | 1
| Демонстрация № 14 «Получение, собирание и распознавание аммиака» | Работа с ПС ХЭ , рис. 81 «Строение молекулы аммиака» работа с рис. 82 «Растворение аммиака в воде» работа с рис. 82 « Дым без огня», рис. 84 «Промышленная установка и схема промышленного получения аммиака» Работа со схемой рис. 85 «Применение аммиака и солей аммония» | Самостоятельная работа тест | П. 25, упр.1, 2, 3 |
| 42/12 |
|
| Соли аммония.
| 1 | Л. О. № 11 «Распознавание катиона аммония» | Работа с рис. 86 « Качественная реакция на ион аммония» работа с рис. 87 «Возгонка хлорида аммония». Работа с рис. 88 «Использование азотных удобрений» | Работа по карточкам (решение задач) | П. 26, упр. 2, стр. 155 |
| 43 – 44/ 13 – 14 |
|
| Кислородные соединения азота. Азотная кислота и ее соли. Окислительные свойства азотной кислоты.
| 2 | Урок изучения нового материала Демонстрация № 15. «Взаимодействие конц. азотной кислоты с медью» | Опыты по горению лучинки в азотной кислоте Рис. 89. Заполнение таблицы «Азотная кислота и её соли» | Тест, решение задач на оценку | П. 27, упр. 2, 4, |
| 45/15 |
|
| Фосфор и его соединения.
| 1
| Демонстрация № 16 «Образцы природных соединений фосфора. Получение белого фосфора из красного» | Опыт, иллюстрирующий переход красного фосфора в белый. Работа с ПСХЭ составление хим. уравнений | Тест Решение уравнений на оценку и окислительно – восстановительных процессов | П. 28, упр.3, 2 |
| 46/16 |
|
| Решение задач и упражнений. Обобщение и систематизация знаний по теме: « Подгруппа азота»
| 1 |
| Решение задач по теме: «Подгруппа азота» | Решение задач по карточкам – заданиям и у доски | Повторить П. 24 – 28, стр. 101 - 118 |
| 47/17 |
|
| Углерод.
|
1 |
| Работа с рис. 93 «Строение алмаза» Работа с рис. 94 «Звезда ордена Святого Андрея Первозванного» Работа с рис. 95 «алмаз Шах» Работа с рис. 96 «строение графита» Работа с рис. 97 «Пористая структура активированного угля» Работа с рис. 98 «Адсорбция оксида азота активированным углем» Работа со схемой на рис. 99 «Применение углерода» Работа со стр. 170 на рис. 100 «Круговорот углерода в природе» Работа с ПСХЭ. | Тест Фронтальный опрос | П. 29, упр. 6 |
| 48/18 |
|
| Кислородные соединения углерода.
| 1 | Демонстрация № 17«Образцы природных соединений» Демонстрация № 18 «Получение, собирание, распознавание углекислого газа» | Работа в парах. Работа со схемой на стр. 173. Работа с рис. 101 «Гашение пламени углекислым газом» Работа с рис. 102 «Лабораторная установка для получения углекислого газа» Работа со схемой рис. 103 «Применение углекислого газа» Работа с рис. 14 «Сталактиты и сталагмиты» Работа с рис. 105 «Качественная реакция на карбонат – ион» Л. О. № 12 «Качественная реакция на карбонат – ион» | Тест, фронтальный опрос, химических диктант | §30 стр. 178 №5,6 |
| 49/19 |
|
| Угольная кислота и её соли.
| 1 |
| Работа с дополнительной литературой Просмотр и обсуждение презентации на тему: «Угольная кислота и её соли» | Фронтальный опрос. | П. 30, упр. 6 . |
| 50/20 |
|
| Кремний и его соединения.
| 1
| Л. О. № 13 «Ознакомление с природными силикатами» Л. О. № 14 «Ознакомление с продукцией силикатной промышленности» Демонстрация № 19 «Образцы природных соединений кремния. Образцы стекла, керамики, цемента» | Работа по дидактическим материалам Работа с ПСХЭ Д. И. Менделеева
| Опрос по карточкам - заданиям | Д.З.§31 стр. 185 №1,2 |
| 51/21 |
|
| Решение задач и упражнений. Обобщение и систематизация знаний по теме "Подгруппа углерода"
| 1 |
| Решение задач по карточкам – заданиям | Тестовые задания Решения задач по теме «Подгруппа углерода» | Д.З. повторить §29-30, |
| 52/22 |
|
| Обобщение и систематизация знаний по теме «Неметаллы».
| 1 |
| Работа с учебником. Работа с иллюстрациями. Работа с карточками – заданиями Работа с ПСХЭ Д. И. Менделеева | Тест, фронтальный опрос | повторить §29-30 задачи в тетради |
| 53/23 |
|
| Контрольная работа №3 по теме:«Неметаллы» | 1 | Контрольная работа № 3 «Неметаллы»
| Разноуровневая контрольная работа по теме «Неметаллы» | Тестовый контроль | Подготовиться к практической работе № 4 |
| 54/24 |
|
| Т. Б. Практическая работа № 4. Экспериментальные задачи по теме: «Подгруппа кислорода» | 1 | Практическая работа № 4 Экспериментальные задачи по теме: «Подгруппа кислорода» | Работа в парах по выполнению и оформлению практической работы | отчет о выполнении практической работы | Конспект повторить, подготовиться к практической работе № 5 стр. 188 – 189. |
| 55/25 |
|
| Т. Б. Практическая работа № 5. Экспериментальные задачи по теме: «Подгруппа азота и углерода» | 1 | Практическая работа № 5 Экспериментальные задачи по теме: «Подгруппа азота и углерода» | Работа в парах по выполнению и оформлению практической работы | отчет о выполнении практической работы | Конспект, подготовиться к практической работе № 6 стр. 189 – 192 |
| 56/26
|
|
| Т. Б. Практическая работа № 6. «Получение, собирание и распознавание газов» | 1 | Практическая работа № 6 «Получение, собирание и распознавание газов» | Работа в парах по выполнению и оформлению практической работы | отчет о выполнении практической работы | Конспекты повторить |
| Тема № 5 «Первоначальные сведения об органических веществах» (10 часов) |
| 57/1 |
|
| Предмет органической химии. Особенности органических веществ.
| 1 |
| Работа по составлению химических формул органических веществ | Фронтальный опрос | П. 32, упр. 1, 6 |
| 58/2 |
|
| Углеводороды. Предельные и непредельные.
| 1
| Демонстрация № 20 «Образцы нефти, каменного угля, продуктов их переработки, горение углеводородов и обнаружение продуктов их горения» |
Работа с гомологическим рядом предельных и непредельных углеводородов
| Текущий, работа в парах, работа по карточкам индивидуальная, стр. 205 №2, стр. 210 № 1-3 устно. | П. 33, 34, подготовиться к практической работе № 7. |
| 59/3 |
|
| Спирты.
| 1
| демонстрация № 21 «Образцы спиртов» | Работа с рис. 121 «Модели молекул метилового спирта» Работа с рис. 122 «Модели молекул этилового спирта» Работа с рис. 123 «Модели молекулы этиленгликоля» Работа с рис. 124 «Модели молекулы глицерина» Работа с рис. 125 «Качественная реакция на многоатомные спирты» | Текущий опрос стр. 216 №1-3 | П. 35, стр. 216, № 4, 5 |
| 60/4 |
|
| Предельные одноосновные карбоновые кислоты. Сложные эфиры.
| 1 | Демонстрация № 22 «Образцы кислот (муравьиной, уксусной, стеариновой) | Работа с рис. 126 «Модели молекулы уксусной кислоты» Работа по составлению реакций этерификации. Работа с карточками – заданиями Л. О. № 16 «Изготовление моделей молекул углеводородов» | Текущий опрос, индивидуальная работа по карточка | П. 36, упр. 2, 3 |
| 61, 62, 63/ 5, 6, 7
|
|
| Биологически важные вещества: жиры, белки, углеводы.
| 3 | Демонстрация № 23 «Качественные реакции на белки» Демонстрация № 24 «Качественная реакция на крахмал» | Опыты на качественные реакции на белки, жиры, углеводы. Просмотр презентации «Белки, жиры, углеводы» Л. О № 15 «Взаимодействие крахмала с йодом» | Фронтальный опрос, стр. 231 №1-3 (устно) | П. 36, 37, 38, 39 конспект |
| 64/8 |
|
| Полимеры.
| 1
| Демонстрация № 25 «Образцы изделий из полиэтилена» | Работа с рис. 131 «Структура полимеров» Работа по составлению реакции полимеризации | Текущий опрос | П. 40, упр. 2. 4.
|
| 65/9 |
|
| Подготовка к контрольной работе по теме: «Органические соединения» | 1
|
| Работа с учебником |
| Подготовка к контрольной работе |
| 66/10 |
|
| Контрольная работа № 4 по теме :«Органические соединения».
| 1 | Контрольная работа № 4 по теме: «Органические вещества» |
| Текущий опрос | Повторить конспекты |
|
Тема № 6 «Повторение основных вопросов курса химии 9 класса» (2 часа) |
|
|
|
|
|
|
| 67/1 |
|
| Классификация и свойства неорганических и органических веществ.
|
|
| Работа с учебником | Тематический контроль | Повторить с П. 1 - 39 |
| 68/2 |
|
| Итоговая контрольная работа № 5 за курс 9 класса
| Итоговая контрольная работа за курс 9 класса | Итоговая контрольная работа за курс 9 класса |
| Итоговый тестовый контроль |
|
Итого – 68 часов
Согласовано:
Заместитель директора по УВР:
_________/И. М. Ушанёва/.
«____»_______________ 2014 год
Интернет– ресурсы
http://www.alhimik.ru/ Алхимик. Сайт предлагает разнообразный материал для учителей, учащихся, абитуриентов и студентов.
http://him.1september.ru/index.php Журнал «Химия».
www.km.ru/education Учебные материалы и словари на сайте «Кирилл и Мефодий».
http://katalog.iot.ru/?cat=23 Электронная версия каталога "Образовательные ресурсы сети Интернет для основного общего и среднего (полного) общего образования".
http://www.edu.ru/ Российский общеобразовательный портал.
http://en.edu.ru/ Естественнонаучный образовательный портал. Портал является составной частью федерального портала "Российское образование". Содержит ресурсы и ссылки на ресурсы по естественнонаучным дисциплинам (физика, химия, биология и математика): базы данных и справочники; задачники и тесты; методические материалы и лабораторные практикумы; наглядные пособия; хрестоматии, учебники, лекции.
http://school-collection.edu.ru/ Единая коллекция цифровых образовательных ресурсов.
http://www.uchportal.ru Учительский портал.
http://www.xumuk.ru/ Сайт о химии.
http://www.chem.msu.su/rus/elibrary/ Электронная библиотека учебных материалов по химии.
Диски.
1. Неорганическая химия. В помощь учителю. – Волгоград: Учитель, 2007
Диагностическая контрольная работа по химии
( курс повторения 8 класса)
Вариант 1
Задание № 1. Дайте характеристику химического элемента по плану:
1. Знак и название элемента (1 балл);
2. Положение элемента в П.С. (1 балл);
3. Состав атома элемента (1 балл);
4. Строение атома элемента (1балл – распределение электронов по уровням,
1 балл – электронная формула, 1 балл – графическая формула);
5. Свойства атома (1 балл);
6. Возможные степени окисления (1 балл).
Задание № 2.
Определите тип химической связи в веществах: MgО, F2, HCl.
Запишите схему образования связи для любого из предложенных веществ.
(3 балла за определение вида связи, 2 балла за схему образования связи)
Задание № 3. Решите уравнения:
- Допишите уравнения реакций. (1 балл за уравнение)
- Расставьте коэффициенты. (1 балл за уравнение)
- Определите тип реакций. (0,5 балла за уравнение)
- Для реакции ионного обмена запишите полное и краткое ионные уравнения.
(2 балла)
1) Na + S = Na2S
2) Fe (OH)2 =
3) K2SO4 + Ba (OH)2 =
4) Zn + CuSO4 = ZnSO4 + Cu
Задание № 4. Решите любую задачу по выбору.
1) (1 балл) Вычислите относительную молекулярную массу сульфата натрия.
2) (2 балла) Рассчитайте массу (н.у.) 1,5моль NO.
3) (3 балла) Объём газа SO2.составляет 4,48 литра. Рассчитайте массу данного газа и число молекул, содержащихся в данном объёме?
4) (5 баллов) Какое количество вещества меди вступит в реакцию с 2 моль кислорода, если при этом образуется оксид меди (II) (CuO)?
5) (8 баллов) Рассчитайте массу осадка, полученного при взаимодействии
32 грамм CuSO4 с раствором KOH?
Результат:
Оценка «3» - 13,5 – 16,5 балла
Оценка «4» - 17,0 - 23 баллов
Оценка «5» - 23,5 и более баллов
Желаю успеха.
Диагностическая контрольная работа по химии
( курс повторения 8 класса)
Вариант 2
Задание № 1. Дайте характеристику химического элемента по плану:
1. Знак и название элемента (1 балл);
2. Положение элемента в П.С. (1 балл);
3. Состав атома элемента (1 балл);
4. Строение атома элемента (1 балл – распределение электронов по уровням; 1 балл – электронная формула атома; 1 балл – графическая формула атома);
5. Свойства атома элемента (1 балл);
6. Возможные степени окисления (1 балл).
Задание № 2.
Определите тип химической связи в веществах: СaCl2, O2, HF.
Запишите схему образования связи для любого из предложенных веществ.
(3 балла за определение вида связи, 2 балла за схему образования связи)
Задание № 3. Решите уравнения:
- Допишите уравнения реакций. (1 балл за уравнение)
- Расставьте коэффициенты. (1 балл за уравнение)
- Определите тип реакций. (0,5 балла за уравнение)
- Для реакции ионного обмена запишите полное и краткое ионные
уравнения. (2 балла)
1) Al + S = Al2S3
2) Cu (OH)2 =
3) H2SO4 + KOH =
4) Fe + AgNO3 = Fe(NO3)2 + Ag
Задание № 4. Решите любую задачу по выбору.
1) (1 балл) Вычислите относительную молекулярную массу карбоната калия.
2) (2 балла) Рассчитайте объём (н.у.) 1,5 моль CO.
3) (3 балла) Масса газа CO2.составляет 8,8 граммов. Какой объём займёт этот газ, сколько молекул газа находится в данной массе вещества?
4) (5 баллов) Какое количество вещества магния вступит в реакцию с 2 моль кислорода, если при этом образуется оксид магния?
5) (8 баллов) Рассчитайте объём газа, полученного при взаимодействии
8,1 грамма алюминия с раствором серной кислоты (H2SO4)?
Результат:
Оценка «3» - 13,5 – 16,5 балла
Оценка «4» - 17,0 - 23 балла
Оценка «5» - 23,5 и более баллов
Желаю успеха.
КОНТРОЛЬНАЯ РАБОТА №2 по химии для учащихся 9 класса
по теме: ”Металлы”. Вариант №1
ЧАСТЬ С.
Напишите уравнения реакций, характеризующих химические свойства натрия.\ 4б.\
Какие свойства алюминия определили его широкое применение в технике?
\ 3б.\
Напишите уравнения реакций, с помощью которых можно осуществить
следующие превращения:
Ca—CaO—Ca(OH)2—CaCO3—CaCl2. \5 б.\
Калий массой 19,5 г поместили в 72 г воды. Вычислите массу образовавшегося гидроксида калия. \6 б.\
ЧАСТЬ А. Тестовые задания с выбором ответа.
(2 балла). Электронная формула атома лития:
А. 1S2 2S2. Б. 1S2 2S1. B. 1S2 2S2 2p1. Г. 1S2 2S2 2p6 3S1.
2. (2 балла). Электронная формула внешнего энергетического уровня атомов
щелочных металлов:
А. ns1. Б. ns2. В. ns2 np1. Г. ns2 np2.
3. (2 балла). Вид химической связи в простом веществе натрий:
А. Ионная Б. Ковалентная полярная
В. Ковалентная неполярная Г. Металлическая
4. (2 балла). Простое вещество с наиболее ярко выраженными металлическими
свойствами:
А. Алюминий. Б. Бор. В. Галлий. Г. Индий.
5. (2 балла). Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается.
6. (2 балла). Атом кальция отличается от иона кальция:
А. Зарядом ядра. В. Числом протонов. Г. Числом нейтронов.
Б. Числом электронов на внешнем энергетическом уровне.
7. (2 балла). Наиболее энергично реагирует с водой:
А. Барий. Б. Кальций. В. Магний. Г. Стронций.
8. (2 балла). С соляной кислотой не взаимодействует:
А. Алюминий. Б. Магний. В. Серебро. Г. Цинк.
9. (2 балла). Гидроксид алюминия взаимодействует с веществом, формула которого:
А. BaSO4. Б. NaOH. B. KCl(p-p). Г. NaNO3 (p-p).
10. (2 балла). Ряд, в котором все вещества реагируют с железом:
А. HCl, CO2, CO. Б. Cl2, CuCl2, HCl.
B. H2, O2, CaO. Г. SiO2, HCl, S.
11. (2 балла). Элементом Э в схеме превращений Э---Э2О—ЭОН является:
А. Барий. Б. Литий. В. Серебро. Г. Углерод.
ЧАСТЬ В.
Дать определение сплавам, их классификация и свойства. Важнейшие сплавы и их
значение в жизни общества. \4 б.\
Перечислить основные физические свойства металлов.\4 б.\
Приведите примеры металлов: а) лёгких и тяжёлых; б) мягких и твёрдых.\4 б.\
В виде каких соединений железо встречается в природе, где они применяются?\4б.\
У какого из щелочных металлов, лития или натрия, ярче выражены металлические
свойства? Объясните почему. \4 б.\
КОНТРОЛЬНАЯ РАБОТА №2 по химии для учащихся 9 класса
по теме: ”Металлы”. Вариант №2
ЧАСТЬ С.
Напишите уравнения реакций, характеризующих химические свойства магния.\4б.\
На стальной крышке поставлена медная заклёпка. Что раньше разрушится –
крышка или заклёпка? Почему? \3 б.\
Напишите уравнения реакций, с помощью которых можно осуществить следующие
превращения: Li—Li 2O—LiOH—Li 2SO4. \5 б.\
|
LiOH
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н.у.)
Найдите объёмную долю выхода продукта реакции (в %). \6 б.\
ЧАСТЬ А. Тестовые задания с выбором ответа.
(2 балла). Электронная формула атома алюминия:
А. 1S2 2S2 2p6 3S2 3p1. В. 1S2 2S2 2p6 3S2 3p2.
Б. 1S2 2S2 2p6 3S1. Г. 1S2 2S2 2p6.
2. (2 балла). Электронная формула внешнего энергетического уровня атомов щелочно-
земельных металлов:
А. ns1. Б. ns2. В. ns2 np1. Г. ns2 np2.
3. (2 балла). Вид химической связи в простом веществе магнии:
А. Ионная. Б. Ковалентная полярная.
В. Ковалентная неполярная . Г. Металлическая.
4. (2 балла). Простое вещество с наиболее ярко выраженными металлическими
свойствами: А. Калий. Б. Литий. В. Натрий. Г. Рубидий.
(2 балла). Радиус атомов элементов главной подгруппы с увеличением заряда ядра:
А. Изменяется периодически. Б. Не изменяется.
В. Увеличивается. Г. Уменьшается.
6. (2 балла). Атом и ион натрия отличаются:
А. Зарядом ядра. Б. Радиусом частиц.
В. Числом протонов. Г. Числом нейтронов.
7. (2 балла). Наиболее энергично реагирует с водой:
А. Al. Б. K. B. Ca. Г. Mg.
8. (2 балла). С соляной кислотой не взаимодействует:
А. Железо. Б. Кальций. В. Медь. Г. Цинк.
9. (2 балла). Гидроксид алюминия не взаимодействует с веществом, формула которого:
А. HCl (p-p). Б. КОН. В. КNO3 (p-p). Г. Cu(OH)2.
10. (2 балла). Ряд, в котором все вещества реагируют с магнием:
А. S, H2O, NaOH. В. Li, H2SO4, CO2.
Б. Cl2, O2, HCl. Г. CuO, Cu(OH)2, H3PO4.
11. (2 балла). Элементом Э в схеме превращений Э—ЭО—Э(ОН)2 является
А. Алюминий. Б. Барий. В. Железо. Г. Медь.
ЧАСТЬ В.
Чем обусловлена жёсткость воды? Почему жёсткую воду нельзя употреблять в паровых котлах? \4 б.\
Что такое коррозия металлов? Какие виды коррозии вам известны? Какие факторы способствуют замедлению, а какие – усилению коррозии металлов? \4 б.\
Приведите примеры металлов: а) тугоплавких и легкоплавких;
б) серебристо-серых и имеющих цвет. \4 б.\
4. В каком виде встречаются металлы в природе? Почему? \4 б.\
5. Почему легкий и прочный металл кальций не применяется в авиационной промышленности и других областях машиностроения? \4 б.\
Контрольная работа по химии 9 класс. Автор – О. С. Габриелян
Классификация органических соединений
ВАРИАНТ 1
1. Установите соответствие между классификацией углеводородов и их названиями:
Классификация Названия
А) алканы 1) бензол
2) этилен
Б) алкены 3) бутадиен -1,3
4) ацетилен
В) алкины 5) метан
6) циклогексан
Г) циклоалканы 7) метанол
2. Углеводороды – вещества, которые состоят из
1) углерода, водорода и кислорода 2) водорода и углерода
3) углерода, водорода и азота 4) углерода и кислорода
3. Какие углеводороды относятся к ряду этилена и являются алкенами?
1) пропилен 4) пропин
2) пропан 5) пентилен
3) бензол 6) дивинил
4. Какие углеводороды относятся к ряду ацетилена и являются алкинами?
1) пропен 4) пропин
2) пропан 5) этин
3) этен 6) этан
5. Заполните таблицу формулами органических веществ
| Алканы СnH2n+2 | Алкены СnH2n | Алкины СnH2n-2 | Циклопарафины СnH2n | Спирты СnH2n+1ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С 3Н 6 , С 6Н10 ,С Н 4 ,С 10Н 22,С4 Н16 ,С3 Н 7ОН, С8Н16, С2Н4, С5Н12, С4Н6, С5Н11ОН, С3Н8
Контрольная работа по химии 9 класс.
Классификация органических соединений
Вариант 2.
1. Установите соответствие между классификацией углеводородов и их названиями:
Классификация Названия
А) алканы 1) циклопентан
2) этен
Б) алкены 3) бутин
4) этанол
В) алкины 5) октан
6) глицерин Г) циклоалканы 7) метанол
2. Углеводороды – вещества, которые состоят из
1) углерода, водорода и кислорода 3) водорода и углерода
2) углерода, водорода и азота 4) углерода и кислорода
3. Какие углеводороды относятся к ряду этилена и являются алкенами?
1) пропан 4) пропин
2) пропен 5) пентанол
3) дивинил 6) этен
4. Какие углеводороды относятся к ряду ацетилена и являются алкинами?
1) пропин 4) пропен
2) пропан 5) этен
3) этин 6) этан
5. Заполните таблицу формулами органических веществ
| Алканы СnH2n+2 | Алкены СnH2n | Алкины СnH2n-2 | Циклопарафины СnH2n | Спирты СnH2n+1ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С 2Н 6 , С 5Н8 ,С Н 4 ,С 14Н 30,С5 Н32 ,С2 Н 5ОН, С10Н20, С7Н14, С5Н10, С3Н4, С7Н15ОН, С4Н16
Контрольная работа по химии
Классификация органических соединений
Вариант 3.
1. Установите соответствие между классификацией углеводородов и их названиями:
Классификация Названия
А) алканы 1) пентен
2) циклопентан
Б) алкены 3) бутадиен -1,3
4) бутин
В) алкины 5) метанол
6) гексан Г) циклоалканы 7) фенол
2. Углеводороды – вещества, которые состоят из
1) водорода и кислорода 2) водорода,кислорода и углерода
3) углерода и водорода 4) углерода и кислорода
3. Какие углеводороды относятся к ряду этилена и являются алкенами?
1) бутилен 3) пропилен 5) пропин
2) бутан 4) пентанол 6) бутин
4. Какие углеводороды относятся к ряду ацетилена и являются алкинами?
1) пропен 4) пропан
2) пропин 5) этен
3) этан 6) этин
5. Заполните таблицу формулами органических веществ
| Алканы СnH2n+2 | Алкены СnH2n | Алкины СnH2n-2 | Циклопарафины СnH2n | Спирты СnH2n+1ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С 3Н 6 , С 6Н10 ,С Н 4 ,С 10Н 22,С4 Н16 ,С3 Н 7ОН, С8Н16, С2Н4, С5Н12, С4Н6, С5Н11ОН, С3Н8
______________________________________________________________________
Контрольная работа по химии 9 класс
Классификация органических соединений
Вариант 4
1. Установите соответствие между классификацией углеводородов и их названиями:
Классификация Названия
А) алканы 1) этен
2) бензол
Б) алкены 3) гексан
4) гексаген
В) алкины 5) этанол
6) циклогептан Г) циклоалканы 7) гексин
2. Углеводороды – вещества, которые состоят из
1) углерода, водорода и кислорода 3) водорода и углерода
2) углерода, водорода и азота 4) углерода и кислорода
3. Какие углеводороды относятся к ряду этилена и являются алкенами?
1) гептилен 4) пропин
2) нонан 5) гексен
3) бензин 6) дивинил
4. Какие углеводороды относятся к ряду ацетилена и являются алкинами?
1) бутен 4) децен
2) бутан 5) децин
3) декан 6) бутин
5. Заполните таблицу формулами органических веществ
| Алканы СnH2n+2 | Алкены СnH2n | Алкины СnH2n-2 | Циклопарафины СnH2n | Спирты СnH2n+1ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С 3Н 8 , С 6Н10 ,С 8Н 18 ,С 11Н 24,С4 Н6 ,С3 Н 7ОН, С8Н16, С2Н4, С5Н12, С4Н16, С 4Н9ОН, С3Н6
Итоговая контрольная работа по химии 9 класс
Вариант 1
ЧАСТЬ 1
| К каждому из заданий А1-А19 даны 4 варианта ответов, из которых только один правильный. Номер этого ответа обведите кружком.
|
А1. Число электронов во внешнем электронном слое атома с зарядом ядра +9 равно
1
5
3
7
А2. Металлические свойства у магния выражены сильнее, чем у
бериллия
калия
кальция
натрия
А3. Веществом с ионной связью является
оксид серы (VI)
водород
магний
фторид натрия
А4. Степень окисления железа в соединениях Fe2O3 и FeCl2 соответственно равны
+3 и -2
+3 и +3
+3 и +2
-3 и +2
А5. Кислотным оксидом является
SO2
CO
ZnO
4) Na2O
А6. К физическим явлениям относят
скисание молока
засахаривание варенья
горение свечи
пригорание пищи
А7. Какое уравнение соответствует реакции соединения?
NH3 + HNO3 = NH4NO3
H2S + MgO = MgS + H2O
SO3 + 2NaOH =Na2SO4 +H2O
CuO + H2 = Cu + H2O
А8. К хорошо растворимым в воде электролитам относится
1) сульфат бария
2) сульфат цинка
3) сульфид меди(II)
4) оксид железа(III)
А9. Наибольшее количество ионов аммония образуется при полной диссоциации 1 моль
сульфата аммония
сульфида аммония
нитрата аммония
фосфата аммония
А10. Выделение газа происходит в результате взаимодействия ионов
H+ u CI-
H+ u SO32-
NH4+ u PO43-
NH4+ u S2-
А11. Кислород не реагирует с
1) оксидом углерода(IV)
2) сероводородом
3) оксидом фосфора(III)
4) аммиаком
А12. Оксид углерода(IV) взаимодействует с
1) KNO3
2) P2O5
3) Ca(OH)2
4) HCI
A13. В реакцию с раствором гидроксида кальция вступает каждое из двух веществ:
CO2 u CuCI2
CuO u HCI
HNO3 u NaCI
AI(OH)3 u KNO3
А14. Продуктами реакции оксида алюминия с разбавленной серной кислотой является
1) →AI2(SO4)3 + H2↑
2) →AI2O3 + H2↑ + SO3
3) → AI2O3 + H2O + SO2↑
4) → AI2(SO4)3 + H2O
А15. С раствором фосфата натрия реагирует
Fe(OH)3
AgNO3
H2SiO3
MgO
А16. Функциональную группу – COOH содержит
этиловый спирт
этан
этановая кислота
этин
А17. Верны ли следующие суждения о чистых веществах и смесях?
А. Минеральная вода является чистым веществом.
Б. Духи являются смесью веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А18. Качественный состав сульфата железа(III) можно установить, используя растворы, содержащие ионы
1) CI- u Zn2+
2) SO42- u Ag+
3) OH- u Ba2+
4) NO3 u H+
А19. Массовая доля кислорода в силикате бария равна
16,4%
22,5% 32,2
ЧАСТЬ 2
| При выполнении заданий В1-В3 выберите ответы и обведите их номера. Обведенные цифры запишите в указанном месте. |
В1. В ряду химических элементов As – P –N
увеличиваются радиусы атомов
увеличивается электроотрицательность
усиливаются кислотные свойства их высших оксидов
возрастает значение высшей степени окисления
увеличивается число электронов во внешнем электронном слое атомов
В2. И алюминий и оксид серы(IV) реагируют с
хлороводородной кислотой
гидроксидом натрия
кислородом
нитратом бария
углекислым газом
В3. Окислительно-восстановительной является реакция разложения
KMnO4
AI(OH)3
(NH4)2CO3
MgSiO3
HNO3
| При выполнении задания В4 установите соответствие и выпишите ответ. В ответе цифры могут повторяться. |
| В4. Установите соответствие между исходными веществами и продуктами реакции.
|
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
| А)Na2O +H2O→ 1)BaO + NaCI +SO3 Б)Na2SO4 +BaCI2→ 2)NaOH + H2↑ B)H2SO4 + Ba(OH)2→ 3)BaSO4 ↓+ NaCI 4)BaSO4↓ + H2O 5)NaOH
|
ЧАСТЬ 3
| Для ответов на задания С1-С2 используйте отдельный лист (бланк). Запишите сначала номер задания (С1 или С2), а затем ответ к нему. |
С1. Составьте уравнения реакций, с помощью которых можно осу-
ществить следующие превращения:
Fe2O3→X→Fe(OH)3→Fe2O3
C2. К избытку карбоната кальция добавили 73 г раствора с массовой долей соляной кислоты 10%. Вычислите объем (н.у.)
выделившегося газа.
Итоговая контрольная работа по химии 9 класс
Вариант 2
А1. Число электронов во внешнем электронном слое атома с зарядом ядра +9 равно
1)1 2)5 3)3 4)7
А2. Металлические свойства у магния выражены сильнее, чем у
1)бериллия 2)калия 3)кальция 4)натрия
А3. Веществом с ионной связью является
1) оксид серы (VI) 2) водород 3) магний 4) фторид натрия
А4. Степень окисления железа в соединениях Fe2O3 и FeCl2 соответственно равны
+3 и -2
+3 и +3
+3 и +2
-3 и +2
А5. Кислотным оксидом является
SO2
CO
ZnO
4)Na2O
А6. К физическим явлениям относят
скисание молока
засахаривание варенья
горение свечи
пригорание пищи
А7. Какое уравнение соответствует реакции соединения?
NH3 + HNO3 = NH4NO3
H2S + MgO = MgS + H2O
SO3 + 2NaOH =Na2SO4 +H2O
CuO + H2 = Cu + H2O
А8. К хорошо растворимым в воде электролитам относится
1) сульфат бария 3) сульфид меди(II)
2) сульфат цинка 4) оксид железа(III)
А9. Наибольшее количество ионов аммония образуется при полной диссоциации 1 моль
сульфата аммония
2) сульфида аммония
3) нитрата аммония
4) фосфата аммония
А10. Выделение газа происходит в результате взаимодействия ионов
H+ u CI-
H+ u SO32-
NH4+ u PO43-
NH4+ u S2-
А11. Оксид углерода(IV) взаимодействует с
1) KNO3
2) P2O5
3) Ca(OH)2
4) HCI
A12. В реакцию с раствором гидроксида кальция вступает каждое из двух веществ:
1) CO2 u CuCI2
CuO u HCI
HNO3 u NaCI
AI(OH)3 u KNO3
А13. Продуктами реакции оксида алюминия с разбавленной серной кислотой является
1) →AI2(SO4)3 + H2↑
2) →AI2O3 + H2↑ + SO3
3) → AI2O3 + H2O + SO2↑
4) → AI2(SO4)3 + H2O
А14. С раствором фосфата натрия реагирует
Fe(OH)3
AgNO3
H2SiO3
MgO
А15. Функциональную группу – COOH содержит
этиловый спирт
этан
этановая кислота
этин
А16. Верны ли следующие суждения о чистых веществах и смесях?
А. Минеральная вода является чистым веществом.
Б. Духи являются смесью веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А17. Качественный состав сульфата железа(III) можно установить, используя растворы, содержащие ионы
1) CI- u Zn2+
2) SO42- u Ag+
3) OH- u Ba2+
4) NO3 u H+
А18. Массовая доля кислорода в силикате бария равна
16,4%
22,5%
ЧАСТЬ 2
| При выполнении заданий В1-В3 выберите ответы и обведите их номера. Обведенные цифры запишите в указанном месте. |
В1. В ряду химических элементов As – P –N
увеличиваются радиусы атомов
увеличивается электроотрицательность
усиливаются кислотные свойства их высших оксидов
возрастает значение высшей степени окисления
увеличивается число электронов во внешнем электронном слое атомов
В2. И алюминий и оксид серы(IV) реагируют с
хлороводородной кислотой
гидроксидом натрия
кислородом
нитратом бария
углекислым газом
В3. Окислительно-восстановительной является реакция разложения
KMnO4
AI(OH)3
(NH4)2CO3
MgSiO3
HNO3
| При выполнении задания В4 установите соответствие и выпишите ответ. В ответе цифры могут повторяться. |
| В4. Установите соответствие между исходными веществами и продуктами реакции.
| ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
| А)Na2O +H2O→ 1)BaO + NaCI +SO3 Б)Na2SO4 +BaCI2→ 2)NaOH + H2↑ B)H2SO4 + Ba(OH)2→ 3)BaSO4 ↓+ NaCI 4)BaSO4↓ + H2O 5)NaOH
|
ЧАСТЬ 3
| Для ответов на задания С1-С2 используйте отдельный лист (бланк). Запишите сначала номер задания (С1 или С2), а затем ответ к нему. |
С1. Составьте уравнения реакций, с помощью которых можно осу-
ществить следующие превращения:
Fe2O3→X→Fe(OH)3→Fe2O3
C2. К избытку карбоната кальция добавили 73 г раствора с массовой долей соляной кислоты 10%. Вычислите объем (н.у.)
выделившегося газа.
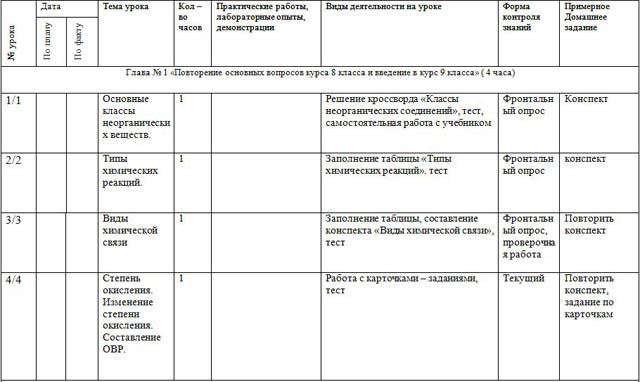

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа и календарно-тематическое планирование по химии (9 класс) (0.42 MB)
Рабочая программа и календарно-тематическое планирование по химии (9 класс) (0.42 MB)
 0
0 4595
4595 547
547 Нравится
0
Нравится
0








