Филиал Муниципального бюджетного общеобразовательного учреждения средней общеобразовательной школы с углубленным изучением отдельных предметов с.Тербуны Тербунского муниципального района Липецкой области в с. Ивановка
РАССМОТРЕНО УТВЕРЖДАЮ
на заседании МО учителей Директор школы
естественно-географического цикла
__________ Филатова Л.А. ___________ Моргачёва Т.Н.
Протокол № 1 от 28.08.2014 г. Приказ № 66 от 29.08.2014 г.
Рабочая программа
по химии
для 8 класса
на 2014-2015 учебный год
(базовый уровень)
учителя первой квалификационной
категории Батуриной Ирины Витальевны
Пояснительная записка
Рабочая программа по химии для 8 класса разработана в целях:
1.Обеспечение конституционного права граждан РФ на получение качественного общего образования;
2. Обеспечение достижения обучающимися результатов обучения по химии в соответствии с Федеральным образовательным стандартом;
3. Овладение системой знаний и умений:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Задачи курса:
вооружить учащихся знаниями основ науки и химической технологии, способами их добывания, переработки и применения;
раскрыть роль химии в познании природы и обеспечении жизни общества, показать значение общего химического образования для правильной ориентации в жизни в условиях ухудшении экологической обстановки;
внести вклад в развитие научного миропонимания ученика;
развить внутреннюю мотивацию учения, повысить интерес к познанию химии;
- развить экологическую культуру учащихся.
Нормативно-правовые документы
Рабочая программа по химии для 8 класса составлена на основании:
1. Федерального Закона от 29.12.12 №273-ФЗ «Об образовании в Российской Федерации».
2. Приказа Министерства образования и науки Российской Федерации от 05.03.2004 №1089 «Об утверждении федерального компонента государственных образовательных стандартов начального общего, основного общего и среднего (полного) общего образования».
3. Приказа Министерства образования и науки Российской Федерации от 09.03.2004 №1312 «Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений РФ, реализующих программы общего образования».
4. Приказа Министерства образования и науки Российской Федерации от 20.08.2008 №241 « О внесении изменений в федеральный базисный учебный план и примерные учебные планы для образовательных учреждений РФ, реализующих программу общего образования ,утверждённые приказом Министерства образования РФ от 09.03.2004 года №1312». (Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений РФ, реализующих программы общего образования).
5. Приказа Министерства образования и науки Российской Федерации от 31.03.2014г. №253 «Об утверждении федеральных перечней учебников, рекомендованных к использованию при реализации имеющих государственную аккредитацию образовательных программ начального общего, основного общего, среднего общего образования».
6. Приказа Министерства образования и науки РФ от 30.08.2010г №889 «О внесении изменений в федеральный базисный учебный и примерные учебные планы для образовательных учреждений Российской Федерации , реализующих программы общего образования, утверждённые приказом Министерства образования РФ от 09.03.2004 года №1312. (Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений РФ, реализующих программы общего образования).
7. Санитарно-эпидемиологических правил и нормативов (Сан ПиН 2.4.2.2821-10).
8. Приказа Управления образования и науки Липецкой области №385 от 23.04.2014 г «О базисных учебных планах для общеобразовательных учреждений Липецкой области, реализующих программы общего образования, на 2014-2015 учебный год».
9. Приказа по муниципальному бюджетному общеобразовательному учреждению средней общеобразовательной школе с углублённым изучением отдельных предметов с.Тербуны Тербунского муниципального района Липецкой области «Об утверждении рабочих программ, учебных курсов, предметов, дисциплин образовательного учреждения, реализующего образовательные программы общего образования» от 29.08.2014г. № 66.
10. Положения о структуре, порядке разработки и утверждения рабочих программ учебных курсов, предметов образовательного учреждения, реализующего образовательные программы общего образования.
11.Устава муниципального бюджетного общеобразовательного учреждения средней общеобразовательной школы с углублённым изучением отдельных предметов с. Тербуны Тербунского муниципального района Липецкой области.
12. Учебного плана филиала МБОУСОШ с углублённым изучением отдельных предметов с. Тербуны в с.Ивановка на 2014-2015 учебный год.
Данная рабочая программа составлена на основании «Программы курса химии для 8-11 классов общеобразовательных учреждений» автор О.С. Габриелян //Программы для общеобразовательных учреждений. Химия 8-11 класс. – М.Дрофа, 2008-г.//
Обоснованием выбора авторской программы является:
- соответствие требованиям федерального базисного учебного плана и федеральным компонентам государственного стандарта;
- соответствие Концепции модернизации Российского образования;
- сохранение принципа преемственности;
- традиционность изложения в сочетании с современными методологическими приёмами построения учебника;
- возможность вариативности содержания материала.
В авторскую программу при разработке рабочей программы внесены изменения количества часов на изучение отдельных тем (увеличение количества часов). Данные изменения позволяют формировать и развивать базовые компетенции учащихся, позволяют повысить интерес к изучению химии.
Для изучения химии в 8 классе Федеральный базисный учебный план для образовательных учреждений Российской Федерации отводит 2 учебных часа в неделю и 1 учебный час в неделю взят из компонента образовательного учреждения.
Приоритетами для учебного предмета «Неорганическая химия» на ступени основного образования на базовом уровне являются: сравнение объектов, анализ, оценка, классификация полученных знаний, поиск информации в различных источниках, умений наблюдать и описывать полученные результаты, проводить элементарный химический эксперимент.
В соответствии с учебным планом и календарным учебным графиком школы рабочая программа по химии для 8 класса рассчитана на 105 часов, 3 часа в неделю, в том числе для проведения 4 контрольных работ и 9 практических работ.
Основной формой организации образовательного процесса при обучении химии в 8 классе является урок: урок изучения нового материала, комбинированный урок, урок-повторение, урок закрепления знаний, урок-практикум, повторительно-обобщающий урок, контрольный урок.
Для реализации рабочей программы используются следующие технологии: информационно-коммуникативная технология, технологии личностно-ориентированного обучения, здоровьесберегающие.
Основные механизмы формирования ключевых компетенций обучающихся : решение тестов, самостоятельная работа, работа в малых группах, поиск информации в различных источниках, работа с таблицами, выполнение практических работ.
Видами и формами контроля при обучении химии в 8 классе являются: текущий контроль в форме тестирования, выполнения самостоятельной работы, устного опроса, выполнения практических работ; итоговый контроль в форме тестирования в формате ГИА.
Планируемый уровень подготовки выпускников на конец учебного года:
в результате изучения химии в 8 классе на базовом уровне ученик должен
знать:
- основные формы существования химического элемента (свободные атомы, простые и сложные вещества), - основные сведения о строении атомов элементов малых периодов,
- основные виды химической связи,
- типы кристаллических решеток,
- факторы, определяющие скорость химических реакций и состояние химического равновесия,
- типологию химических реакций по различным признакам,
- сущность электролитической реакции,
- названия, состав, классификацию и состав важнейших классов неорганических соединений в свете электролитической диссоциации и с позиций окисления – восстановления.
уметь:
- применять следующие понятия: химический элемент, атомы, изотопы, ионы, молекулы; простое и сложное вещество; аллотропия; относительная атомная и молекулярная массы, количества вещества, молярная масса, молярный объем, число Авогадро; электроотрицательность, степень окисления, окислительно-восстановительный процесс; химическая связь, ее виды и разновидности; химическая реакция и ее классификации; скорость химической реакции и факторы ее зависимости; обратимость химической реакции, химическое равновесие и условия его смещения; электролитическая диссоциация, гидратация молекул и ионов; ионы, их классификация и свойства; электрохимический ряд напряжений металлов;
- разъяснять смысл химических формул и уравнений; объяснять действие изученных закономерностей (сохранения массы веществ при химических реакциях); определять степени окисления атомов химических элементов по формулам их соединений; составлять уравнения реакций, определять их вид и характеризовать окислительно – восстановительные реакции, определять по составу (химическим формулам) принадлежность веществ к различным классам соединений и характеризовать их химические свойства, в том числе и в свете теории электролитической диссоциации; устанавливать генетическую связь между классами неорганических соединений и зависимость между ставом вещества и его свойствами;
- обращаться с лабораторным оборудованием; соблюдать правила техники безопасности; проводить простые химические опыты; наблюдать за химическими процессами и оформлять результаты наблюдений;
- производить расчеты по химическим формулам и уравнениям с использованием изученных понятий.
Для реализации рабочей программы по химии в 8 классе используется учебник О.С. Габриеляна «Химия», 8 класс. М.: «Дрофа», 2010.
Содержание программы
Введение (6 часов) Химия — наука о веществах, их свойствах и превращениях.
Понятие о химическом элементе и формах его существования: свободных атомах, простых и сложных веществах.
Превращения веществ. Отличие химических peaкций от физических явлений. Роль химии в жизни человека. Хемофилия и хемофобия.
Краткие сведения по истории возникновения развития химии. Период алхимии. Понятие о философском камне. Химия в XVI в. Развитие химии на Руси. Роль отечественных ученых в становлении химической науки — работы М. В. Ломоносова, А. М. Бутлерова, Д. И. Менделеева.
Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительные атомная и молекулярная массы.
Периодическая система химических элементов Д.И. Менделеева, ее структура: малые и большие периоды, группы и подгруппы. Периодическая система как справочное пособие для получения сведений о химических элементах.
В результате изучения темы учащийся должен
знать/понимать: основные понятия химии: химия, химический элемент, химический знак, химическая формула, химическая реакция, признаки химических реакций; основные этапы развития химии как науки; вклад в развитие химии российских ученых М. В Ломоносова, Д.И. Менделеева, М. А. Бутлерова.
уметь:
- называть структуру периодической таблицы химических элементов Д.И. Менделеева,
- определять по химическим знакам химические элементы, их русские названия.
- характеризовать химические явления
- объяснять черты химических реакций
- проводить самостоятельный расчет молекулярной массы вещества.
1. Атомы химических элементов (13 часов)
Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Ре-зерфорда. Планетарная модель строения атома. Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса». Изменение числа протонов в ядре атома – образование новых химических элементов. Изменение числа протонов в ядре атома — образование изотопов. Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента. Электроны. Строение электронных уровней атомов химических элементов малых периодов. Понятие о завершенном электронном уровне. Периодическая система химических элементов Д.И. Менделеева и строение атомов: физический смысл порядкового номера элемента, номера группы, номера периода. Изменение числа электронов на внешнем электронном уровне атома химического элемента — образование положительных и отрицательных ионов. Ионы, образованные атомами металлов и неметаллов. Причины изменения металлических и неметаллических свойств в периодах и группах. Образование бинарных соединений. Понятие об ионной связи. Схемы образования ионной связи. Взаимодействие атомов элементов-неметаллов между собой — образование двухатомных молекул простых веществ. Ковалентная неполярная химическая связь. Электронные и структурные формулы.
Взаимодействие атомов неметаллов между собой - образование бинарных соединений неметаллов. Электроотрицательность. Понятие о полярной ковалентной связи.
Взаимодействие атомов металлов между собой — образование металлических кристаллов. Понятие о металлической связи.
Демонстрации. Модели атомов химических элементов. Периодическая система химических элементов Д. И. Менделеева.
Контрольная работа №1 по теме «Атомы химических элементов»
В результате изучения темы учащийся должен
знать/понимать: основные сведения о строении атомов, состав атомных ядер, физический смысл таблицы химических элементов Д.И. Менделеева.
уметь:
- называть формулировки периодического закона (Д.И.Менделеева и современную)
- определять валентность, строение электронных оболочек.
- характеризовать химический элемент по его положению в таблице химических элементов Д.И. Менделеева
- объяснять свойства на основе положения элемента в таблице химических элементов Д.И. Менделеева
2. Простые вещества (10 часов)
Положение металлов и неметаллов в периодической системе. Важнейшие простые вещества-металлы: железо, алюминий, кальций, магний, натрий калий. Общие физические свойства металлов.
Важнейшие простые вещества-неметаллы, образованные атомами кислорода, водорода, азота, серы, фосфора, углерода. Молекулы простых веществ-неметаллов: водорода, кислорода, азота, галогенов. Относительная молекулярная масса.
Способность атомов химических элементов к образованию нескольких простых веществ — аллотропия. Аллотропные модификации кислорода, фосфора, олова. Металлические и неметаллические свойства простых веществ. Относительность этого понятия. Число Авогадро. Количество вещества. Моль. Mолярная масса. Молярный объем газообразных веществ. Кратные единицы измерения количества вещества — миллимоль и киломоль, миллимолярная и киломолярная массы вещества, миллимолярный и киломолярный объемы газообразных веществ.
Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «число Авогадро».
Демонстрации. Получение озона. Образцы белого и серого олова, белого и красного фосфора. Некоторые металлы и неметаллы количеством вещества 1 моль. Молярный объем газообразных веществ.
В результате изучения темы учащийся должен
знать/понимать: важнейшие простые вещества – металлы: железо, алюминий, кальций, магний, натрий, калий. Неметаллы.
уметь:
- называть формулы для вычисления количества вещества
- определять способность атомов к образованию аллотропии.
- характеризовать общие физические свойства металлов.
- объяснять решение задач с использованием понятий «количество вещества», «молярная масса», «молярный объем», «постоянная Авогадро».
3.Соединения химических элементов (16часов)
Степень окисления. Определение степени окисления элементов в бинарных соединениях. Составление формул бинарных соединений, общий способ их названий.
Бинарные соединения металлов и неметаллов: оксиды, хлориды, сульфиды и пр. Составление их формул.
Бинарные соединения неметаллов: оксиды, летучие водородные соединения, их состав и названия. Представители оксидов: вода, углекислый газ, негашеная известь. Представители летучих водородных соединений: хлороводород и аммиак.
Основания, их состав и названия. Растворимость оснований в воде. Представители щелочей: гидроксиды натрия, калия и кальция. Понятие об индикаторах и качественных реакциях.
Кислоты, их состав и названия. Классификация кислот. Представители кислот: серная, соляная, азотная. Изменение окраски индикаторов.
Соли как производные кислот и оснований. Их состав и названия. Растворимость солей в воде. Представители солей: хлорид натрия, карбонат и фосфат кальция.
Аморфные и кристаллические вещества.

Межмолекулярные взаимодействия. Типы кристаллических решеток. Зависимость свойств веществ от типов кристаллических решеток.
Чистые вещества и смеси. Примеры жидких, твердых и газообразных смесей. Свойства чистых веществ и смесей. Их состав. Массовая и объемная доли компонента смеси. Расчеты, связанные с использованием понятия «доля».
Демонстрации. Образцы оксидов, кислот, оснований и солей. Модели кристаллических решеток хлорида натрия, алмаза, оксида углерода (IV). Модели атомов. Взрыв смеси водорода с воздухом. Разделение смесей. Дистилляция воды.
Лабораторные опыты. 1. Знакомство с образцами веществ разных классов. 2. Разделение смесей.
Контрольная работа №2 по теме «Соединения химических элементов»
В результате изучения темы учащийся должен
знать/понимать: степень окисления. Бинарные соединения. Основные классы неорганических соединений, их строение, состав, химические свойства и способы получения. Аморфные и кристаллические вещества.
уметь:
- называть класс неорганических соединений, тип кристаллической решетки.
- определять к какому классу неорганических соединений относится данное вещество, молекулярное и немолекулярное строение, среду реакции.
- характеризовать свойства классов неорганических соединений.
- объяснять действие закона постоянства вещества.
- проводить самостоятельный поиск признаков физических свойств веществ.
4. Изменения, происходящие с веществами (13 часов)
Понятие явлений как изменений, происходящих с веществом.
Явления, связанные с изменением кристаллического строения вещества при постоянном его составе, — физические явления. Физические явления химии: дистилляция, кристаллизация, выпаривание и возгонка веществ.
Явления, связанные с изменением состава вещества, — химические реакции. Признаки и условия протекания химических реакций. Выделение теплоты и света — реакции горения. Понятие об экзо- и эндотермических реакциях.
Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление уравнений химических реакций.
Типы химических реакций: разложения, соединения, замещения и обмена.
Расчеты по химическим уравнениям. Решение задач на нахождение количества, массы или объёма продукта реакции по количеству, массе или объему исходного вещества. Расчеты с использованием понятия «доля», когда исходное вещество дано в виде раствора с заданной массовой долей растворенного вещества или содержит определенную долю примесей.
Демонстрации. Примеры физических явлений: 1) плавление парафина; б) возгонка йода или бензойной кислоты; в) растворение перманганата калия; I) диффузия душистых веществ с горящей лампочки накаливания. Примеры химических явлений: а) горение магния, фосфора; б) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди (II); г) растворение полученного гидросида в кислотах; д) взаимодействие оксида меди (II) с серной кислотой при нагревании; е) разложение перманганата калия; ж) взаимодействие разбавленных кислот с металлами; з) разложение пероксида водорода; и)электролиз воды.
Лабораторные опыты. 3. Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. 4. Окисление меди в пламени спиртовки или горелки. 5. Помутнение известковой воды от выдыхаемого углекислого газа. 6. Получение углекислого газа взаимодействием соды и кислоты. 7. Замещение меди в растворе хлорида меди (I) железом.
Контрольная работа №3 по теме «Изменения, происходящие с веществами»
В результате изучения темы учащийся должен
знать/понимать: признаки химических реакций, закон сохранения массы вещества.
уметь:
- называть вещество и его свойства.
- определять типы химических реакций.
5. Простейшие операции с веществом. Химический практикум (5 часов)
1. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами. Оборудование Инструкция по технике безопасности, штатив,
пробирка, фарфоровая чашка, спиртовка (илиэлектронагреватель), лучина, спички, химический стакан, пробиркодержатель.
2. Наблюдения за изменениями, происходящими с горящей свечой, и их описание. 3. Анализ почвы и воды. 4. Признаки химических реакций. 5. Приготовление раствора сахара и определение массовой доли его в растворе. Оборудование Сахар, химический стакан, весы, стеклянная палочка, пробирки, стеклянная воронка
В результате изучения темы учащийся должен
- проводить самостоятельный поиск явлений сопровождающих химические реакции.
6. Растворение. Растворы. Свойства растворов электролитов (26 часов)
Растворение как физико-химический процесс. Понятие о гидратах и кристаллогидратах. Растворимость. Кривые растворимости как модель зависимости растворимости твердых веществ от температуры. Насыщенные, ненасыщенные и пересыщенные растворы. Значение растворов для природы и сельского хозяйства.
Понятие об электролитической диссоциации. Электролиты и неэлектролиты. Механизм диссоциаций электролитов с различным характером связи. Степень электролитической диссоциации. Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Реакции обмена, идущие до конца.
Классификация ионов и их свойства.
Кислоты, их классификация. Диссоциация кислот их свойства в свете теории электролитической диссоциации. Молекулярные и ионные уравнения реакций. Взаимодействие кислот с металлами. Электрохимический ряд напряжений металлов. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями — реакция нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости для характеристики химических свойств кислот.
Основания, их классификация. Диссоциация оснований и их свойства в свете теории электролитической диссоциации. Взаимодействие оснований с солями. Использование таблицы растворимости для характеристики химических свойств оснований. Взаимодействие щелочей с оксидами неметаллов.
Соли, их диссоциация и свойства в свете теории электролитической диссоциации. Взаимодействие солей с металлами, особенности этих реакций. Взаимодействие солей с солями. Использование таблицы растворимости для характеристики химических свойств солей.
Обобщение сведений об оксидах, их классификации и свойствах.
![]()
Генетические ряды металла и неметалла. Генетическая связь между классами неорганических веществ.
Окислительно-восстановительные реакции.

Определение степеней окисления для элементов, образующих вещества разных классов. Реакции ионного обмена и окислительно-восстановительные реакции. Окислитель и восстановитель, окисление и восстановление.
Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Свойства простых веществ — металлов и неметаллов, кислот и солей в свете окислительно-восстановительных реакций.
Демонстрации. Испытание веществ и их растворов на электропроводность. Зависимость электропроводности уксусной кислоты от концентрации. Движение окрашенных ионов в электрическом поле. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II). Горение магния. Взаимодействие хлорной и сероводородной воды.
![]()
Лабораторные опыты. 8. Реакции, характерные для растворов кислот (соляной или серной). 9. Peакции, характерные для растворов щелочей (гидроксидов натрия или калия). 10. Получение и свойства нерастворимого основания, например гидроксида меди (II). 11. Peaкции, характерные для растворов солей (например, для хлорида меди (II). 12. Реакции, характерные для основных оксидов (для оксида кальция) 13. Реакции, характерные для кислотных оксидов (для углекислого газа).
Контрольная работа №4 по теме «Растворение. Растворы. Свойства растворов электролитов»
В результате изучения темы учащийся должен
знать/понимать: основные положения теории электролитической диссоциации; признаки реакций ионного обмена; механизм диссоциации веществ с ионной и ковалентной связями; виды концентраций и формулы для их расчета.
уметь:
- определять реакции ионного обмена, их признаки.
- характеризовать свойства растворов электролитов; генетическую связь основных классов неорганических соединений.
- объяснять свойства основных классов неорганических соединений в свете теории электролитической диссоциации.
7. Свойства растворов электролитов. Химический практикум ( 4 часа)
6.Ионные реакции. 7.Условия протекания химических реакций между растворами электролитов до конца.8. Свойства кислот, оснований, оксидов и солей. 9.Решение экспериментальных задач.
В результате изучения темы учащийся должен
- проводить самостоятельный химический эксперимент по изучению свойств веществ.
8. Портретная галерея великих химиков ( 6 часов)
Повторение материала 8 класса – основных понятий, законов и теорий через знакомство с жизнью и деятельностью учёных, осуществивших их открытие.
В результате изучения темы учащийся должен
знать/понимать: основные понятия и законы, теории химии и ученых их открывших.
уметь:
- называть авторов различных законов химии, даты их жизни и основные события жизнедеятельности.
9. Повторение изученного материала (6 часов)
Учебно-тематический план
| № п/п | Название раздела / темы | Кол-во часов | В том числе: |
| Практичес. работы | Контрол. работы |
|
| Введение.
| 6 |
|
|
| 1 | Атомы химических элементов
| 13 |
| 1 |
| 2 | Простые вещества.
| 10 |
|
|
| 3 | Соединение химических элементов | 16 |
| 1 |
| 4 | Изменения, происходящие с веществами | 13 |
| 1 |
| 5 | Простейшие операции с веществом. Химический практикум. | 5 | 5 |
|
| 6 | Растворение. Растворы. Свойства электролитов. | 26 |
| 1 |
| 7 | Свойства электролитов. Химический практикум | 4 | 4 |
|
| 8 | Шеренга великих химиков
| 6 |
|
|
| 9 | Повторение изученного материала | 6 |
|
|
|
|
Всего: |
105 |
9 |
4 |
Требования к уровню подготовки
В результате изучения данного предмета в 8 классе учащийся должен знать:
основные формы существования химического элемента (свободные атомы, простые и сложные вещества),
Основные сведения о строении атомов элементов малых периодов,
Основные виды химической связи,
Типы кристаллических решеток,
Факторы, определяющие скорость химических реакций и состояние химического равновесия,
Типологию химических реакций по различным признакам,
Сущность электролитической реакции,
Названия, состав, классификацию и состав важнейших классов неорганических соединений в свете электролитической диссоциации и с позиций окисления – восстановления.
Учащиеся должны уметь:
Применять следующие понятия: химический элемент, атомы, изотопы, ионы, молекулы; простое и сложное вещество; аллотропия; относительная атомная и молекулярная массы, количества вещества, молярная масса, молярный объем, число Авогадро; электроотрицательность, степень окисления, окислительно-восстановительный процесс; химическая связь, ее виды и разновидности; химическая реакция и ее классификации; скорость химической реакции и факторы ее зависимости; обратимость химической реакции, химическое равновесие и условия его смещения; электролитическая диссоциация, гидратация молекул и ионов; ионы, их классификация и свойства; электрохимический ряд напряжений металлов;
Разъяснять смысл химических формул и уравнений; объяснять действие изученных закономерностей (сохранения массы веществ при химических реакциях); определять степени окисления атомов химических элементов по формулам их соединений; составлять уравнения реакций, определять их вид и характеризовать окислительно – восстановительные реакции, определять по составу (химическим формулам) принадлежность веществ к различным классам соединений и характеризовать их химические свойства, в Ом числе и в сете электролитической диссоциации; устанавливать генетическую связь между классами неорганических соединений и зависимость между ставом вещества и его свойствами;
Обращаться с лабораторным оборудованием; соблюдать правила техники безопасности; проводить простые химические опыты; наблюдать за химическими процессами и оформлять результаты наблюдений;
Производить расчеты по химическим формулам и уравнениям с использованием изученных понятий.
Литература и средства обучения
1.Бочарова С.И. Внеклассная работа по химии. 8-9 класс.- Волгоград: ИТД «Корифей»
2.Волынова Л.Г. Химия. Предметная неделя в школе: планы и конспекты мероприятий. – Волгоград: Учитель,2005.
3.Габриелян О.С. Химия. 8 класс: Учебник для общеобразовательных учреждений.- М.: Дрофа, 2010.
4. Габриелян О.С. Химия. 8 класс: контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия.8.- М.: Дрофа, 2006.
5.Галичкина О.В. Занимательная химия на уроках в 8-11 классах: тематические кроссворды. – Волгоград: Учитель, 2005.
6.Горбунцова С.В. Тесты по основным разделам школьного курса химии: 8-9 классы.- М.: «ВАКО», 2006.
7.Мильчев В.А., Ковалёва З.С. Типовые расчётные задачи для учащихся 8 классов на базе учебного стандарта. – М.: АРКТИ, 2002.
8.Тяглова Е.В. Исследовательская деятельность учащихся по химии: метод. Пособие. – М.: Глобус, 2007.
Электронные пособия:
СD диски «Общая и неорганическая химия»,«Органическая химия»,
«Виртуальная лаборатория»
Интернет-ресурсы:
http://www.chem-astu.ru/chair/study/genchem/index.html
http://bril2002.narod.ru/chemistry.html
http://www.chemel.ru/
http://www.prosv.ru/ebooks/Gara_Uroki-himii_8kl/index.html
http://chem-inf.narod.ru/inorg/element.html
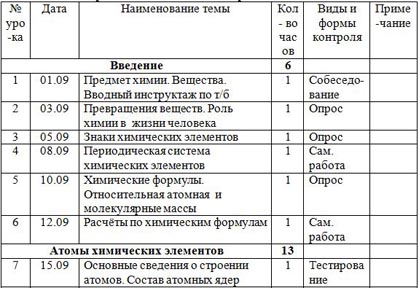
Календарно-тематическое планирование по химии 8 класс
| № уро-ка | Дата | Наименование темы | Кол- во часов | Виды и формы контроля | Приме-чание |
| Введение | 6 |
|
|
| 1 | 01.09 | Предмет химии. Вещества. Вводный инструктаж по т/б | 1 | Собеседо-вание |
|
| 2 | 03.09 | Превращения веществ. Роль химии в жизни человека | 1 | Опрос |
|
| 3 | 05.09 | Знаки химических элементов | 1 | Опрос |
|
| 4 | 08.09 | Периодическая система химических элементов | 1 | Сам. работа |
|
| 5 | 10.09 | Химические формулы. Относительная атомная и молекулярные массы | 1 | Опрос |
|
| 6 | 12.09 | Расчёты по химическим формулам | 1 | Сам. работа |
|
| Атомы химических элементов | 13 |
|
|
| 7 | 15.09 | Основные сведения о строении атомов. Состав атомных ядер | 1 | Тестирование |
|
| 8 | 17.09 | Изменение в составе ядер атомов. Изотопы | 1 | Опрос |
|
| 9 | 19.09 | Электроны. Строение электронных оболочек атомов | 1 | Опрос |
|
| 10 | 22.09 | Строение электронных оболочек атомов | 1 | Опрос |
|
| 11 | 24.09 | Периодическая система химических элементов Д.И. Менделеева | 1 | Сам. работа |
|
| 12 | 26.09 | Ионная связь | 1 | Опрос |
|
| 13 | 29.09 | Ковалентная неполярная связь | 1 | Опрос |
|
| 14 | 01.10 | Ковалентная полярная связь | 1 | Тестирование |
|
| 15 | 03.10 | Ковалентная полярная связь. Составление схем | 1 | Сам. работа |
|
| 16 | 06.10 | Металлическая связь | 1 | Сам. работа |
|
| 17 | 08.10 | Решение упражнений по теме «Химическая связь» | 1 | Тестирование |
|
| 18 | 10.10 | Обобщение и систематизация знаний по теме «Атомы химических элементов» | 1 | Сам. работа |
|
| 19 | 13.10 | Контрольная работа №1 по теме «Атомы химических элементов» | 1 | Письменная контр.раб |
|
| Простые вещества | 10 |
|
|
| 20 | 15.10 | Анализ контрольной работы. Простые вещества - металлы. Общие физические свойства | 1 |
|
|
| 21 | 17.10 | Простые вещества - неметаллы. Физические свойства веществ неметаллов | 1 | Опрос |
|
| 22 | 20.10 | Аллотропия | 1 | Опрос |
|
| 23 | 22.10 | Количество вещества | 1 | Тестирование |
|
| 24 | 24.10 | Молярная масса вещества | 1 | Опрос |
|
| 25 | 27.10 | Молярный объем газообразных веществ | 1 | Опрос |
|
| 26 | 05.11 | Решение задач по теме «Количество вещества» | 1 | Опрос |
|
| 27 | 07.11 | Решение задач по теме «Молярный объем газов» | 1 | Сам. работа |
|
| 28 | 10.11 | Обобщение и систематизация знаний по теме «Простые вещества» | 1 | Сам. работа |
|
| 29 | 12.11 | Тестирование по теме «Простые вещества» | 1 | Тестирование |
|
| Соединения химических элементов | 16 |
|
|
| 30 | 14.11 | Степень окисления | 1 |
|
|
| 31 | 17.11 | Бинарные соединения металлов и неметаллов | 1 | Опрос |
|
| 32 | 19.11 | Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения | 1 | Опрос |
|
| 33 | 21.11 | Основания | 1 | Опрос |
|
| 34 | 24.11 | Кислоты | 1 | Опрос |
|
| 35 | 26.11 | Классификация кислот | 1 | Опрос |
|
| 36 | 28.11 | Соли как производные кислот и оснований | 1 | Сам. работа |
|
| 37 | 01.12 | Растворимые и нерастворимые соли | 1 | Опрос |
|
| 38 | 03.12 | Урок –упражнение по теме «Соединения химических элементов» | 1 | Сам. работа |
|
| 39 | 05.12 | Кристаллические решетки | 1 | Тестирование |
|
| 40 | 08.12 | Чистые вещества и смеси | 1 | Опрос |
|
| 41 | 10.12 | Массовая доля компонентов раствора | 1 | Опрос |
|
| 42 | 12.12 | Объемная доля компонентов смеси | 1 | Опрос |
|
| 43 | 15.12 | Решение расчётных задач на нахождение объёмной и массовой долей смеси | 1 | Сам. работа |
|
| 44 | 17.12 | Обобщение и систематизация знаний по теме «Соединения химических элементов» | 1 | Сам. работа |
|
| 45 | 19.12 | Контрольная работа №2 по теме «Соединения химических элементов» | 1 | Письменная контр. работа |
|
| Изменения, происходящие с веществами | 13 |
|
|
| 46 | 22.12 | Анализ контрольной работы. Физические явления | 1 |
|
|
| 47 | 24.12 | Химические реакции | 1 | Опрос |
|
| 48 | 26.12 | Химические уравнения. Закон сохранения массы веществ | 1 | Опрос |
|
| 49 | 29.12 | Составление уравнений химических реакций | 1 | Опрос |
|
| 50 |
| Реакции разложения | 1 | Сам. работа |
|
| 51 |
| Реакции соединения | 1 | Опрос |
|
| 52 |
| Реакции замещения | 1 | Опрос |
|
| 53 |
| Реакции обмена | 1 | Опрос |
|
| 54 |
| Типы химических реакций на примере свойств воды | 1 | Тестирование |
|
| 55 |
| Расчеты по химическим уравнениям | 1 | Сам. работа |
|
| 56 |
| Решение задач по химическим уравнениям |
| Опрос |
|
| 57 |
| Обобщение и систематизация знаний по теме «Изменения, происходящие с веществами» | 1 | Опрос |
|
| 58 |
| Контрольная работа №3 по теме «Изменения, происходящие с веществами» | 1 | Письменная контр. работа |
|
| Простейшие операции с веществом. Химический практикум | 5 |
|
|
| 59 |
| Практическая работа №1 «Приемы обращения с лабораторным оборудованием. Правила безопасной работы в химической лаборатории». Первичный инструктаж по т/б | 1 | Наблюдение |
|
| 60 |
| Практическая работа №2 «Очистка загрязненной поваренной соли» | 1 | Наблюдение |
|
| 61 |
| Практическая работа №3 «Анализ почвы и воды» | 1 | Наблюдение |
|
| 62 |
| Практическая работа №4 «Признаки химических реакций» | 1 | Наблюдение |
|
| 63 |
| Практическая работа №5 «Приготовление раствора сахара и расчёт его массовой доли в растворе» | 1 | Наблюдение |
|
| Растворение. Растворы. Свойства растворов электролитов | 26 |
|
|
| 64 |
| Растворение как физико-химический процесс | 1 |
|
|
| 65 |
| Растворимость. Типы растворов | 1 | Опрос |
|
| 66 |
| Электролитическая диссоциация | 1 | Опрос |
|
| 67 |
| Степень диссоциации | 1 | Опрос |
|
| 68 |
| Основные положения ТЭД | 1 | Опрос |
|
| 69 |
| Ионные уравнения реакций | 1 | Тестирование |
|
| 70 |
| Реакции ионного обмена | 1 | Опрос |
|
| 71 |
| Кислоты в свете ТЭД, их классификация | 1 | Сам. работа |
|
| 72 |
| Кислоты в свете ТЭД, их свойства | 1 | Опрос |
|
| 73 |
| Основания в свете ТЭД, их классификация | 1 | Сам. работа |
|
| 74 |
| Основания в свете ТЭД, их свойства | 1 | Опрос |
|
| 75 |
| Оксиды в свете ТЭД, их классификация | 1 | Сам. работа |
|
| 76 |
| Оксиды в свете ТЭД, их свойства | 1 | Опрос |
|
| 77 |
| Соли в свете ТЭД, их классификация | 1 | Сам. работа |
|
| 78 |
| Соли в свете ТЭД, их свойства | 1 | Опрос |
|
| 79 |
| Генетический ряд металлов | 1 | Сам. работа |
|
| 80 |
| Генетический ряд неметаллов | 1 | Опрос |
|
| 81 |
| Обобщение знаний по теме «Основные классы неорганических соединений с позиции ТЭД » | 1 | Опрос |
|
| 82 |
| Тестирование по теме «Основные классы неорганических соединений с позиции ТЭД | 1 | Тестирование |
|
| 83 |
| Классификация химических реакций | 1 |
|
|
| 84 |
| Окислительно - восстановительные реакции | 1 | Опрос |
|
| 85 |
| Упражнения в составлении окислительно – восстановительных реакций | 1 | Опрос |
|
| 86 |
| Метод электронного баланса | 1 | Сам. Работа
|
|
| 87 |
| Свойства изученных классов веществ в свете ОВР | 1 | Опрос |
|
| 88 |
| Обобщение и систематизация знаний по теме «Свойства растворов электролитов» | 1 | Опрос |
|
| 89 |
| Контрольная работа №4 по теме «Свойства растворов электролитов» | 1 | Письменная контр. работа |
|
| Свойства электролитов. Химический практикум | 4 |
|
|
| 90 |
| Практическая работа № 6 «Ионные реакции» | 1 | Наблюдение |
|
| 91 |
| Практическая работа № 7 «Условия протекания химических реакций между растворами электролитов до конца» | 1 | Наблюдение |
|
| 92 |
| Практическая работа № 8 «Свойства кислот, оснований, оксидов и солей» | 1 | Наблюдение |
|
| 93 |
| Практическая работа № 9 «Решение экспериментальных задач» | 1 | Наблюдение |
|
| Повторение изученного материала | 6 |
|
|
| 94 |
| Химия как наука в трудах Парацельса и Роберта Бойля | 1 | Опрос |
|
| 95 |
| Атомно-молекулярное учение его создатели М.В. Ломоносов и Д. Дальтон | 1 | Опрос |
|
| 96 |
| Д.И. Менделеев и учение о строении атома | 1 | Опрос |
|
| 97 |
| Решение задач с постоянной Авогадро | 1 | Опрос |
|
| 98 |
| Химическая кинетика и учение о равновесии. К. Бертолле и А. Шателье | 1 | Опрос |
|
| 99 |
| С. Аррениус – основоположник теории электролитической диссоциации | 1 | Сам. работа |
|
| Повторение изученного материала | 3 |
|
|
| 100 |
| Основные сведения о составе и строении атома химического элемента | 1 |
|
|
| 101 |
| Виды химической связи в неорганических веществах | 1 |
|
|
| 102 |
| Основные классы неорганических соединений | 1 |
|
|
| 103-105 |
| Резерв | 3 |
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход













 Рабочая программа по химии для 8 класса (0.65 MB)
Рабочая программа по химии для 8 класса (0.65 MB)
 0
0 1610
1610 59
59 Нравится
0
Нравится
0








