Гилина Людмила Васильевна
Астраханская область, Ахтубинский район, п. Верхний Баскунчак
МБОУ «СОШ № 11 МО Ахтубинский район»
Преподаватель биологии и химии
Электронный адрес: [email protected]
Аннотация
В связи с Концепцией модернизации российского образования на современном этапе предусматривается профильное обучение старшеклассников. Программа элективного курса по химии создана для старшеклассников и знакомит с основными типами расчетных задач. Элективный курс также создает условия для формирования научного мировоззрения школьников и развития логического мышления. Знания помогут учащимся при подготовке к экзаменам по химии, помогут реализовать способности школьников при итоговой аттестации. Данный курс предназначен преподавателям предметов естественного цикла для углубления знаний по курсу основной школы. При написании программы были использованы сборники решения задач и Интернет - сайты
ПРОГРАММА ЭЛЕКТИВНОГО КУРСА
« ОСНОВНЫЕ ТИПЫ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ»
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Основной задачей модернизации российского образования является обеспечение нового качества школьного образования, соответствующего требованиям современной жизни. В соответствии с концепцией нового подхода к школьному образованию элективные курсы являются обязательным компонентом школьного обучения. Элективный курс «Основные типы расчетных задач по химии» предназначен для расширения возможностей учащихся при выборе профессий химического профиля. Программа элективного курса составлена для учеников девятого класса и рассчитана на 17 часов. В процессе изучения данного элективного курса учащиеся познакомятся с различными способами решения химических задач, их классификацией по содержанию, по применению формул. Элективный курс предусматривает не только овладение различными умениями, навыкам для решения задач, но и создает условия для формирования логического мышления ученика. Задачи по химии часто носят исследовательский характер и имеют практическое значение. Практика итоговых экзаменов в школе и приемных экзаменов в высшие учебные заведения показывает, то задачи представляют для учащихся наибольшую сложность, поэтому умение их решать способствует успешной сдаче единого государственного экзамена по химии. Старшеклассники, усвоившие данный материал, смогут реализовать полученные знания и умения на итоговой аттестации. Умение решать задачи является одним из критериев оценки глубины знаний учащихся по предмету и умений применять полученные знания на практике. Изучение элективного курса предполагает решение задач по химии, содержание которых соответствует рассматриваемым темам. Кроме того программный материал может быть источником дополнительной информации для школьников, стремящихся к получению разносторонних знаний по учебным предметам. Каждый учащийся при получении среднего образования должен иметь возможность углубить свои знания, расширить кругозор, поднять свой образовательный уровень вне зависимости от специализации, которую он выбирает. В процессе изучения курса предусматривается творческая работа учащихся с литературой, информацией на электронных носителях и в сети Интернет, формирование умений конспектирования, реферирования, публичного выступления. Самостоятельная деятельность школьников способствует развитию исследовательских и прогностических умений, подготовке к вузовской системе обучения.
ЦЕЛЬ КУРСА: формирование научного мировоззрения через систему химических знаний.
ЗАДАЧИ КУРСА:
- систематизация и углубление знаний по химии
- развитие логического и творческого мышления
- формирование практических умений работать с периодической системой химических элементов Д.И Менделеева.
- формирование практических умений решать задачи по химии и использовать их в повседневной жизни
- ознакомление с различными способами решения расчетных задач
-использование химических закономерностей при выполнении алгоритмов решения задач
- совершенствование навыков самостоятельной работы с дополнительными источниками информации.
ОСНОВНЫЕ ТРЕБОВАНИЯ К ЗНАНИЯМ И УМЕНИЯМ
В результате изучения элективного курса учащиеся должны приобрести новые знания и умения.
Учащиеся должны знать:
- о роли химии в познании окружающей среды
- о химических методах исследования
- основные термины, понятия, формулы
- основные алгоритмы решения химических задач, различные способы
- систему единиц СИ.
Учащиеся должны уметь:
- владеть терминологией и знать основные понятия
- анализировать результаты, делать выводы
- участвовать в дискуссии
- выбирать рациональное решение
- составлять схемы и таблицы
- находить информацию в различных источниках.
СОДЕРЖАНИЕ КУРСА
Общее количество часов – 17 ч
УЧЕБНО – ТЕМАТИЧЕСКИЙ ПЛАН
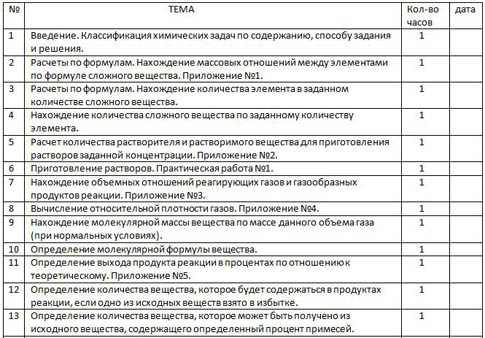
| № | ТЕМА | Кол-во часов | дата |
| 1 | Введение. Классификация химических задач по содержанию, способу задания и решения. | 1 |
|
| 2 | Расчеты по формулам. Нахождение массовых отношений между элементами по формуле сложного вещества. Приложение №1. | 1 |
|
| 3 | Расчеты по формулам. Нахождение количества элемента в заданном количестве сложного вещества. | 1 |
|
| 4 | Нахождение количества сложного вещества по заданному количеству элемента. | 1 |
|
| 5 | Расчет количества растворителя и растворимого вещества для приготовления растворов заданной концентрации. Приложение №2. | 1 |
|
| 6 | Приготовление растворов. Практическая работа №1. | 1 |
|
| 7 | Нахождение объемных отношений реагирующих газов и газообразных продуктов реакции. Приложение №3. | 1 |
|
| 8 | Вычисление относительной плотности газов. Приложение №4. | 1 |
|
| 9 | Нахождение молекулярной массы вещества по массе данного объема газа (при нормальных условиях). | 1 |
|
| 10 | Определение молекулярной формулы вещества. | 1 |
|
| 11 | Определение выхода продукта реакции в процентах по отношению к теоретическому. Приложение №5. | 1 |
|
| 12 | Определение количества вещества, которое будет содержаться в продуктах реакции, если одно из исходных веществ взято в избытке. | 1 |
|
| 13 | Определение количества вещества, которое может быть получено из исходного вещества, содержащего определенный процент примесей. | 1 |
|
| 14 | Вычисление количества газообразных продуктов реакции в объемных единицах измерения. | 1 |
|
| 15 | Расчеты по термохимическим уравнениям реакций. Приложение.№6. | 1 |
|
| 16 | Тестовые задания по химии. | 1 |
|
| 17 | Презентация страницы по выбранной теме. | 1 |
|
ПРИЛОЖЕНИЕ 1
Расчеты по химическим формулам.
Задача. Массовая доля серы в соединении с кислородом равна 40%. Выведите формулу этого вещества.
Дано: Решение
 (S)=40% 1)
(S)=40% 1)  (O)=100 - 40=60%
(O)=100 - 40=60%
____________ 2) Находим отношение атомов по формуле:
SхOy - ? S : O=40/32 : 60/16=1,25:3,75
Меньшее число принимаем за единицу и находим отношение атомов
S : O=1:3
Ответ: формула данного вещества SO3.
Задача. Вычислите содержание элементов в массовых долях и процентах в гидроксиде натрия.
Дано: Решение.
NaOH 1) Находим молярную массу гидроксида натрия:
________ M (NaOH)=23+16+1=40г/моль
Х1(Na)-? 2) Вычисляем массовую долю натрия:
Х2(O)-? Х1=23/40=0,575, Na – 0,575 мас.д., или 57,5%
Х3(H)-? 3) Вычисляем массовую долю кислорода
Х2=16/40=0,4, О – 0, 4 мас.д., или 40%
4) Выисляем массовую долю водорода
Х3=1/40=0,025, H – 0,025 мас.д., или 2, 5%.
5) Проверяем правильность вычисления:
0,575+0,4+0,025=1,00 (в мас.д.)
57,5+40+2,5=100 (в %).
Ответ: в NaOH содержится 0,575 мас.д., или 57,5%, Na, 0,4 мас.д., или 40%, О и 0,025 мас.д., или 2,5%, H.
ПРИЛОЖЕНИЕ 2
Расчет количества растворителя и растворимого вещества.
Задача 1. Рассчитайте массу сульфата калия и воды, которые надо взять для приготовления 60 г раствора с массовой долей растворенного вещества 15%.
Дано: Решение.
m р-р(K2SO4)=60 г 1) Находим массу сульфата калия необходимую для приготовления
 =15%
=15%
______________ раствора: mв-ва (K2SO4) =  . mр-р /100 =15.60/100 = 9 г
. mр-р /100 =15.60/100 = 9 г
m (K2SO4)=? 2) Вычисляем массу воды:
m ( H2O)=? m (H2O)= mр-р—mв-ва=60 - 9=51г
Ответ: масса сульфата калия – 9 г, масса воды – 51 г.
Задача 2. К 150 г раствора с массовой долей H2SO4 10% добавили 100г воды. Вычислите массовую долю серной кислоты в полученном растворе.
Дано: Решение.
mр-р1=150 г 1) Находим массу раствора, полученного после добавления воды
 1 = 10%
1 = 10%
m(H2O) =100 mр-р2 = mр-р1 + m(H2O) =150+100 = 250 г
____________ 2) Находим массу серной кислоты в растворе:
 2-? m(H2SO4) =
2-? m(H2SO4) =  . mр-р1/100
. mр-р1/100
m(H2SO4) = 10 . 250/100 = 25г
3) Находим массовую долю серной кислоты в полученном растворе:
 2 = mв-ва/mр-р2.100%
2 = mв-ва/mр-р2.100%
 2 = 25.250/100 = 6,25%
2 = 25.250/100 = 6,25%
Ответ: массовая доля серной кислоты в полученном растворе 6, 25%.
ПРИЛОЖЕНИЕ 3
Нахождение объемных отношений реагирующих газов.
Задача 1. Какие объемы водорода и кислорода должны прореагировать, чтобы получилось 0,4 моль воды.
Дано: Решение.
n(H2O) = 0,4моль y моль х моль 0,4 моль
_______________ 2H2 + O2 = 2H2O
V(O2)-? 2 моль 1 моль 2моль
V(H2)-? 1) Обозначим через х количество вещества O2, через y– количество
вещества H2.
2) Вычисляем х. Х = 0,4 . 1/2 = 0,2 моль
3) Вычисляем y. Y = 0,4 .2/2 = 0,4 моль
4) Используя молярный объем газов (Vm = 22,4 л/моль), вычисляем
объемы газов: V(O2) = 22,4 . 0,2 = 4,48 л, V(H2) = 22,4 . 0,4 = 8,96 л
Ответ: V(O2) = 4,48 л, V(H2) = 8,96 л.
Задача 2.Объемные доли ацетилена и этана в газовой смеси составляют 25% и 75% соответственно. Вычислите массовые доли газов в смеси.
Решение. В газовых смесях объемные доли компонентов совпадают с мольными (следствие закона Авогадро). Следовательно, мольные доли газов в смеси также 25% и 75%. Пусть имеется 100 моль смеси данных газов. В такой смеси содержится 25 моль ацетилена и 75 моль этана. Вычислим массы ацетилена и этана:
m(C2H2) = n(C2H2) . M (C2H2) = 25моль.26 г/моль = 650 г,
m( C2H6) = n(C2H6) . M (C2H6) = 75моль .30 г/ моль = 2250 г.
Вычислим общую массу 100 моль смеси и массовые доли компонентов в ней:
mсмеси = m(C2H2) + m(C2H6) = 650 г + 2250 г = 2900 г
 (C2H2) = 650/2900 = 0, 224 или 22,4%;
(C2H2) = 650/2900 = 0, 224 или 22,4%;
 (C2H6) = 2250/2900 = 0,776 или 77,6%.
(C2H6) = 2250/2900 = 0,776 или 77,6%.
Ответ:  (C2H2) = 0,224 или 22,4%;
(C2H2) = 0,224 или 22,4%;  (C2H6) = 0,776 или 77,6%.
(C2H6) = 0,776 или 77,6%.
ПРИЛОЖЕНИЕ 4
Вычисление относительной плотности газов.
Задача. Какова плотность углекислого газа по водороду, по воздуху?
Дано: Решение
CO2 Определяем плотность газа по формулам:
_________ Мr = 2DH2, где Мr – молекулярная масса, DH2- плотность газа по водороду.
Dвозд -? Мr = 29Dвозд, Dвозд – плотность газа по воздуху.
DH2 - ? 1. Находим молекулярную массу оксида углерода.
Мr (СО2) = 12 + (16 . 2) = 44.
2. Находим плотность оксида углерода по водороду:
DH2 = Мr/2; DH2 = 44/2 = 22.
3. Находим плотность оксида углерода по воздуху.
Dвозд = Мr/29; Dвозд.= 44/29 = 1,5 Ответ: DH2 =22, Dвозд. =1,5.
ПРИЛОЖЕНИЕ 5
Определение выхода продукта реакции в % по отношению к теоретически возможному.
Задача. Из 280 г жженой извести получили 364 г гашеной извести. Сколько процентов это составляет от теоретически возможного.
Дано: Решение.
m(CaO) = 280 г 5 моль х моль
m(Ca(OH)2) = 364 г CaO + H2O = Ca(OH)2)
________________ 1 моль 1 моль
 вых(Ca(OH)2) - ? 1) М(CaO) = 56г/моль
вых(Ca(OH)2) - ? 1) М(CaO) = 56г/моль
2) n (CaO) = m/M; n = 280/56 = 5моль ; n(CaO) = n(CaOH)2) = 5 моль
3) М (Ca(OH)2) = 74 г/моль, 4) m(Ca(OH)2) = 74 г/моль . 5 моль = 370 г
5)  вых = mпракт./ mтеор. . 100% = 364/370 . 100% = 98, 38%
вых = mпракт./ mтеор. . 100% = 364/370 . 100% = 98, 38%
Ответ:  вых (Ca(OH)2) = 98, 38%.
вых (Ca(OH)2) = 98, 38%.
ПРИЛОЖЕНИЕ 6
Расчеты по термохимическим уравнениям.
В соответствии с термохимическим уравнением
C6H12O6 + 6 O2 = 6 CO2 + 6H2O + 280кДж
Количество теплоты 210 кДж выделяется при сгорании глюкозы массой
90 г 2) 135 г 3) 270 г 4) 360 г
Выполняем расчеты по данному термохимическому уравнению.
По уравнению в реакции участвует 1 моль глюкозы. Молярная масса глюкозы 180 г/моль.
М (C6H12O6) = 12 . 6 + 1 . 12 + 16 .6 = 180г/ моль.
Масса глюкозы количеством вещества 1 моль равна 180 г. При сгорании 180 г глюкозы выделяется 280 кДж теплоты, а при сгорании х г глюкозы – 210 кДж :
Х = 180 . 210/ 280 = 135 г.
Ответ: масса глюкозы 135 г.
Вычисление массы продукта реакции по массе исходного вещества, содержащую определенную массовую долю примесей.
Задача. Какую массу негашеной извести можно получить из известняка массой 400 г, содержащую 10 % примесей.
Дано: Решение.
mизв = 400 г CaCO3 = CaO + CO2
 прим. = 10% 1моль 1 моль
прим. = 10% 1моль 1 моль
___________ По условию задачи 400 г известняка содержат карбонат кальция и m (CaO) -? примеси. На долю карбоната кальция приходится 90 % (100- 10 =90).
Масса карбоната кальция в известняке равна: m ( CaCO3) = 400 . 90/100 = 360 г.
Определим количество вещества, соответствующее массе карбоната кальция:
n (CaCO3) = m(CaCO3) / M (CaCO3) = 360 г/ 100 г/ моль = 3,6 моль
По уравнению реакции n (CaCO3) = n (CaO) = 3,6 моль.
Рассчитаем массу 4 моль оксида кальция:
m(CaO) = n(CaO) . M(CaO) = 3,6 моль . 56 г/моль = 201,6 г.
Ответ: m(CaO) = 201,6 г.
СПИСОК ИСТОЧНИКОВ
Гольдфарб Я.Л., Ходаков Ю.В. Сборник задач и упражнений по химии. М.:
Просвещение, 1980.
Горский М.В. Обучение основам общей химии. М.: Просвещение, 1997.
Плетнев. Ю.В., Полосин В.С. Практикум по методике обучения химии. М.: Просвещение, 1980.
Сорокин В.В., Злотников Э.Г. Тесты по химии. М.: Просвещение, 1997.
Суровцева Р.П и др. Химия 10 -11 классы. М.: Дрофа, 2001.
Тесты. Химия. Центр тестирования. М.: 2004.
Химия. Справочник школьника. М.: Слово, 1995.
Хомченко И.Г. Сборник задач и упражнений по химии для средней школы. М.: Новая волна, 2002.
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. М.: Новая волна, 1997.
Интернет сайты:
Interneturok.ru
Infourok.ru
Opencollection.ru
Pedsovet.su
Testboх.ru

 Получите свидетельство
Получите свидетельство Вход
Вход


 (S)=40% 1)
(S)=40% 1) 








 Программа элективного курса по химии (9 класс) (44.18 КB)
Программа элективного курса по химии (9 класс) (44.18 КB)
 2
2 3354
3354 952
952 Нравится
0
Нравится
0









