
Презентация к уроку
Суханова Н.Л., учитель химии и биологии
МБОУ «Куединская СОШ №1 им. П.П. Балахнина»

Отгадайте о чём идёт речь
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!

Тема урока «Водо род »
Цель - …..

Водород в природе.
Первый я на белом свете:
Во вселенной, на планете
Превращаюсь в лёгкий гелий,
Зажигаю Солнце в небе.
Гость из космоса пришёл
В воде приют себе нашёл!
(Объясните смысл этого стихотворения)

Элемент космоса

Элемент космоса
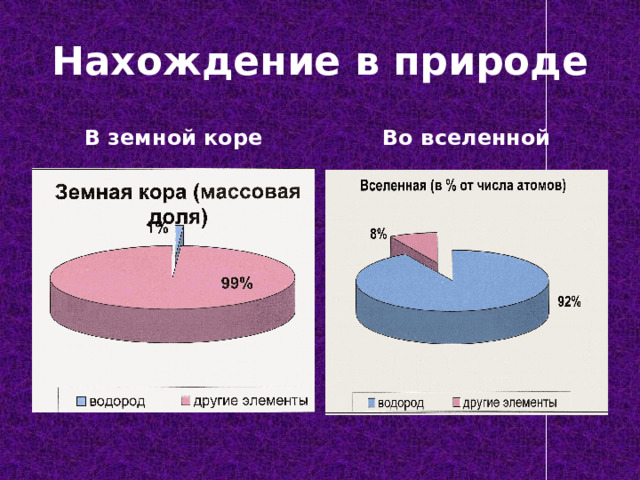
Нахождение в природе
В земной коре
Во вселенной

Исторические сведения
- Водород был известен ещё в XVI веке Теофрасту Парацельсу (1493-1541)
- Его получали Ван-Гельмонт(1577-1644),
Роберт Бойль (1627-1691),
Николя Лемери (1645-1715),
Михаил Васильевич Ломоносов (1711-1765),
Джозеф Пристли и др.

Всё те же открытия.
- В 1766 году известный английский учёный Генри Кавендиш получил «искусственный воздух» действием цинка на разведённую соляную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название «горючего воздуха»

Открытие водорода
Лишь в 1787 году Антуан Лавуазье доказал, что «горючий воздух»,открытый в 1766 году входит в состав воды. Осуществил
термическое разложение воды и установил, что она состоит из кислорода и водорода.

Открытие водорода
Л. Гитон де Морво
барон, французский химик .
В 1787г. дал современное название водороду. Он предложил латинское название гидрогениум , означающее «рождающий воду».

Визитка химического элемента
1. Период: 2. Группа: 3. Порядковый номер: 4. Атомная масса: 5. Металл или неметалл:

Критерии оценивания
Поставьте себе 0,2 балла за каждое правильное написание характеристики (максимум 1 балл)

Визитка химического элемента
Период: 1 Группа: 1 Порядковый номер: 1 Атомная масса: 1 Металл или неметалл :

Водород – простое вещество.
Н 2

Водород как простое вещество и как химический элемент
Параметры сравнения
Химический элемент
Химическая формула
Простое вещество
Н
Относительная атомная или молекулярная массы
A r(H) = 1
Н 2
Свойства
M r (H 2 ) =2
Входит в состав простых и сложных веществ .
Обладает набором физических и химических свойств.

Ответьте на вопрос.
Если бы перед вами стояла задача получить большое количество водорода, какое сырьё вы бы выбрали и почему ?

Получение водорода из воды с помощью солнечной энергии

Когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не золото, а энергия. И тогда изотопы водорода спасут человечество от надвигающегося энергетического голода: в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина . Академик, геохимик: Д.И. Шербаков

Работа с таблицей в тетради (параграф 15)

Физические свойства водорода
- Лёгкий горючий газ без цвета, запаха и вкуса.
- Температура плавления -259,15
- Температура кипения -252,7
- Плохо растворим в воде.

Получение водорода
В промышленности :
2H 2 O = 2H 2 ↑ + O 2 ↑
В лаборатории :
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑

Получение водорода в лаборатории
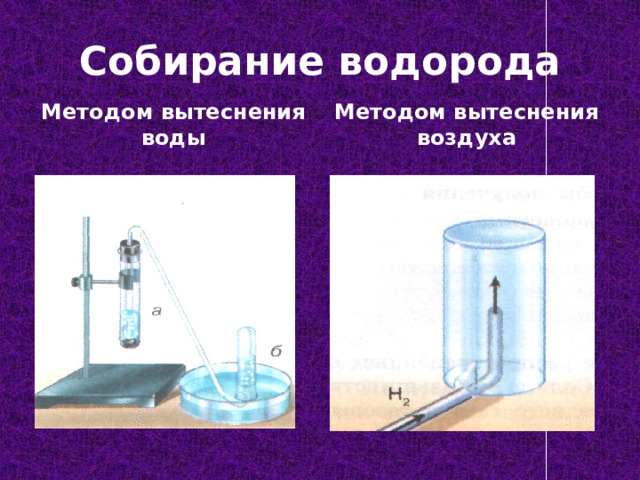
Собирание водорода
Методом вытеснения воды
Методом вытеснения воздуха

Образование гремучей смеси
Обычно лёгок и летуч,
Он вдруг становится могуч:
Его нагрев неосторожно
Взорвать в округе всё возможно.

Вот какая история произошла с французским химиком, директором парижского музея науки Пилатом де Розье. Как-то он решил проверить, что будет, если вдохнуть водород. До него никто такого эксперимента не проводил.
Не заметив никакого эффекта, учёный решил убедиться, проник ли водород в лёгкие? Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в лёгких экспериментатора смешался с воздухом и произошёл сильный взрыв. “ Я думал, что у меня вылетели все зубы вместе с корнями ”, – так Розье характеризовал испытанные ощущения. Эксперимент чуть не стоил ему жизни.

Химические свойства водорода
Расставьте сами коэффициенты.
- С галогенами
H 2 + Cl 2 = HCl ↑
2. С кислородом (в соотношении 2:1 гремучая смесь)
H 2 + O 2 = H 2 O
3. С серой
H 2 + S = H 2 S ↑

Химические свойства водорода
4. С азотом (при давлении и с катализатором)
H 2 + N 2 = NH 3
5. С активными металлами
H 2 + Na = NaH – гидрид натрия
6. Восстанавливает металлы из их оксидов
MoO 3 + H 2 = Mo + H 2 O

Критерии оценивания
Поставьте себе 1 балл за каждое правильно уравненное уравнение (максимум 5 баллов)

Химические свойства водорода
- С галогенами
H 2 + Cl 2 = 2 HCl ↑
2. С кислородом (в соотношении 2:1 гремучая смесь)
2 H 2 + O 2 = 2 H 2 O
3. С серой
H 2 + S = H 2 S ↑

Химические свойства водорода
4. С азотом (при давлении и с катализатором)
3 H 2 + N 2 = 2 NH 3
5. С активными металлами
H 2 + 2 Na = 2 NaH – гидрид натрия
6. Восстанавливает металлы из их оксидов
MoO 3 + 3 H 2 = Mo + 3 H 2 O

Некоторые области применения водорода

Применение водорода
Водородом заполняли дирижабли вплоть до 1937 года, пока не взорвался немецкий дирижабль «Гинденбург».
Погибло 36 человек.
Размеры дирижабля достигали размеров двух футбольных полей.

Водород в качестве горючего
При сгорании водорода в кислороде образуется экологически чистый продукт – вода.

Водород – аккумулятор энергии

Использование водорода в ракетных двигателях.
Жидкий водород
является
распространенным
компонентом
ракетного топлива .

Использование водорода в металлургической промышленности
Водород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)

Сварка металла
Смесь кислорода с водородом используют при сварке и резке металлов.

Проверь себя
Генри Кавендиш
(1731-1810) английский физик и химик
Получил …… 1 ……в 1766г.
И дал ему название «горючий воздух».

Антуан Лавуазье
( 1743-1794) французский химик, один из создателей современной химии
В 1783-1784 совместно с
Жаном Мёнье осуществили
термическое разложение воды и установили, что она состоит из ………… 2 …

Л. Гитон де Морво
( 1737—1816)
барон, французский химик . В 1787г. дал современное название водороду. Он предложил латинское название гидрогениум, означающее «…… 3 …».

Критерии оценивания
Поставьте себе 1 балл за каждое правильный ответ. (максимум 4 балла)

Генри Кавендиш
(1731-1810) английский физик и химик
Получил водород в 1766г. И дал ему название
1 - «горючий воздух».

Антуан Лавуазье
( 1743-1794) французский химик, один из создателей современной химии
В 1783-1784 совместно с
Жаном Мёнье осуществили
термическое разложение воды и установили, что она состоит
2 - из кислорода и водорода.

Л. Гитон де Морво
(1737—1816)
барон, французский химик . В 1787г. дал современное название водороду. Он предложил латинское название гидрогениум, означающее
3 - «рождающий воду» .

Сравнение
Кислород
Водород
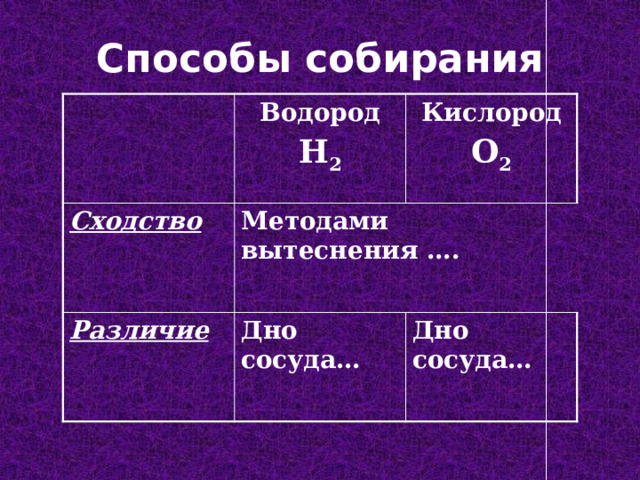
Способы собирания
Водород
Cходство
H 2
Кислород
Методами вытеснения ….
Различие
O 2
Дно сосуда…
Дно сосуда…
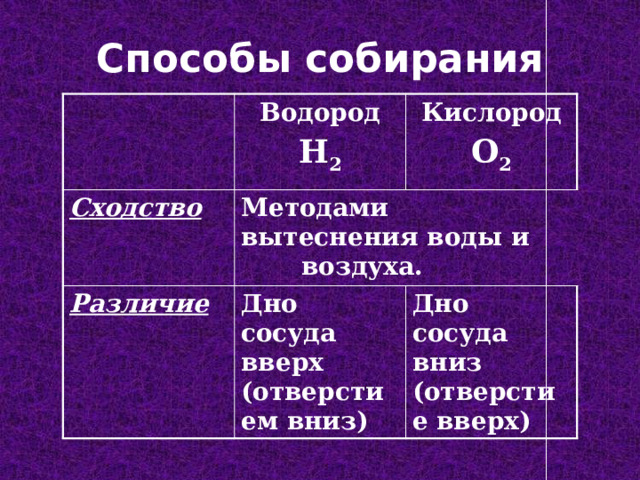
Способы собирания
Водород
Cходство
H 2
Кислород
Методами вытеснения воды и воздуха.
Различие
O 2
Дно сосуда вверх (отверстием вниз)
Дно сосуда вниз (отверстие вверх)

Физические свойства
Водород
Cходство
H 2
Кислород
Различие
O 2

Физические свойства
Водород
Cходство
H 2
Кислород
Газы, без цвета, запаха , вкуса, мало растворимы в воде.
Различие
O 2
Легче воздуха.
Тяжелее воздуха.
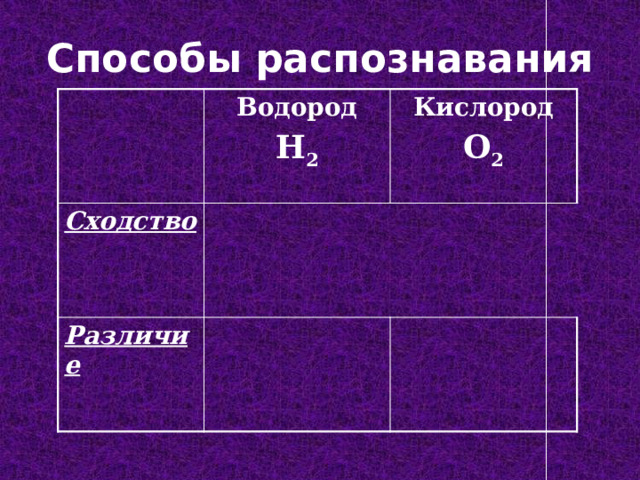
Способы распознавания
Водород
Cходство
H 2
Кислород
Различие
O 2
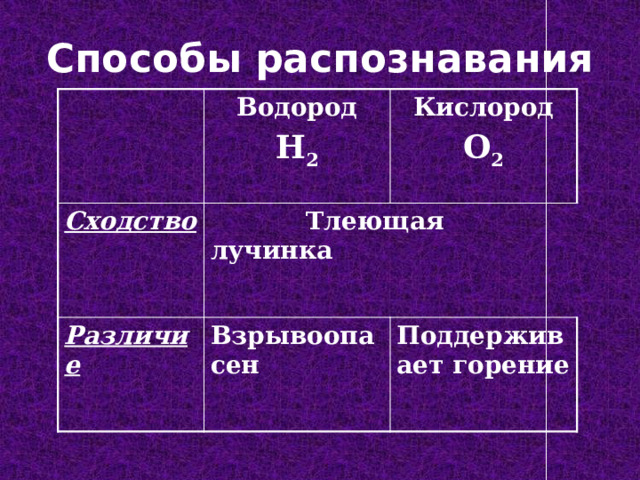
Способы распознавания
Водород
Cходство
H 2
Кислород
Тлеющая лучинка
Различие
O 2
Взрывоопасен
Поддерживает горение

Оцени свою активность
- ответил по просьбе учителя, но ответ неправильный « 0 »
- ответил по просьбе учителя, ответ правильный « 1 »
- ответил по своей инициативе, но ответ не правильный « 0 »
- ответил по своей инициативе, ответ правильный « 1 »
- не ответил « 0 »
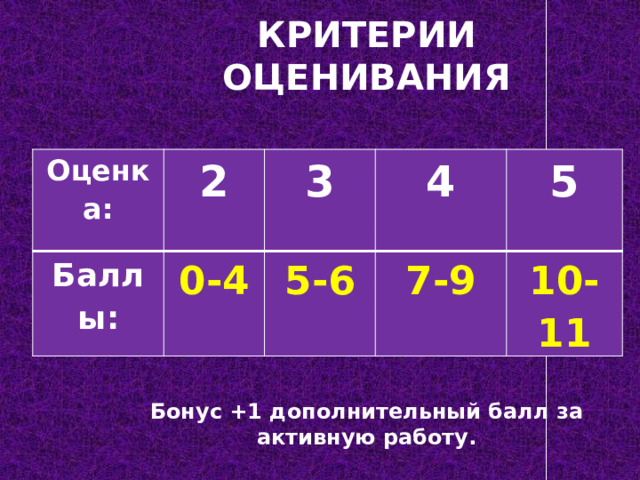
Критерии оценивания
Бонус +1 дополнительный балл за активную работу.
Оценка:
2
Баллы:
3
0-4
4
5-6
5
7-9
10-11

Рефлексия
- 1 – идея
- 2 – вопроса которые у меня остались, и я хотел(а) бы найти на них ответ.
- 3 – вещи которые я узнал на уроке.

Запишите домашнее задание.
Прочитать параграф 15.
Повторить записи в тетради.
По желанию:
Подготовить сообщения по темам:
«Водород во Вселенной»,
«Из истории развития воздухоплавания».

Лист с критериями для детей
Ф.И. _____________________ __________________________ Критерии оценивания: 1. Визитка - 2. Химические свойства – 3. Проверь себя – 4. Активность на уроке – Итог: Оценка:

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация к уроку по теме "Водород" (2.82 MB)
Презентация к уроку по теме "Водород" (2.82 MB)
 0
0 1077
1077 74
74 Нравится
0
Нравится
0






