
Танких Светлана Николаевна
МБУ СОШ №70 г.Тольятти
учитель химии

Соли – часто встречающиеся соединения, входящие в состав камней и минералов. Многие из них широко используются нами в повседневной жизни. Мы хорошо знаем обычные ( бытовые) названия таких солей: поваренная соль, сода, мел.
Соли – это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Хлорид меди(II) – кристаллическая соль зеленого цвета.
Cульфат магния – бесцветная кристаллическая соль.
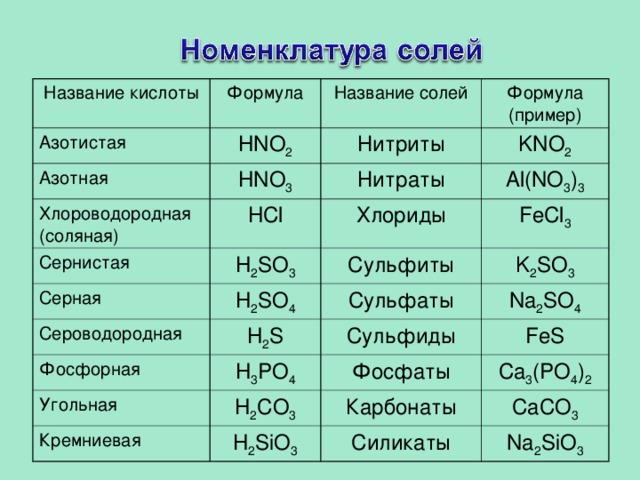
Название кислоты
Формула
Азотистая
Название солей
HNO 2
Азотная
Нитриты
HNO 3
Формула (пример)
Хлороводородная (соляная)
Ce рнистая
KNO 2
Нитраты
HCl
H 2 SO 3
Серная
Al(NO 3 ) 3
Хлориды
FeCl 3
Сульфиты
H 2 SO 4
Сероводородная
Сульфаты
K 2 SO 3
H 2 S
Фосфорная
Na 2 SO 4
Угольная
H 3 PO 4
Сульфиды
Фосфаты
FeS
H 2 CO 3
Кремниевая
Карбонаты
H 2 SiO 3
Ca 3 (PO 4 ) 2
CaCO 3
Силикаты
Na 2 SiO 3
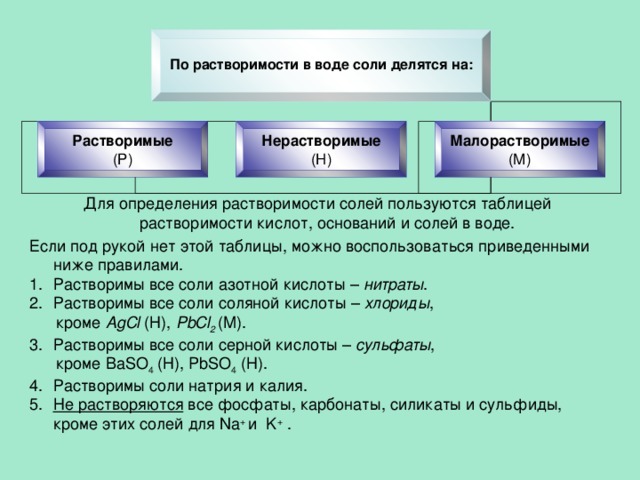
По растворимости в воде соли делятся на:
Растворимые
(Р)
Нерастворимые
(Н)
Малорастворимые
(М)
Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде.
Если под рукой нет этой таблицы, можно воспользоваться приведенными ниже правилами.
- Растворимы все соли азотной кислоты – нитраты .
- Растворимы все соли соляной кислоты – хлориды ,
кроме AgCl (Н), PbCl 2 (М).
- Растворимы все соли серной кислоты – сульфаты ,
кроме BaSO 4 (Н), PbSO 4 (Н).
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na + и K + .

Хлорид натрия NaCl
Хлорид натрия NaCl - хорошо растворимая в воде соль, известна под названием поваренная соль . Без этой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищи.
Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т.д.
Соль образует мощные отложения в земной коре. Огромные количества соли содержат в себе воды морей и океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать всю сушу земного шара слоем в 130 м.
Поваренная соль (хлорид натрия)

Концентрация соли в Мертвом море настолько высока, что человек может держаться на поверхности воды, практически совсем не погружаясь.
Высокая концентрация соли делает невозможным обитание многих живых организмов в воде этого моря, именно поэтому оно называется Мертвым морем.

Чрезмерное употребление соли вредно для здоровья. Запомните, что организму необходимо не более 0,5 г соли в день

Карбонат кальция CaCO 3
Карбонат кальция CaCO 3 , нерастворимый в воде, - важнейшая соль, из которой, многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела – разнообразные по форме, многоцветные по окраске раковины. Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород – известняков CaCO 3 .
Эту же формулу имеет мрамор, и столь привычный каждому школьнику, стоящему у доски - мел. Из известняка получают негашеную и гашеную известь, строят дома. Мрамор идет на изготовление статуй и др.
Из этой соли наземные животные «строят» свои скелеты – внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры.
Мел – один из видов известняков.

Карбонат кальция – компонент минералов, из которых сложены многие горные хребты.

Старинный замок, построенный из известняка.

Нитрат кобальта(II) – соль темно-красного цвета.
Гидроксид меди(II) имеет характерный голубой цвет.
Сульфат никеля(II) – соль, имеющая вид красивых зеленых кристаллов.
Нитрат калия – соль, известная под названием селитра.
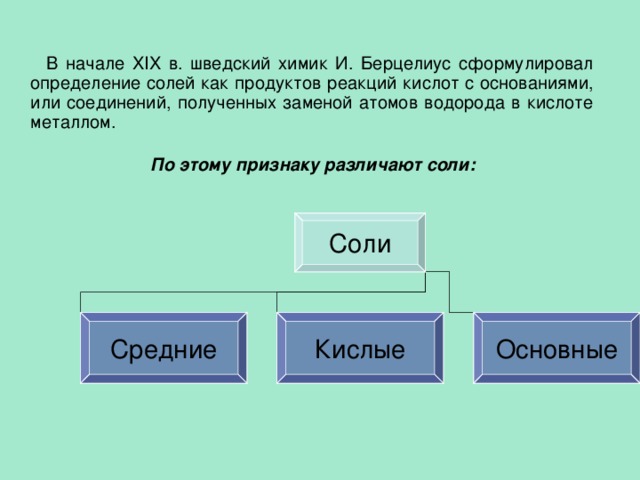
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом.
По этому признаку различают соли:
Соли
Средние
Кислые
Основные

Средние, или нормальные, соли – это продукты полного замещения атомов водорода в кислоте на металл.
Например:
Na 2 CO 3 – карбонат натрия
CuSO 4 – сульфат меди ( II ) и т.д.
Cульфат меди – кристаллы ярко-синего цвета, применяется в сельском хозяйстве (для борьбы с вредителями и для протравливания зерна) и при получении минеральных красок.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Na 2 CO 3 = 2 Na + + 2 CO 3 2-

Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
К ним относят, например, питьевую соду, используемую в домашнем хозяйстве - NaHCO 3 .
Для кислой кальциевой соли формула записывается так: Ca(HCO 3 ) 2 .
Названия этих солей складываются из названий солей с прибавлением слова гидро- , например
Mg(HSO4) 2 – гидросульфат магния .
Диссоциируют кислые соли следующим образом:
NaHCO 3 = Na + + HCO 3 - ,
Mg(HSO 4 ) 2 = Mg 2 + + 2HSO 4 -

Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит (CuOH) 2 CO 3 .
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например
(CuOH) 2 CO 3 – гидроксокарбонат меди ( II) .
AlOHCl 2 – гидроксохлорид алюминия.
Подавляющее большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
AlOHCl 2 = AlOH 2+ + 2 Cl -

Типичные реакции солей
1. Соль + кислота другая соль + другая кислота.
(реакция обмена)
2. Соль + щелочь другая соль + другое основание.
(реакция обмена)
3. Соль 1 + соль 2 соль 3 + соль 4
(реакция обмена: в реакцию вступают две соли,
в результате ее получаются две другие соли)
4. Соль + металл другая соль + другой металл
(реакция замещения)

Вывод
Применение солей чрезвычайно разнообразно: в красильном деле (соли хрома), как строительный материал, исходное сырьё для получения различных металлов (руды меди, цинка и свинца – халькоцит, сфалерит и галенит – представляют собой сульфиды этих металлов). Электролизом соответствующих солей получают галогены и ряд металлов. Широко используют соли и в качестве удобрений (селитры NaNO 3 и NH 4 NO 3 , различные фосфаты). Нитрит калия KNO 2 применяется для консервирования мяса, а натриевая соль салициловой кислоты как известное лекарство. Всякий живой организм, в том числе м организм человека, в котором соли составляют 5,5% массы тела, остро нуждается в постоянном поддержании солевого равновесия.

Проверь себя:
- Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной (всего 9 формул). Дайте их названия. Какие из солей растворимы в воде?
- Запишите формулы следующих солей: а) карбоната калия, сульфида свинца ( II ), нитрата железа ( III ); б) хлорида свинца ( IV) , фосфата магния, нитрата алюминия.
- Из перечня формул выпишите отдельно формулы нормальных, кислых и основных солей, дайте их названия и запишите уравнения их диссоциации: Ca(HSO 4 ) 2 , (CaOH) 2 SO 4 , Ca(NO 3 ) 2 , NaH 2 PO 4 , Na 3 PO 4 , MgOHNO 3 .


 Получите свидетельство
Получите свидетельство Вход
Вход





























 Презентация по химии "Соли" (2.34 MB)
Презентация по химии "Соли" (2.34 MB)
 0
0 5165
5165 262
262 Нравится
0
Нравится
0


