Цели урока:
сформировать у учащихся представление об окислительно-восстановительных реакциях
Дать понятие об электролитах. Изучить процесс электролитической диссоциации. Рассмотреть механизм диссоциации веществ с ионной связью.
формировать умение составлять уравнения химических реакций;
развивать память, мышление, внимание;
воспитывать интерес к химии и физике.
Тип урока: интегрированный урок с применением информационных технологий.
ТСО: интерактивная доска.
Оборудование и реактивы: источники питания, амперметр, электролитическая ванна, лампочка, раствор поваренной соли.
План урока
1. Орг.момент (3 мин.)
2. Актуализация (5 мин.)
3. Усвоение нового материала (химия) (13 мин.)
5. Усвоение нового материала (физика) (9 мин.)
6. Закрепление. Самостоятельная работа (7 мин.)
7. Подведение итогов. Проверка самостоятельной работы. Анализ работы. Выставление оценок (5 мин.)
8. Домашнее задание.
Ход урока:
Кто-то теряет, а кто-то находит…
I.Постановка целей урока и актуализация знаний
Учитель: Цель нашего урока - найти ответы на следующие вопросы.
1. Где в окружающем нас мире мы встречаемся с окислительно-восстановительными реакциями?
В чем отличие обменных реакций от окислительно-восстановительных?
Как правильно составить уравнения окислительно-восстановительных реакций?
Где окислительно-восстановительные реакции находят свое применение?
II. Формирование новых знаний и способов действия
Учитель химии: Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. С ними связаны процессы обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, в процессе коррозии металла, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и другие ценные продукты. Окислительно-восстановительные реакции лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в гальванических и топливных элементах. Именно с их помощью ракеты и самолеты поднимаются в космос.
Учитель предлагает просмотреть презентацию «Чудеса света». Учащиеся, демонстрируя свою работу, рассказывают о горении, коррозии металлов, взрыве, дыхании, гниении, брожении, фотосинтезе. Все эти процессы они называют «чудесами света». В результате ими делается вывод: эти семь чудес живой и неживой природы относятся к окислительно-восстановительным реакциям, окружающим нас и играющим огромную роль в нашей жизни.
После выступления учащихся учитель предлагает классу ответить на первый вопрос урока.
Учитель химии: Где в окружающем нас мире мы встречаемся с окислительно-восстановительными реакциями?
Учитель с классом выясняет, к каким типам относятся просмотренные реакции. Типы реакций заранее записаны на доске и закрыты, во время выяснения эти записи открываются: замещение, соединение, разложение.
Учитель химии: Почему в природе происходят окислительно-восстановительные реакции? Давайте прослушаем поэтические строки, а после объясним происхождение окислительно-восстановительных реакций.
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там - все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
Учитель физики
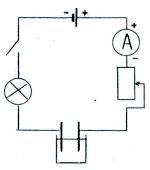
Обратимся к знаниям по физике. Вспомним, какие вещества мы называем проводниками и диэлектриками? Проведем эксперимент, сначала с чистой водой, затем добавим в воду раствор поваренной соли.
Демонстрация опыта с использованием прибора с лампочкой, показывающего электропроводность растворов.
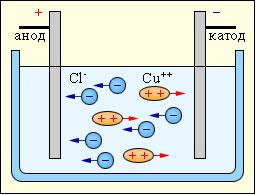
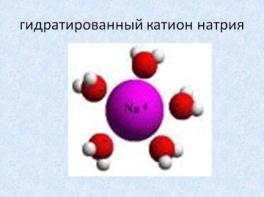
Какой можно сделать вывод на основе проделанных опытов? Почему водный раствор поваренной соли проводит электрический ток. Для объяснения этого явления, рассмотрим процесс электролитической диссоциации. ( Показ к/фрагмента «Электролитическая диссоциация») Кристалл поваренной соли имеет кубическую форму и состоит из молекул NaCl,связанных между собой ионной связью. Попадая в водный раствор, кристаллическая решетка поваренной соли разрушается из-за того, что молекулы воды со всех сторон обступают молекулы NaCl . Происходит распад молекул на ионы Na+ и ионы Сl-
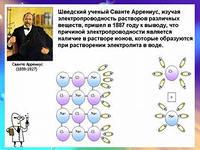
- Автор теории ЭД шведский ученый Сванте Аррениус. (Портрет)
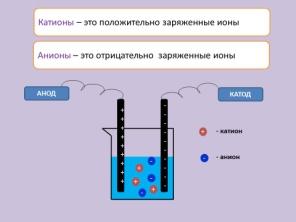
Физик – химик выяснил природу растворов электролитов и сделал логический вывод: чтобы лампочка загорелась, цепь должна замкнуться через раствор электролита. Это может произойти, если появится упорядоченное движение заряженных частиц. Что это за частицы в растворах солей и кислот?
Ионы – “+” и “-”.
- Диссоциация – распад электролита на ионы.
- Являясь приверженцем физической теории растворов, Аррениус не ответил на вопросы.
1. Почему именно в водном растворе происходит диссоциация веществ?
2. Откуда берутся ионы в растворах кислот?
- Доработали теорию русские химики И. А. Каблуков и В. А. Кистяковский (портреты ученых).
Суть дополнений:
Причиной диссоциации электролита в растворе является гидратация, т.е. взаимодействие с молекулами воды.
Как образуются ионы натрия и хлора? Рассмотрим электронную структуру натрия и хлора.
Атом Na 2)8)1) легко отдает атому Cl 2) 8) 7) электрон, превращаясь при этом в положительный ион (катион), а хлор легко принимает электрон, превращаясь при этом в отрицательный ион ( анион).
В электролитической ванне, под действием электрического поля, возникающего между анодом и катодом, ионы приходят в направленное движение, двигаясь к электродам (катион к катоду, анион к аноду), образуя электрический ток. На аноде хлор отдает электрон, превращаясь в нейтральный атом - эта реакция называется окислительной. На катоде натрий получает недостающий электрон, откладываясь на электроде в виде нейтрального атома – эта реакция называется восстановительной.
Учитель химии: Все, что нас окружает, состоит из мельчайших частиц – атомов. Опираясь на ваши знания о микромире, попробуем найти тайны происхождения окислительно-восстановительных реакций в «простейших атомах».
Глядя на таблицу Д,И, Менделеева и схемы строения атомов, изготовленные учащимися при изучении темы «Периодический закон и периодическая система Д.И. Менделеева», учащиеся отвечают на вопросы учителя.
Учитель: Почему все атомы стремятся завершить свой внешний энергетический слой? В какие частицы превращаются атомы после присоединения или отдачи электронов? Могут ли они соединяться между собой?
(Атомы с незавершенным энергетическим слоем очень активны, и поэтому принимают или отдают электроны. После этого они превращаются в положительные или отрицательные ионы. Разноименно заряженные частицы в природе соединяются).
Работа со схемами
Учитель показывает таблички со схемами строения атомов:
Аl +13 2е- 8 е- 3 е-
S+16 2 е- 8 е- 6 е-
Учитель химии: Какой элемент принимает, а какой - отдает электроны? Почему атомы могут соединяться и образовывать новые вещества?
Учащиеся фронтально отвечают на вопросы.
(Алюминию энергетически легче отдать свои 3 электрона, а сере выгоднее принять 2 электрона и т. д.).
Учащиеся приходят к выводу, что окислительно-восстановительные реакции происходят вследствие существования атомов, при этом окислительно-восстановительный процесс протекает по следующим закономерностям:
борьба и единство противоположностей;
разноименные частицы в природе соединяются;
сильный побеждает слабого;
кто-то теряет, а кто-то находит.
Учитель химии: Чем отличаются реакции ионного обмена от окислительно-восстановительных реакций? Приведите примеры реакций ионного обмена и окислительно-восстановительных. На примерах уравнений реакций ионного обмена выясняется, что в них степени окисления элементов не меняются.
Учащиеся записывают свои примеры уравнений реакций на доске, обращая внимание на изменение степеней окисления в них.
Выслушав сначала мнения учащихся, вместе формулируем определение, которое записывается в тетради:
«Химические реакции, которые протекают с изменением степеней окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными».
Учитель химии: Можно ли все реакции разделить на две группы? Какие?
(Все химические реакции можно разделить на 2 группы: 1) идущие с изменением степеней окисления (окислительно-восстановительные); 2) идущие без изменения степеней окисления).
Самостоятельная работа
Выполнить самостоятельную работу в парах по карточкам (схема изображена и на доске, и у каждого учащегося на карточке). Учащиеся должны быть готовы записать у доски переходы электронов после обсуждения в парах.
Учителя проверяют правильность заполнения карточек, помогают учащимся, у которых возникли затруднения. После этого учащиеся определяют в схемах частицы, принимающие электроны; частицы, отдающие электроны; записывают в тетрадях определения окислителя и восстановителя.
Учитель химии: А сейчас рассмотрим составление уравнений окислительно-восстановительных реакций методом электронного баланса. В основе метода электронного баланса лежит правило: общее число электронов, которые отдает восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход


 Разработали и провели:
Разработали и провели: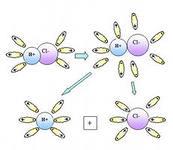









 "Окислительно-восстановительные реакции" (0.11 MB)
"Окислительно-восстановительные реакции" (0.11 MB)
 0
0 1395
1395 195
195 Нравится
0
Нравится
0








