
Оксиды, их классификация и свойства

Что такое оксиды?
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
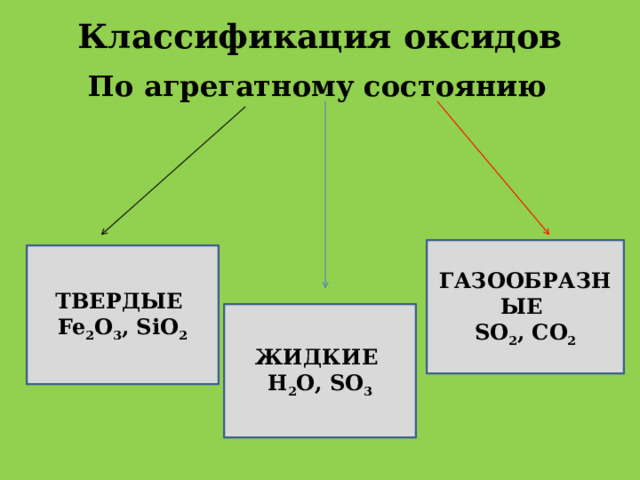
Классификация оксидов
По агрегатному состоянию
ГАЗООБРАЗНЫЕ
SO 2 , CO 2
ТВЕРДЫЕ
Fe 2 O 3 , SiO 2
ЖИДКИЕ
Н 2 О, SO 3

Пример твердого оксида
Песок – диоксид кремния SiO 2 с небольшим количеством примесей.

Пример жидкого оксида
Вода – оксид водорода Н 2 O.
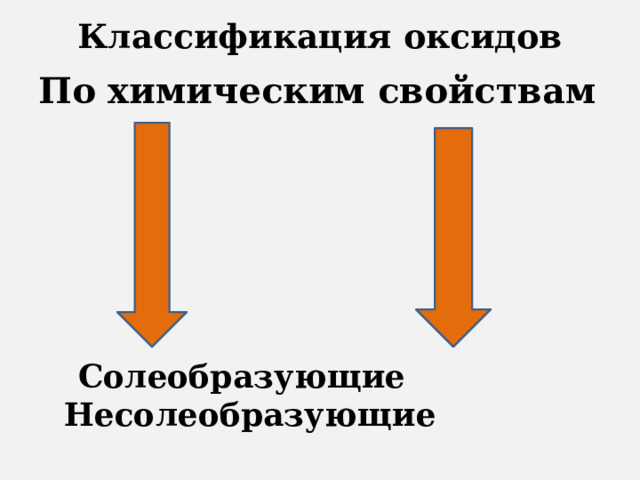
Классификация оксидов
По химическим свойствам
Солеобразующие Несолеобразующие

Классификация оксидов
Несолеобразующие оксиды – такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей.
Например:
oксиды азота (I), (II) и (IV) - N 2 O, NO, NO 2
oксид углерода (II) – СО
oксид кремния (II) - SiO
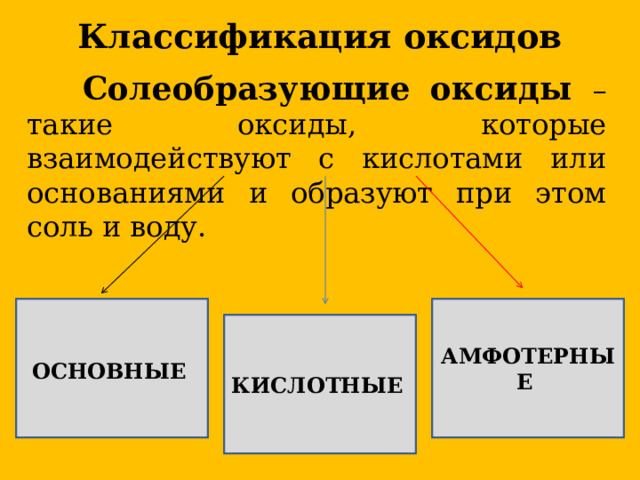
Классификация оксидов
Солеобразующие оксиды – такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
АМФОТЕРНЫЕ
ОСНОВНЫЕ
КИСЛОТНЫЕ

Основные оксиды
Основные оксиды – это такие оксиды, которым соответствуют основания.
Например:
MgO соответствует Mg(OH) 2
Na 2 O соответствует NaOH
BaO соответствует Ba(OH) 2

Кислотные оксиды
Кислотные оксиды – это такие оксиды, которым соответствуют кислоты.
Например:
S O 3 соответствует H 2 SO 4
CO 2 соответствует H 2 CO 3
P 2 O 5 соответствует H 3 PO 4

Типичные реакции основных оксидов
1) Основной оксид + кислота = соль + вода
2) Основной оксид + кислотный оксид = соль
3) Основной оксид + вода = щелочь

Типичные реакции основных оксидов
1) Основной оксид + кислота = соль + вода
Например: CuO + H 2 SO 4 = CuSO 4 + H 2 O

Типичные реакции основных оксидов
2) Основной оксид + кислотный оксид = соль
Например:
СaO + N 2 O 5 = Ca(NO 3 )
MgO + SiO 2 = MgSiO 3
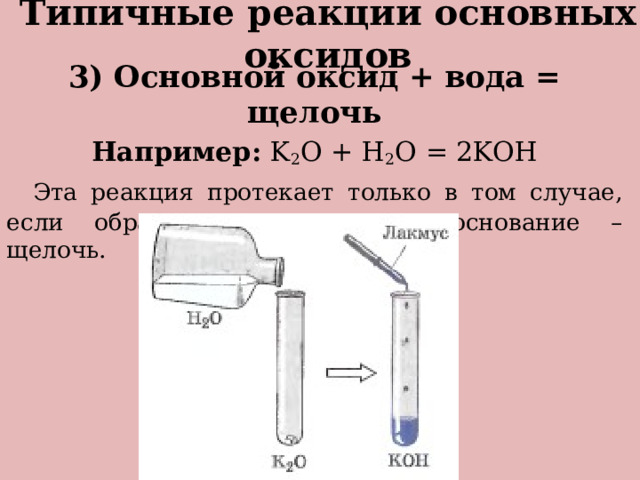
Типичные реакции основных оксидов
3) Основной оксид + вода = щелочь
Например: K 2 O + H 2 O = 2KOH
Эта реакция протекает только в том случае, если образуется растворимое основание – щелочь.

Типичные реакции кислотных оксидов
1) Кислотный оксид + основание = соль + вода
2) Кислотный оксид + основной оксид = соль
3) Кислотный оксид + вода = кислота
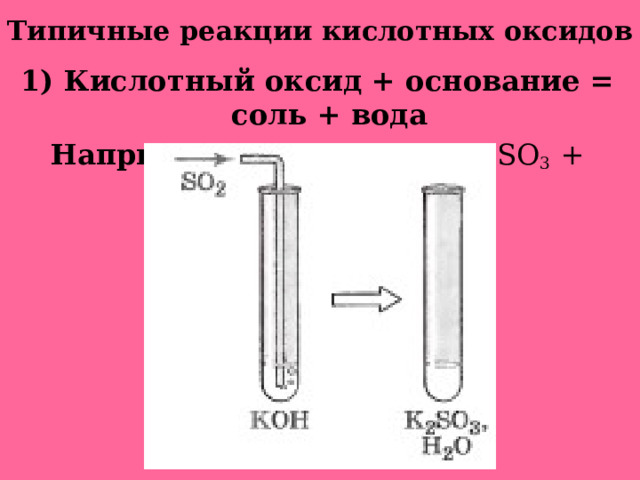
Типичные реакции кислотных оксидов
1) Кислотный оксид + основание = соль + вода
Например: SO 2 + 2KOH = K 2 SO 3 + H 2 O

Типичные реакции кислотных оксидов
1) Кислотный оксид + основной оксид = соль
Например:
SO 3 + K 2 O = K 2 SO 4
CO 2 + CaO = CaCO 3
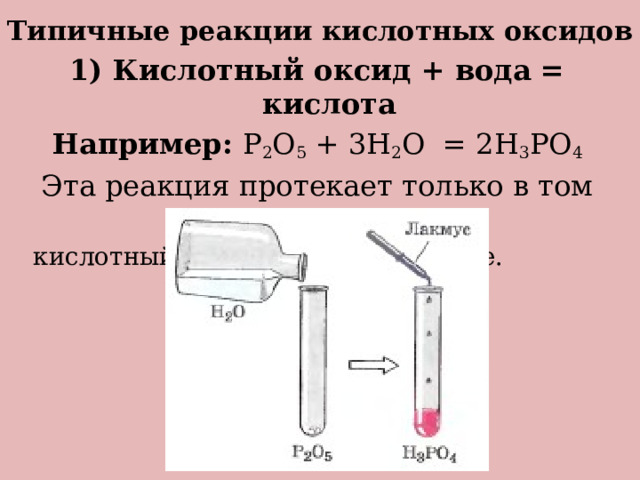
Типичные реакции кислотных оксидов
1) Кислотный оксид + вода = кислота
Например: P 2 O 5 + 3H 2 O = 2H 3 PO 4
Эта реакция протекает только в том случае, если
кислотный оксид растворим в воде.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Оксиды.Химические свойства.Получение. (390.42 KB)
Оксиды.Химические свойства.Получение. (390.42 KB)
 0
0 359
359 2
2 Нравится
0
Нравится
0


