
Урок по теме: «Кислоты»
Урок подготовила
учитель химии МБОУ ООШ
г. Кирсанова
Е. А. Гвоздева

Подумайте! Какой класс химических веществ мы будем изучать?

Кислый вкус лимону придает лимонная кислота , яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.
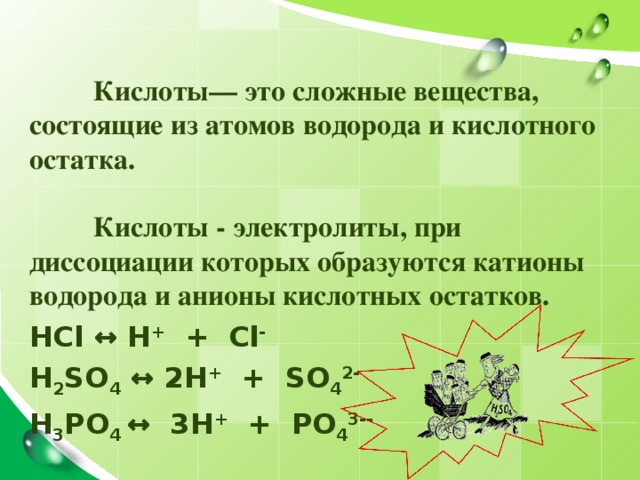
Кислоты— это сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты - электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков.
HCl ↔ H + + С l -
H 2 SO 4 ↔ 2H + + SO 4 2-
H 3 PO 4 ↔ 3H + + PO 4 3 - -
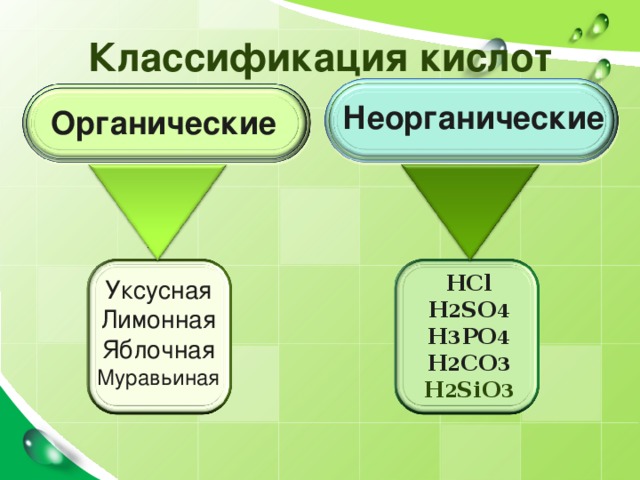
Классификация кислот
Неорганические
Органические
HCl
H 2 SO 4
H 3 PO 4
H 2 CO 3
H 2 SiO 3
Уксусная
Лимонная
Яблочная
Муравьиная
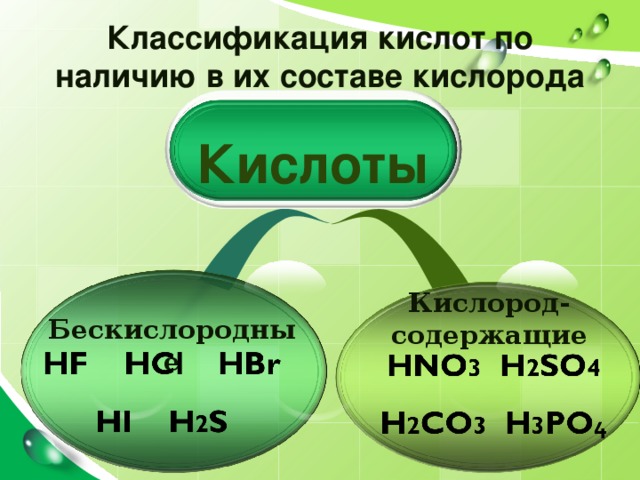
Классификация кислот по наличию в их составе кислорода
Кислоты
Кислород-
содержащие
Бескислородные
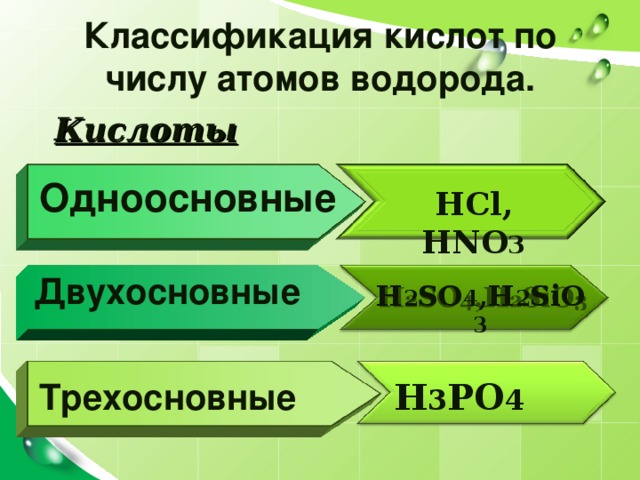
Классификация кислот по числу атомов водорода.
Кислоты
Одноосновные
HCl, HNO 3
Двухосновные
H 2 SO 4 ,H 2 SiO 3
Трехосновные
H 3 PO 4
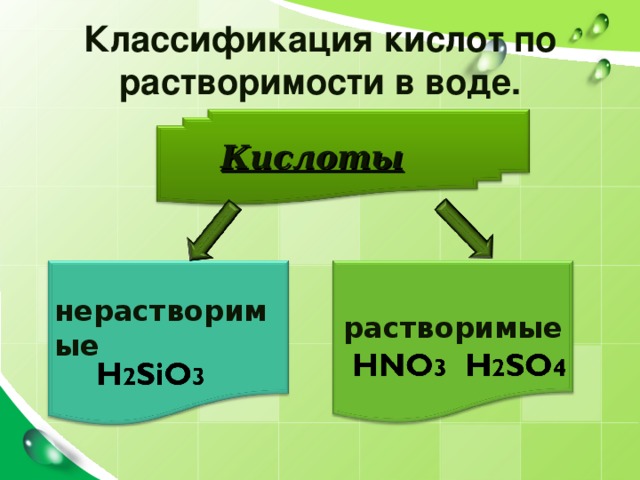
Классификация кислот по растворимости в воде.
Кислоты
нерастворимые
растворимые
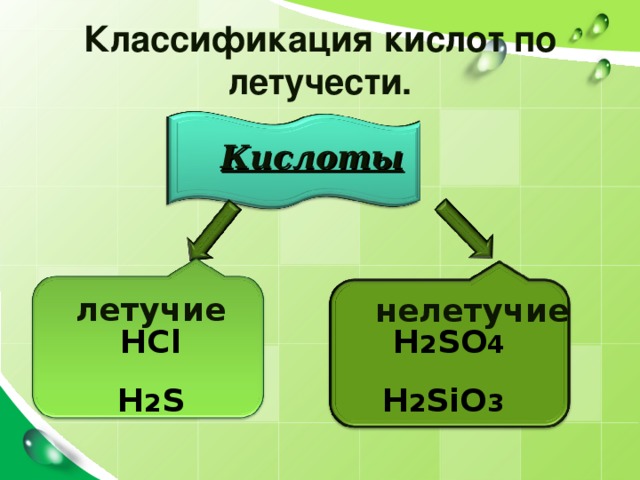
Классификация кислот по летучести.
Кислоты
летучие
нелетучие
HCl
H 2 S
H 2 SO 4
H 2 SiO 3
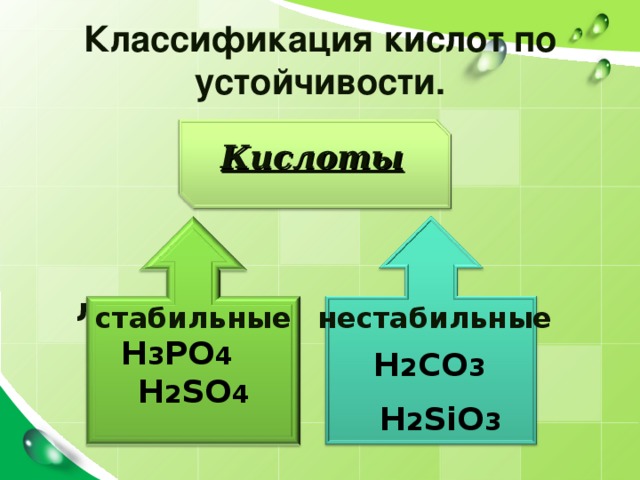
Классификация кислот по устойчивости.
Кислоты
летучие
стабильные
нестабильные
H 3 PO 4 H 2 SO 4
H 2 СO 3
H 2 SiO 3

Техника безопасности при работе с кислотами
При разбавлении концентрированной серной кислоты всегда соблюдайте следующее правило: нужно добавлять кислоту в воду, а не наоборот.

При смешивании концентрированной серной кислоты с водой выделяется большое количество теплоты, и температура смеси повышается.

Физические свойства кислот
По агрегатному
состоянию:
- Газообразные (HCl, H2S)
- Жидкие (HNO3, H2SO4)
- Твердые (H3PO4, H2SiO3)
Без цвета
Без запаха
Кислые на вкус
Разъедают многие вещества

Кремниевая кислота
H2SiO3 единственная нерастворимая кислота. Она соответствует кислотному оксиду - SiO2

ПРАВИЛА БЕЗОПАСНОСТИ
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.
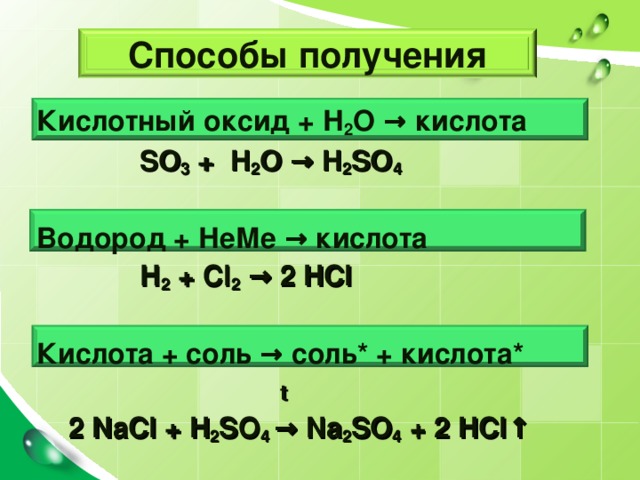
Способы получения
Кислотный оксид + Н 2 О → кислота
SO 3 + H 2 O → H 2 SO 4
Водород + НеМе → кислота
Н 2 + Cl 2 → 2 HCl
Кислота + соль → соль * + кислота *
t
2 NaCl + H 2 SO 4 → Na 2 SO 4 + 2 HCl ↑

Химические свойства
1 ). Изменяют окраску индикатора;
Взаимодействуют:
2). с металлами;
3). с основными и амфотерными оксидами;
4). с основаниями;
5). с солями.

Химические свойства
Взаимодействие с индикаторами
Индикатор
Нейтраль-ная среда
Лакмус
Кислая среда
Фиолетовый
Фенол-фталеин
Бесцветный
Красный
Метиловый
оранжевый
Бесцветный
Оранжевый
Красный
Помни! Нерастворимые кислоты не меняют окраску индикаторов.

Химические свойства
металл + кислота → соль + Н 2
Mg 0 + H 2 SO 4 = Mg SO 4 + H 2 0 ↑
Условия: металл должен стоять в ряду активности до водорода , а в результате реакции должна получиться растворимая соль , если образуется нерастворимая соль, то на поверхности металла образуется плёнка из этой соли, которая прекращает доступ кислоты к металлу. Нерастворимые кислоты (кремниевая) не всупают в реакцию с металлами.
- Особо взаимодействуют с металлами азотная и концентрированная серная кислоты, подробнее об этом вы узнаете в 9 классе
 CaCl 2 + H 2 O " width="640"
CaCl 2 + H 2 O " width="640"
Химические свойства
Кислота + основной оксид → соль + Н 2 О
Условия:
Все кислоты кроме нестабильных ( H 2 CO 3 , H 2 SiO 3 )
Образуется растворимая соль
2 HCl + CaO — CaCl 2 + H 2 O

Химические свойства
кислота + основание → соль + вода
H 2 SO 4 +2 NaOH = Na 2 SO 4 + 2H 2 O
Реакция между кислотой и основанием, в результате которой образуется соль и вода называется реакцией нейтрализации.
Реакция нейтрализации - частный случай реакции обмена.
 CaCl 2 + H 2 O + CO 2 ↑ 2) H 2 SO 4 + BaCl 2 — BaSO 4 ↓ + 2 HCl " width="640"
CaCl 2 + H 2 O + CO 2 ↑ 2) H 2 SO 4 + BaCl 2 — BaSO 4 ↓ + 2 HCl " width="640"
Химические свойства
Кислота + соль → соль * + кислота *
Должно выполняться одно из двух условий:
- Один из продуктов реакции – летучее вещество (газ)
- Один из продуктов реакции выпадает в осадок
1) 2 HCl + CaCO 3 — CaCl 2 + H 2 O + CO 2 ↑
2) H 2 SO 4 + BaCl 2 — BaSO 4 ↓ + 2 HCl
 H 2 O + SiO 2 t , свет 2) 4 HNO 3 — 2 H 2 O + 4 NO 2 ↑ + O 2 ↑ " width="640"
H 2 O + SiO 2 t , свет 2) 4 HNO 3 — 2 H 2 O + 4 NO 2 ↑ + O 2 ↑ " width="640"
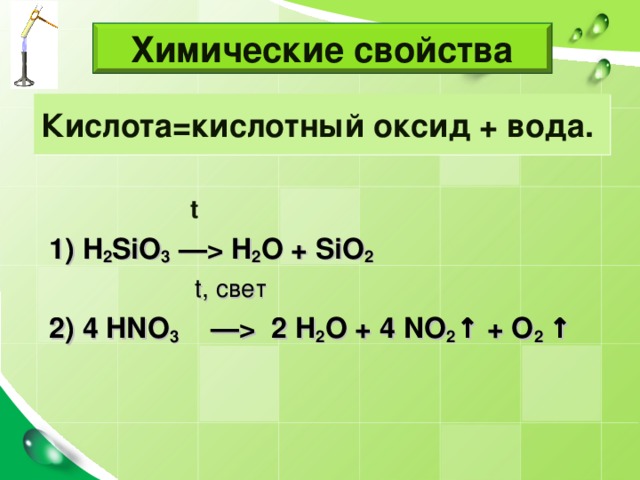
Химические свойства
Кислота=кислотный оксид + вода.
t
1) H 2 SiO 3 — H 2 O + SiO 2
t , свет
2) 4 HNO 3 — 2 H 2 O + 4 NO 2 ↑ + O 2 ↑
Д/З § 38, № 3-6 с. 214

 Получите свидетельство
Получите свидетельство Вход
Вход





















 CaCl 2 + H 2 O " width="640"
CaCl 2 + H 2 O " width="640"

 CaCl 2 + H 2 O + CO 2 ↑ 2) H 2 SO 4 + BaCl 2 — BaSO 4 ↓ + 2 HCl " width="640"
CaCl 2 + H 2 O + CO 2 ↑ 2) H 2 SO 4 + BaCl 2 — BaSO 4 ↓ + 2 HCl " width="640"
 H 2 O + SiO 2 t , свет 2) 4 HNO 3 — 2 H 2 O + 4 NO 2 ↑ + O 2 ↑ " width="640"
H 2 O + SiO 2 t , свет 2) 4 HNO 3 — 2 H 2 O + 4 NO 2 ↑ + O 2 ↑ " width="640"










 Презентация по химии на тему «Кислоты» (4.47 MB)
Презентация по химии на тему «Кислоты» (4.47 MB)
 0
0 1988
1988 114
114 Нравится
0
Нравится
0









