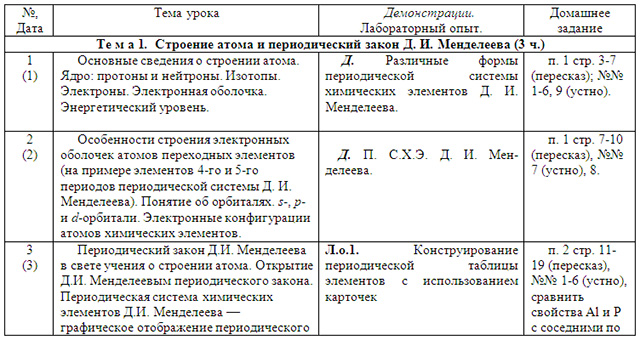
| №, Дата | Тема урока | Демонстрации. Лабораторный опыт. | Домашнее задание |
| Те м а 1. Строение атома и периодический закон Д. И. Менделеева (3 ч.) |
| 1 (1) | Основные сведения о строении атома. Ядро: протоны и нейтроны. Изотопы. Электроны. Электронная оболочка. Энергетический уровень. | Д. Различные формы периодической системы химических элементов Д. И. Менделеева. | п. 1 стр. 3-7 (пересказ); №№ 1-6, 9 (устно). |
| 2 (2) | Особенности строения электронных оболочек атомов переходных элементов (на примере элементов 4-го и 5-го периодов периодической системы Д. И. Менделеева). Понятие об орбиталях. s-, p- и d-орбитали. Электронные конфигурации атомов химических элементов. | Д. П. С.Х.Э. Д. И. Менделеева.
| п. 1 стр. 7-10 (пересказ), №№ 7 (устно), 8. |
| 3 (3) | Периодический закон Д.И. Менделеева в свете учения о строении атома. Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Д.И. Менделеева — графическое отображение периодического закона. Физический смысл порядкового номера элемента, номера периода и номера группы. Валентные электроны. Причины изменения свойств элементов в периодах и группах (главных подгруппах). Положение водорода в периодической системе. Значение периодического закона и периодической системы химических элементов Д. И. Менделеева для развития науки и понимания химической картины мира. | Л.о.1. Конструирование периодической таблицы элементов с использованием карточек
| п. 2 стр. 11-19 (пересказ), №№ 1-6 (устно), сравнить свойства Al и Р с соседними по периоду и по подгруппе элементами. п. 2 стр. 19-20 (пересказ), № 7 (устно). п. 2 стр. 20-23 (пересказ), №№ 8-10 (устно); повт. п. 1-2 стр. 11-20. |
|
1
(4) | Т е м а 2. Строение вещества (14ч.) Ионная химическая связь. Классификация ионов. Механизм образования ионной химической связи. Ионные кристаллические решетки. Свойства веществ с этим типом кристаллических решеток. | Д.Модель кристаллической решетки хлорида натрия. Образцы минералов с ионной кристаллической решеткой: кальцита, галита. Л.о.2. Определение типа кристаллической решетки вещества и описание его свойств | п. 3 стр. 24-26 (пересказ), Na и S. п. 3 стр. 26-28 (пересказ), № 9; на дополнительную оценку № 10. |
| 2.
(5) | Ковалентная химическая связь. Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы. Обменный и донорно-акцепторный механизмы образования ковалентной связи. Молекулярные и атомные кристаллические решетки. Свойства веществ с этими типами кристаллических решеток. | Д. Модели кристаллических решеток «сухого льда» (или иода), алмаза, графита (или кварца). Л.о.2. Определение типа кристаллической решетки вещества и описание его свойств.
| п. 4 стр. 29-33 (пересказ), №№ 1-6 (устно); записать схему образования ковалентной связи между Н и O, Н и S.. п. 4 стр. 33-36 (пересказ), №№ 7,8. |
| 3. (6) | Металлическая химическая связь. Особенности строения атомов металлов. Металлическая кристаллическая решетка. Свойства веществ с этим типом связи. | Д. Модель кристаллической решетки Л.о.2. Определение типа кристаллической решетки вещества и описание его свойств.
| п. 5 (пересказ), №№ 1-8 (устно); на дополнительную оценку №№ 9,10 (по выбору). |
| 4. (7) | Водородная химическая связь. Межмолекулярная и внутримолекулярная водородная связь. Значение водородной связи для организации структур биополимеров.
| Д.Модель молекулы ДНК. Л.о.2. Определение типа кристаллической решетки вещества и описание его свойств. | п. 6 (пересказ), №№ 1-7 (устно); №№ 8,9 (по выбору). |
| 5. (8) | Полимеры: органические и неорганические. Основные понятия химии высокомолекулярных соединений: полимер, мономер, структурное звено, степень полимеризации, реакции полимеризации и поликонденсации. Классификация полимеров (по происхождению, по отношению к нагреванию), их применение.
| Д. Образцы пластмасс, волокон и изделия из них. Образцы неорганических полимеров. Л.о.3. Ознакомление с коллекцией полимеров: пластмасс и волокон и изделия из них.
| п. 7 (пересказ), №№ 7,9; учить записи в тетради. |
| 6. (9) | Единая природа химических связей. | Д. П. С.Х.Э. Д. И. Менделеева.
| п. 10 стр. 91-93 (пересказ), №№ 10,11 (по выбору). |
| 7. (10) | Газообразное состояние вещества. Особенности строения газов. Молярный объем газообразных веществ. Примеры газообразных природных смесей: воздух, природный газ. Загрязнение атмосферы (кислотные дожди, парниковый эффект) и борьба с ним. Представители газообразных веществ: водород, кислород, углекислый газ, аммиак, этилен. Их получение, собирание и распознавание. | Д.Модель молярного объема газов. Образцы различных дисперсных систем: эмульсий, суспензий, аэрозолей, гелей и золей. Эффект Тиндаля. Л.о.6. Ознакомление с дисперсными системами.
| п. 8 стр. 67-73 (пересказ), №№ 3,4. п. 8 стр. 74-79 (пересказ), №№ 11,12. |
| 8. (11) | Практическая работа № 1. Получение, собирание и распознавание газов. | п. 8 (повт.), № 9; |
| 9. (12) | Жидкое состояние вещества. Особенности строения жидкостей. Вода – самое важное и уникальное вещество на планете. Круговорот воды в природе. Потребление воды в быту и на производстве. Жидкие кристаллы и их применение. Жесткость воды и способы ее устранения. Минеральные воды, их использование в столовых и лечебных целях.
| Д.Три агрегатных состояния воды. Образцы накипи в чайнике и трубах центрального отопления. Жесткость воды и способы ее устранения. Приборы на жидких кристаллах. Л.о. 4.Испытание воды на жесткость. Устранение жесткости воды. 5. Ознакомление с минеральными водами.
| п. 9 стр. 80-82, 85-86 (пересказ), №№ 1-6,11 (устно).
п. 9 стр. 83-85 (пересказ), №№ 7-9 (устно). |
| 10. (13) | Твердое состояние вещества. Особенности строения твёрдых тел. Аморфные твердые вещества в природе и в жизни человека, их значение и применение. Кристаллическое строение вещества. | Д. П. С.Х.Э. Д. И. Менделеева.
| п. 10 (пересказ), №№ 1-4,6 (устно); на дополнительную оценку № 5. |
| 11. (14) | Дисперсные системы. Понятие о дисперсных системах. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем в зависимости от агрегатного состояния дисперсной среды и дисперсионной фазы. Грубодисперсные системы: эмульсии, суспензии, аэрозоли. Тонкодисперсные (коллоидные) системы: гели и золи.
| Д. Образцы различных дисперсных систем: эмульсий, суспензий, аэрозолей, гелей и золей. Эффект Тиндаля. Л.о.6. Ознакомление с дисперсными системами. | п. 11 стр. 95-97 (пересказ), №№ 1,3,6 (устно). п. 11 стр. 97-103 (пересказ), №№ 2,4,5,7,8,9,11 (устно); на дополнительную оценку № 10. |
| 12(15) | Состав вещества и смесей. Закон постоянства состава веществ. Решение расчетных задач, связанных с понятием «доля». Понятие «доля» и ее разновидности: массовая (доля элементов в соединении, доля компонента в смеси — доля примесей, доля растворенного вещества в растворе) и объёмная. Доля выхода продукта реакции от теоретически возможного. | Д. П. С.Х.Э. Д. И. Менделеева.
| п. 12 стр. 105-109 (учить), №№ 4-9. п. 12 стр. 109-110 (учить), №№ 10-11; на дополнительную оценку №№ 12-14; повт. п 3-12 стр. 105-109. |
| 13(16) | Обобщение и систематизация знаний обучающихся по теме «Строение вещества». | Д. П. С.Х.Э. Д. И. Менделеева.
| Задание в тетради. |
| 14(17) | Контрольная работа № 1 по теме «Строение веществ» | Д. П. С.Х.Э. Д. И. Менделеева.
| Нет. |
| Т е м а 3. Химические реакции (8 ч.) |
| 1. (18) | Реакции, идущие без изменения состава веществ. Аллотропия и аллотропные видоизменения. Причины аллотропии на примере модификаций кислорода, углерода и фосфора. Изомеры и изомерия. | Д. Превращение красного фосфора в белый. Озонатор. Модели молекул н-бутана и изобутана. | п.13 (пересказ), №№ 1-6 (устно); |
| 2(19) | Реакции, идущие с изменением состава веществ. Реакции соединения (присоединения), разложения, замещения и обмена в неорганической и органической химии. Реакции экзо- и эндотермические. Тепловой эффект химической реакции и термохимические уравнения. Реакции горения, как частный случай экзотермических реакций. | Д.Зависимость скор реакции от природы веществ на примере взаимодействия р-ров различных кислот одинаковой концентрации с одинаковыми гранулами цинка и взаимодействия одинаковых кусочков разных металлов (магния, цинка, железа) с соляной кислотой. Взаимодействие растворов серной кислоты с растворами тиосульфата натрия различной конц и температуры. Л.о.7. Реакция замещения меди железом в растворе медного купороса.
| п.14 стр. 118-123 (пересказ); №№ 1-3 (устно); №№ 4,5; знать таблицу в тетради. |
| 3(20) | Скорость химической реакции. Зависимость скорости химической реакции от природы реагирующих веществ, концентрации, температуры, площади поверхности соприкосновения и катализатора. Реакции гомо- и гетерогенные. Понятие о катализе и катализаторах. Ферменты как биологические катализаторы, особенности их функционирования.
| Д. Зависимость скорости реакции от природы веществ на примере взаимодействия растворов различных кислот одинаковой концентрации с одинаковыми гранулами цинка и взаимодействия одинаковых кусочков разных металлов (магния, цинка, железа) с соляной кислотой. Взаимодействие растворов серной кислоты с растворами тиосульфата натрия различной концентрации и температуры . Модель кипящего слоя. Разложение пероксида водорода с помощью катализатора (оксида марганца (IV)) и каталазы сырого мяса и сырого картофеля. Л.о.8. Реакции, идущие с образованием осадка, газа и воды. 9. Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля. | п.15 стр. 126-136 (пересказ); №№ 1-5 (устно); №№ 10,11.. |
| 4(21) | Необратимые и обратимые химические реакции. Состояние химического равновесия для обратимых химических реакций. Способы смещения химического равновесия на примере синтеза аммиака. Понятие об основных научных принципах производства на примере синтеза аммиака. . | Д. Примеры необратимых реакций, идущих с образованием осадка, газа или воды. Взаимодействие лития и натрия с водой. Л.о.8. Реакции, идущие с образованием осадка, газа и воды.. | п. 16 стр.137-142 (пересказ). |
| 5(22) | Роль воды в химической реакции. Растворение как физико-химический процесс. Истинные растворы. Растворимость и классификация веществ по этому признаку: растворимые, малорастворимые и нерастворимые вещества. Электролиты и неэлектролиты. Электролитическая диссоциация. Кислоты, основания и соли с точки зрения теории электролитической диссоциации. Химические свойства воды: взаимодействие с металлами, основными и кислотными оксидами, разложение и образование кристаллогидратов. Реакции гидратации в органической химии. | Д.Взаимодействие лития и натрия с водой. Получение оксида фосфора (V) и растворение его в воде; испытание полученного раствора лакмусом. Образцы кристаллогидратов. Испытание растворов электролитов и неэлектролитов на предмет диссоциации. Зависимость степени электролитической диссоциации уксусной кислоты от разбавления раствора Л.о.9. Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля. 10. Получение водорода взаимодействием кислоты с цинком | п. 17 стр. 143-148 (пересказ), №№ 2-5 |
| 6(23) | Гидролиз органических и неорганических соединений. Необратимый гидролиз. Обратимый гидролиз солей. Гидролиз органических соединений и его практическое значение для получения гидролизного спирта и мыла. Биологическая роль гидролиза в пластическом и энергетическом обмене веществ и энергии в клетке.
. | Д. Гидролиз карбида кальция. Гидролиз карбонатов щелочных металлов и нитратов цинка или свинца (II). Получение мыла. Простейшие окислительно-восстановительные реакции: взаимодействие цинка с соляной кислотой и железа с раствором сульфата меди (II). Л.о. 11. Различные случаи гидролиза солей. | п. 18 стр.150-154 (пересказ); № 7 (а, б, в – по вариантам). |
| 7(24) | Степень окисления. Определение степени окисления по формуле соединения. Окислительно-восстановительные реакции. Окисление и восстановление, окислитель и восстановитель. | Д. Простейшие окислительно-восстановительные реакции: взаимодействие цинка с соляной кислотой и железа с раствором сульфата меди (II). | п.19 стр.155-158 (пересказ); № 1; задание в тетради. |
| 8(25) | Электролиз. Электролиз как окислительно-восстановительный процесс. Электролиз расплавов и растворов электролитов на примере хлорида натрия. Практическое применение электролиза. Электролитическое получение алюминия. | Д.Модель электролизера. Модель электролизной ванны для получения алюминия. | п.17 стр. 158-162 (пересказ); №№ 6,8. |
| Тема 4. «Вещества и их свойства». 9 |
| 1(26) | Металлы. Химические свойства металлов: взаимодействие с неметаллами, с водой, с растворами кислот и солей, металлотермия; взаимодействие натрия с этанолом и фенолом. Коррозия металлов и способы защиты от неё.
| Д.Коллекция образцов металлов. Взаимодействие щелочноземельных металлов с водой. Взаимодействие натрия с этанолом, цинка с уксусной кислотой. Взаимодействие меди с концентрированной азотной кислотой Взаимодействие меди с концентрированной азотной кислотой. Результаты коррозии металлов в зависимости от условий ее протекания. Взаимодействие натрия с этанолом, цинка с уксусной кислотой. Л.о. 13. Взаимодействие соляной кислоты и раствора уксусной кислоты с металлами. 18. Ознакомление с коллекциями: а- металлов,.
| п. 20 стр. 164-173 (пересказ); №№ 1-4 (устно), № 5 (а, б, в – по вариантам). |
| 2(27) | Неметаллы. Физические свойства неметаллов. Окислительные свойства неметаллов (взаимодействие с металлами и водородом). Восстановительные свойства неметаллов (взаимодействие с более электроотрицательными неметаллами и сложными веществами-окислителями). | Д. Коллекция образцов неметаллов. Взаимодействие хлорной воды с раствором бромида калия. Образцы природных минералов, содержащих хлорид натрия, карбонат кальция, фосфат кальция и гидрокарбонат меди (II). Образцы пищевых продуктов, содержащих гидрокарбонаты натрия и аммония, их способность к разложению при нагревании. Гашение соды уксусом. Качественные реакции на катионы и анионы. 18. Ознакомление с коллекциями: б- неметаллов.
| п. 21 (пересказ); №№ 6,7. |
| 3(28) | Кислоты неорганические и органические. Классификация кислот. Химические свойства кислот: взаимодействие с металлами, оксидами металлов, гидроксидами металлов, солями, спиртами (реакция этерификации). | Д.Взаимодействие натрия с этанолом, цинка с уксусной кислотой. Взаимодействие меди с концентрированной азотной кислотой. Коллекция природных органических кислот. Разбавление концентрированной серной кислоты. Взаимодействие концентрированной серной кислоты с сахаром, целлюлозы и медью.. Гашение соды уксусом. Качественные реакции на катионы и анионы. Л.о.12. Испытание растворов кислот оснований и солей индикаторами. 13. Взаимодействие соляной кислоты и раствора уксусной кислоты с металлами. 14. Взаимодействие соляной кислоты и раствора уксусной кислоты с основаниями. 15. Взаимодействие соляной кислоты и раствора уксусной кислоты с солями.. | п. 22 (пересказ); №№ 5-7. |
| 4(29) | Основания неорганические и органические. Классификация оснований. Химические свойства оснований: взаимодействие с кислотами, кислотными оксидами и солями, разложение нерастворимых оснований при нагревании. | Д. Качественные реакции на катионы и анионы. Л.о.12. Испытание растворов оснований индикаторами. 14. Взаимодействие соляной кислоты и раствора уксусной кислоты с основаниями. 16. Получение и свойства нерастворимых оснований. 18. Ознакомление с коллекциями: г –оснований. | п. 23 (пересказ); №№ 4-7. |
| 5(30) | Соли. Классификация солей: средние, кислые и основные. Химические свойства солей: взаимодействие с кислотами, щелочами, металлами и солями. Представители солей и их значение. Хлорид натрия, карбонат кальция, фосфат кальция (средние соли); гидрокарбонаты натрия и аммония (кислые соли); гидроксокарбонат меди (II) — малахит (основная соль). Качественные реакции на хлорид-, сульфат-, и карбонат-анионы, катион аммония, катионы железа (II) и (III). Качественные реакции на альдегиды, многоатомные спирты, крахмал и белки.
| Д.Образцы природных минералов, содержащих хлорид натрия, карбонат кальция, фосфат кальция и гидрокарбонат меди (II). Образцы пищевых продуктов, содержащих гидрокарбонаты натрия и аммония, их способность к разложению при нагревании. Гашение соды уксусом. Качественные реакции на катионы и анионы. Л.о. Испытание растворов солей индикаторами. 18. Ознакомление с коллекциями минералов и биологических материалов содержащих некоторые соли. | п. 24 стр. 193,198-199 (пересказ); учить записи в тетради; №№ 3,5 (по вариантам), 6; ЛО 22 (найти основные месторождения минералов и их применение). |
| 6(31) | Генетическая связь между классами неорганических и органических соединений. Понятие о генетической связи и генетических рядах. Генетический ряд металла. Генетический ряд неметалла. Особенности генетического ряда в органической химии. | Д. П. С.Х.Э. Д. И. Менделеева.
| п. 25 (пересказ); №№ 3-7. |
| 7(32) | Практическая работа № 2. Решение экспериментальных задач на идентификацию органических и неорганических соединений. Д. П. С.Х.Э. Д. И. Менделеева.
| Повт. п. 20-25; №№ 8,9 на стр. 192. |
| 8(33) | Обобщение и систематизация знаний обучающихся по теме «Единство и многообразие веществ». Контрольная работа №2 по темам «Химические реакции. Вещества и их свойства»
| Д. П. С.Х.Э. Д. И. Менделеева.
| Повт. п. 20-25; задание в тетради. |
| 9(34) | Итоговая контрольная работа
| Д. П. С.Х.Э. Д. И. Менделеева.
| Повт. п. 1-25. |

 Получите свидетельство
Получите свидетельство Вход
Вход











 Календарно-тематическое планирование по химии (11 класс) (32.06 КB)
Календарно-тематическое планирование по химии (11 класс) (32.06 КB)
 0
0 961
961 113
113 Нравится
0
Нравится
0


