В презентации из 11 слайдов представлена определение кислоты, свойства, получение и виды кислот.

В презентации из 11 слайдов представлена определение кислоты, свойства, получение и виды кислот.



Кислоты-
Сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.
Общая формула кислот Н n А , где А - кислотный остаток.
Кислоты (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы водорода Н + и анионы кислотного остатка.

Состав кислот
Mg+2HCl →MgCl₂+H₂↑
Соляная Хлорид
кислота магния
Mg+H ₂ SO ₄→MgSO₄+H₂↑
Серная Сульфит
кислота магния
2 Al+6HCl →2AlCl₃+3H₂
Соляная Хлорид
кислота алюминия
1)Кислотные остатки в химических реакциях обычно сохраняют и переходят из одних соединений в другие.
2)Валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металлов.
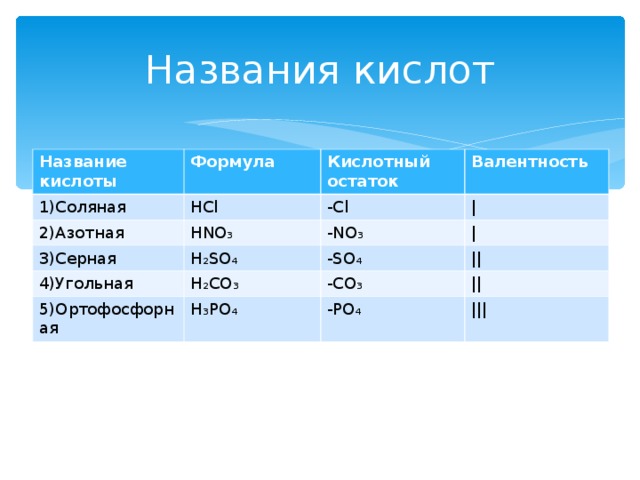
Названия кислот
Название кислоты
1)Соляная
Формула
HCl
Кислотный остаток
2) Азотная
Валентность
3) Серная
HNO₃
-Cl
|
H₂SO₄
-NO₃
4)Угольная
|
-SO₄
H₂CO₃
5)Ортофосфорная
||
H₃PO₄
-CO₃
||
-PO₄
|||
Классификация кислот
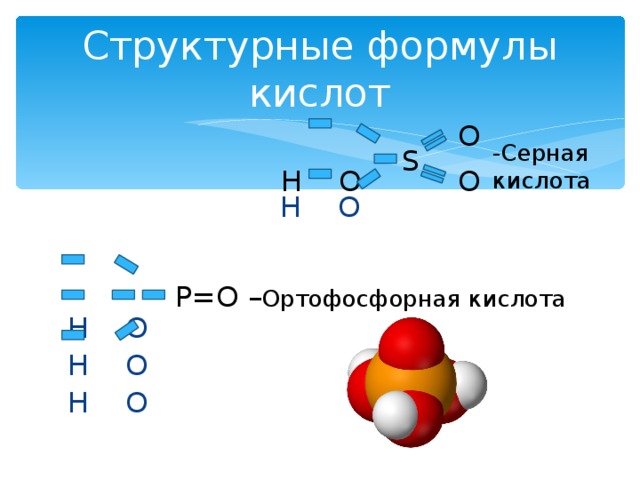
Структурные формулы кислот
O
- Серная кислота
S
H O
O
H O
H O
H O
H O
P=O – Ортофосфорная кислота

Физические свойства
1)Почти все кислоты растворимы в воде(кроме H₂SiO₃)
2) Могут быть газообразными, жидкими, твердыми
3)Некоторые кислоты имеют запах и цвет

Химические свойства
Действие кислот на растворы индикаторов:
1)Растворы кислот окрашивают лакмус в красный, метиловый - оранжевый в розовый, фенолфталеин остаётся бесцветным
индикатор + Н + ( кислота ) окрашенное соединение
2)Характерным свойством кислот является их взаимодействие с металлами. При выпаривании образовавшихся растворов выделяются кристаллические вещества – соли.
K, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb – вытесняют водород из кислот
Cu, Hg, Ag, Pt, Au – водород из кислот не вытесняют
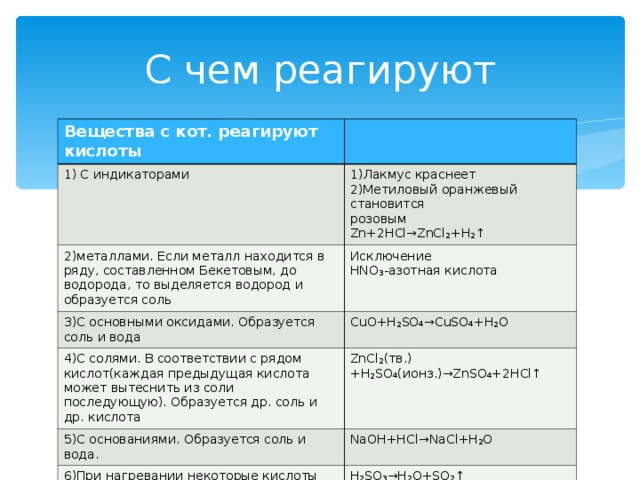
С чем реагируют
Вещества с кот. реагируют кислоты
1) С индикаторами
1)Лакмус краснеет
2)Метиловый оранжевый становится
розовым
Zn+2HCl→ZnCl₂+H₂↑
2) металлами. Если металл находится в ряду, составленном Бекетовым, до водорода, то выделяется водород и образуется соль
Исключение
HNO₃- азотная кислота
3)С основными оксидами. Образуется соль и вода
CuO+H₂SO₄→CuSO₄+H₂O
4) С солями. В соответствии с рядом кислот(каждая предыдущая кислота может вытеснить из соли последующую). Образуется др. соль и др. кислота
ZnCl₂( тв.)+ H₂SO₄( ионз.) →ZnSO₄+2HCl ↑
5) С основаниями. Образуется соль и вода.
NaOH+HCl → NaCl+H₂O
6) При нагревании некоторые кислоты разлагаются, как правило, образуется кислотный оксид и вода.
H₂SO₃→H₂O + SO₂↑

ПОЛУЧЕНИЕ Бескислородные кислоты получают: 1) Из неметаллов и водорода с последующим растворением образовавшегося газа в воде : Cl 2 + H 2 → 2HCl. 2) При действии сильных кислот на соли более слабых или летучих бескислородных кислот : 2HCl + Na 2 S → 2NaCl + Н 2 S 2H + + S 2– → Н 2 S. Кислородсодержащие кислоты получают: 1) Взаимодействием кислотного оксида и воды. Оксид кремния(IV) SiO 2 с водой не реагирует! SO 2 + H 2 O → H 2 SO 3 . 2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот : 2HCl + Na 2 CO 3 → 2NaCl + Н 2 СО 3 2H + + CO 3 2– → Н 2 СО 3 .
 -80%
-80%
 0
0 3378
3378 95
95 Нравится
0
Нравится
0