Цели и задачи рабочей программы
Цель - вооружение учащихся основами химических знаний, необходимых для повседневной жизни, производственной деятельности, продолжения образования, правильной ориентации и поведении в окружающей среде, внесение существенного вклада в развитие научного миропонимания учащихся.
В данной программе выражена гуманистическая и химико- экологическая направленность и ориентация на развивающее обучение. В ней отражена система важнейших химических знаний, раскрыта роль химии в познании окружающего мира, в повышении уровня материальной жизни общества, в развитии его культуры, в решении важнейших проблем современности.
Задачи:
- вооружить учащихся знаниями основ науки и химической технологии, способами их добывания, переработки и применения;
- раскрыть роль химии в познании природы и обеспечении жизни общества, показать значение общего химического образования для правильной ориентации в жизни в условиях ухудшении экологической обстановки;
- внести вклад в развитие научного миропонимания ученика;
- развить внутреннюю мотивацию учения, повысить интерес к познанию химии;
- развить экологическую культуру учащихся.
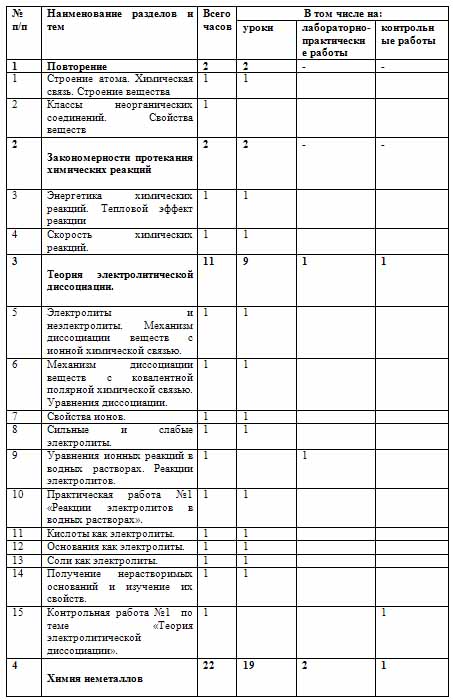
Содержание тем учебного курса химии
1. Повторение - 2часа
Строение атома. Химическая связь. Строение вещества
Классы неорганических соединений. Свойства веществ
Демонстрации:
Образцы неорганических соединений.
Модели кристаллических решеток.
Опыты, раскрывающие взаимосвязь строения и свойства.
2. Закономерности протекания химических реакций -2 часа
Энергетика химических реакций. Тепловой эффект реакции
Скорость химических реакций. Энергетика и пища. Калорийность жиров, белков и углеводов
Лабораторный опыт
Изучение скорости протекания химических реакций
3. Теория электролитической диссоциации -- 11 часов
Электролиты и неэлектролиты. Механизм диссоциации веществ с ионной химической связью.
Механизм диссоциации веществ с ковалентной полярной химической связью.
Сильные и слабые электролиты.
Реакции электролитов в водных растворах. Уравнения ионных реакций в водных растворах.
Кислоты как электролиты.
Основания как электролиты.
Соли как электролиты.
Демонстрации:
Модели и образцы ионитов.
Испытание веществ и их растворов на электрическую проводимость
Влияние разбавления на степень диссоциации
Гидратация и дегидратация ионов (на примере безводного сульфата меди (II))
Влияние разбавления на степень диссоциации
Взаимодействие оксида магния с кислотами.
Взаимодействие углекислого газа с известковой водой.
Лабораторный опыт
Получение осадков нерастворимых оснований и изучение их свойств
Практические работы
1. Реакции электролитов в водных растворах
Контрольная работа №1 по теме «Теория электролитической диссоциации».
4. Химия неметаллов - 22 часа
Общая характеристика элементов-неметаллов
Простые вещества-неметаллы, их состав, строение, общие свойства и получение
Водородные и кислородные соединения неметаллов
Общая характеристика элементов подгруппы кислорода и их простых веществ. Биологические функции халькогенов. Кислород. Озон. Круговорот кислорода в природе
Сера. Аллотропия и свойства серы
Сероводород. Сульфиды
Кислородсодержащие соединения серы. Круговорот серы в природе
Общая характеристика элементов подгруппы азота. История открытия элементов подгруппы азота
Азот – простое вещество
Аммиак
Соли аммония
Оксиды азота
Азотная кислота
Нитраты – соли азотной кислоты. Круговорот азота в природе
Фосфор – элемент и простое вещество. Круговорот фосфора в природе
Общая характеристика элементов подгруппы углерода. Углерод – простое вещество. Круговорот углерода в природе
Оксиды углерода. Угольная кислота и ее соли
Кремний и его свойства. Соединения кремния.
Полную информацию смотрите в файле.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии для 9-го класса (43.49 КB)
Рабочая программа по химии для 9-го класса (43.49 КB)
 1
1 611
611 46
46 Нравится
0
Нравится
0








