Муниципальное бюджетное общеобразовательное учреждение -
Смолевичская основная общеобразовательная школа
Клинцовского района Брянской области
РАССМОТРЕНО
на МО учителей естественно-научного цикла
протокол № ___
от «___» _________2013 г.
рук. ________ И.В.Перькова
СОГЛАСОВАНО
«___» ________ 2013 г.
зам. директора по УВР ________ Н.В.Гутникова
УТВЕРЖДЕНО
приказ № ____
от «___» _________ 2013 г.
директор школы
________ С.В.Буравлева
Рабочая программа
по химии
9 класс
Учитель: Буравлева Светлана Васильевна
первая квалификационная категория
2015 -2016 уч. год
Пояснительная записка
Рабочая программа по химии составлена в соответствии с федеральным компонентом государственного стандарта общего образования, примерной программы основного общего образования по химии, программы курса химии для 8-11 классов общеобразовательных учреждений (автор О.С. Габриелян), допущенной Министерством образования Российской Федерации, опубликованной издательством «Дрофа» в 2009 году.
В тематическом планировании изменений с программой курса химии 9 класса О.С. Габриеляна нет. Данная рабочая программа может быть реализована при использовании традиционной технологии обучения, а также элементов других современных образовательных технологий, передовых форм и методов обучения, таких как проблемный метод, развивающее обучение, компьютерные технологии, тестовый контроль знаний и др. в зависимости от склонностей, потребностей, возможностей и способностей каждого конкретного класса.
Программа курса построена на концентрической концепции. Особенность программы состоит в том, что она позволяет сохранить высокий теоретический уровень и сделать обучение максимально развивающим. Весь теоретический материал курса химии рассматривался на первом году обучения (8 класс), что позволяет учащимся более осознанно и глубоко изучить фактический материал – химию элементов и их соединений. Такое построение программы даёт возможность развивать полученные первоначально теоретические сведения на богатом фактическом материале химии элементов в 9 классе.
Цель курса: изучение состава, строения, свойств химических элементов- представителей отдельных групп главных подгрупп периодической системы элементов Д.И. Менделеева, их соединений и применения.
Задачи:
реализация единства веществ природы, их генетической связи;
установление причинно-следственных связей между составом, строением, свойствами и применением веществ;
формирование основных понятий курса химии 9 класса;
развитие метапредметных умений и навыков;
формирование специальных предметных умений и навыков работы с веществами;
практическая направленность обучения;
контроль знаний, умений и навыков учащихся.
Содержание курса составляет основу для раскрытия важных мировоззренческих идей, таких, как материальное единство веществ природы, их генетическая связь, развитие форм от сравнительно простых до наиболее сложных, входящих в состав организмов; обусловленность свойств веществ их составом и строением, приме нения веществ их свойствами; единство природы химических связей и способов их преобразования при химических превращениях; познаваемость сущности химических превращений современными научными методами.
Курс включает в себя основы общей и неорганической химии, а также краткие сведения об органических веществах. В программе названы основные разделы курса, для каждого из них перечислены подлежащие изучению вопросы, виды расчетов, химический эксперимент (демонстрации, лабораторные опыты, практические работы, объекты учебных экскурсий). Химический эксперимент в процессе обучения сочетается с другими средствами обучения, в том числе с аудиовизуальными.
Рабочая программа рассчитана на 2 часа в неделю (всего 68 часов). На практикум отводится 6 часов, 4 часа – контрольные работы, 3 часа - на решение расчетных задач.
График контрольных и практических работ.
| № п/п | Дата проведения | Название практической или контрольной работ. |
| По плану | фактически |
|
|
|
| Практическая работа № 1 «Осуществление цепочки химических превращений».
Практическая работа № 2 «Получение и свойства соединений металлов».
Практическая работа № 3. Решение экспериментальных задач по теме на распознавание и получение веществ.
Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода».
Практическая работа № 5. Экспериментальные задачи по теме «Подгруппа азота и углерода».
Практическая работа № 6 «Получение, собирание и распознавание газов (углекислого газа, аммиака)». Контрольная работа № 1 по теме «Металлы». Контрольная работа № 2 по теме «Неметаллы». Контрольная работа № 3 по теме «Органические соединения»
Итоговая контрольная работа. |
Блок «Содержание курса».
Повторение основных вопросов курса 8 класса и введение в курс 9 класса (6 ч)
Характеристика элемента по его положению в периодической системе Д. И. Менделеева. Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и окисления-восстановления.
Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента.
Периодический закон и периодическая система химических элементов Д. И. Менделеева.
Тема 1. Металлы (15 ч)
Положение металлов в периодической системе Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Химические свойства металлов как восстановителей, а также в свете их положения в электрохимическом ряду напряжений металлов. Коррозия металлов и способы борьбы с ней. Сплавы, их свойства и значение.
Общая характеристика щелочных металлов. Металлы в природе. Общие способы их получения. Строение атомов. Щелочные металлы — простые вещества. Важнейшие соединения щелочных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, сульфаты, нитраты), их свойства и применение в народном хозяйстве. Калийные удобрения.
Общая характеристика элементов главной подгруппы II группы. Строение атомов, Щелочноземельные металлы — простые вещества. Важнейшие соединения щелочноземельных металлов — оксиды, гидроксиды и соли (хлориды, карбонаты, нитраты, сульфаты, фосфаты), их свойства и применение в народном хозяйстве.
Алюминий. Строение атома, физические и химические свойства простого вещества. Соединения алюминия — оксид и гидроксид, их амфотерный характер. Важнейшие соли алюминия. Применение алюминия и его соединений.
Железо. Строение атома, физические и химические свойства простого вещества. Генетические ряды Fе2+ и Fе3+. Важнейшие соли железа. Значение железа и его соединений для природы и народного хозяйства.
Демонстрации.
Образцы щелочных и щелочноземельных металлов. Образцы сплавов. Взаимодействие натрия, лития и кальция с водой. Взаимодействие натрия и магния с кислородом. Взаимодействие металлов с неметаллами. Получение гидроксидов железа (II) и (III).
Лабораторные опыты.
1. Получение и взаимодействие гидроксида цинка с растворами кислот и щелочей. 2. Рассмотрение образцов металлов. 3. Взаимодействие металлов с растворами кислот и солей. 4. Ознакомление с образцами природных соединений натрия, кальция, алюминия и рудами железа. 5. Качественные реакции на ионы Fе2+ и Fе3+.
Тема 2. Практикум №1 Свойства металлов и их соединений (3 часа).
Тема 3. Неметаллы (23 ч)
Общая характеристика неметаллов: положение в периодической системе, особенности строения атомов, электроотрицательность (ЭО) как мера «неметалличности», ряд ЭО. Кристаллическое строение неметаллов — простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятия «металл» — «неметалл».
Общая характеристика галогенов. Строение атомов. Простые вещества и основные соединения галогенов, их свойства. Краткие сведения о хлоре, броме, фторе и йоде. Применение галогенов и их соединений в народном хозяйстве.
Сера. Строение атома, аллотропия, свойства и применение ромбической серы. Оксиды серы (IV и VI), их получение, свойства и применение. Серная кислота и ее соли, их применение в народном хозяйстве. Производство серной кислоты.
Азот. Строение атома и молекулы, свойства простого вещества. Аммиак, строение, свойства, получение и применение. Соли аммония, их свойства и применение. Оксиды азота (II) и (IV). Азотная кислота, ее свойства и применение. Нитраты и нитриты, проблема их содержания в сельскохозяйственной продукции. Азотные удобрения.
Фосфор. Строение атома, аллотропия, свойства белого и красного фосфора, их применение. Основные соединения: оксид фосфора (V) и ортофосфорная кислота, фосфаты. Фосфорные удобрения.
Углерод. Строение атома, аллотропия, свойства модификаций, применение. Оксиды углерода (II) и (IV), их свойства и применение. Карбонаты: кальцит, сода, поташ, их значение в природе и жизни человека.
Кремний. Строение атома, кристаллический кремний, его свойства и применение. Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Понятие о силикатной промышленности.
Демонстрации.
Образцы галогенов — простых веществ. Взаимодействие галогенов с натрием, алюминием. Вытеснение хлором брома или йода из растворов их солей. Взаимодействие серы с металлами, водородом и кислородом. Взаимодействие концентрированной азотной кислоты с медью. Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. Образцы природных соединений хлора, серы, фосфора, углерода, кремния. Образцы важнейших для народного хозяйства сульфатов, нитратов, карбонатов, фосфатов. Образцы стекла, керамики, цемента.
Лабораторные опыты.
6. Качественные реакции на хлорид-, сульфат-, карбонат-ионы. 7. Распознавание солей аммония. 8. Ознакомление с природными силикатами. 9. Ознакомление с продукцией силикатной промышленности. 10. Получение углекислого газа и его распознавание.
Тема 4. Практикум № 2. «Свойства металлов и их соединений» (3 ч)
4. Решение экспериментальных задач по теме «Подгруппа кислорода». 5. Решение экспериментальных задач по теме «Подгруппа азота и углерода». 6.Получение, собирание и распознавание газов.
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Тема 5. Органические соединения (10 ч)
Вещества органические и неорганические, относительность этого понятия. Причины многообразия углеродных соединений. Теория строения органических соединений А. М. Бутлерова.
Алканы. Строение молекулы метана. Понятие о гомологическом ряде. Изомерия углеродного скелета. Химические свойства алканов: реакция горения,замещения, разложения и изомеризации. Применение метана.
Алкены. Этилен как родоначальник гомологического ряда алкенов. Двойная связь в молекуле этилена. Свойства этилена: реакции присоединения (водорода, галогена, галогеноводорода, воды) и окисления. Понятие о предельных одноатомных спиртах на примере этанола и двухатомных — на примере этиленгликоля. Трехатомный спирт — глицерин. Реакции полимеризации этилена. Полиэтилен и его значение.
Алкины. Ацетилен. Тройная связь в молекуле ацетилена. Применение ацетилена на основе свойств: реакция горения, присоединения хлороводорода и дальнейшая полимеризация в поливинилхлорид, реакция гидратации ацетилена. Понятие об альдегидах на примере уксусного альдегида.
Окисление альдегида в кислоту. Одноосновные предельные карбоновые кислоты на примере уксусной кислоты. Ее свойства и применение.
Реакции этерификации и понятие о сложных эфирах. Жиры как сложные эфиры глицерина и жирных кислот.
Понятие об аминокислотах как амфотерных органических веществах. Реакции поликонденсации. Белки, их строение и биологическая роль.
Понятие об углеводах. Глюкоза, ее свойства и значение. Крахмал и целлюлоза, их биологическая роль.
Демонстрации.
Модели молекул метана и других углеводородов. Взаимодействие этилена с бромной водой и раствором перманганата калия. Получение ацетилена карбидным способом и его горение. Образцы этанола, этиленгликоля и глицерина. Окисление уксусной кислоты. Получение уксусно-этилового эфира. Омыление жира. Доказательство наличия функциональных групп в растворах аминокислот. Цветные реакции белков. Взаимодействие глюкозы с аммиачным раствором оксида серебра. Гидролиз глюкозы и крахмала.
Лабораторные опыты.
11. Изготовление моделей молекул углеводородов. 12. Свойства глицерина. 13.Взаимодействие глюкозы с гидроксидом меди (II). 14.Взаимодействие крахмала с йодом.
Тема 6. Обобщение знаний по химии за курс основной школы. (8 ч)
.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ
Основные умения и навыки, которые должны быть сформированы у учащихся по окончанию изучения курса химии в 9 классе:
Неорганическая химия
Учащиеся должны знать:
положение металлов и неметаллов в ПСХЭ Д.И.Менделеева;
общие физические и химические свойства металлов и основные способы их получения;
основные свойства и применение важнейших соединений щелочных и щелочноземельных металлов;
алюминия;
качественные реакции на важнейшие катионы и анионы.
Учащиеся должны уметь:
давать определения и применять следующие понятия: сплавы, коррозия металлов, переходные элементы, амфотерность;
характеризовать свойства классов химических элементов, групп химических элементов (ЩМ и ЩЗМ, галогенов) и важнейших химических элементов (алюминия, железа, серы, азота, фосфора, углерода и кремния) в свете изученных теорий;
распознавать важнейшие катионы и анионы;
решать расчетные задачи с использованием изученных понятий.
Органическая химия
Учащиеся должны знать:
причины многообразия углеродных соединений(изомерию); виды связей; важнейшие функциональные группы, номенклатуру основных представителей групп органических веществ;
строение, свойства и практическое применение метана, этилена, ацетилена, одноатомных и многоатомных спиртов, уксусного альдегида и уксусной кислоты;
понятие об альдегидах, сложных эфирах, жирах, аминокислотах, белках и углеводах; реакциях этерификации, полимеризации и поликонденсации.
Учащиеся должны уметь:
разъяснять на примерах причины многообразия органических веществ, материальное единство и взаимосвязь органических веществ, причинно-следственную зависимость между составом, строением, свойствами и практическим применением веществ;
составлять уравнения химических реакций, подтверждающих свойства изученных органических веществ, их генетическую связь;
выполнять обозначенные в программе эксперименты и распознавать важнейшие органические вещества.
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентраци
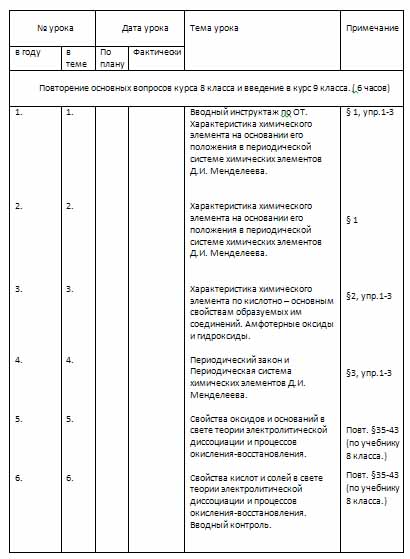
Календарно-тематический план (9 класс)
| № урока |
Дата урока |
Тема урока |
Примечание |
| в году | в теме | По плану | Фактически |
| Повторение основных вопросов курса 8 класса и введение в курс 9 класса. ( 6 часов)
|
| 1.
2.
3.
4.
5.
6. | 1.
2.
3.
4.
5.
6. |
|
| Вводный инструктаж по ОТ. Характеристика химического элемента на основании его положения в периодической системе химических элементов Д.И. Менделеева.
Характеристика химического элемента на основании его положения в периодической системе химических элементов Д.И. Менделеева.
Характеристика химического элемента по кислотно – основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Свойства оксидов и оснований в свете теории электролитической диссоциации и процессов окисления-восстановления.
Свойства кислот и солей в свете теории электролитической диссоциации и процессов окисления-восстановления. Вводный контроль.
| § 1, упр.1-3
§ 1
§2, упр.1-3
§3, упр.1-3
Повт. §35-43 (по учебнику 8 класса.) Повт. §35-43 (по учебнику 8 класса.)
|
| Тема 1. Металлы. (15 часов) |
|
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21. |
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15. |
|
| Положение металлов в периодической системе химических элементов Д.И. Менделеева и особенности строения их атомов. Физические свойства металлов.
Сплавы.
Химические свойства металлов.
Металлы в природе. Общие способы их получения.
Коррозия металлов.
Общая характеристика элементов главной подгруппы l группы.
Щелочные металлы.
Общая характеристика элементов главной подгруппы ll группы.
Бериллий, магний и щелочноземельные металлы.
Алюминий.
Железо, его физические и химические свойства.
Генетические ряды железа (ll ) и железа (lll ).
Обобщающий урок по теме «Металлы».
Решение задач на определение выхода продукта реакции.
Контрольная работа № 1 по теме «Металлы».
|
§4(читать), §5-6. Упр.1-3
§7, упр.1,3
§8, упр.2-3
§9, упр.6
§10
§11 стр. 52-54
§11 стр. 54-58 §12 стр. 60-62
§12 стр. 63-67
§13, упр.6
§14 стр.76-78
§14 стр.78-82
Повт. тему «Металлы»
Повт. тему «Металлы»
|
| Тема 2. Свойства металлов и их соединений. (3 часа). Практикум № 1
|
| 22.
23.
24.
| 1.
2.
3.
|
|
| Практическая работа № 1 «Осуществление цепочки химических превращений».
Практическая работа № 2 «Получение и свойства соединений металлов».
Практическая работа № 3. Решение экспериментальных задач по теме на распознавание и получение веществ. | Стр.84
Стр.84-85
Стр.86-87 |
| Тема 3. Неметаллы. (23 часа)
|
| 25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
| 1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
|
|
| Неметаллы: атомы и простые вещества. Кислород, озон, воздух.
Химические элементы в клетках живых организмов.
Водород.
Галогены.
Соединения галогенов.
Получение галогенов. Биологическое значение и применение галогенов и их соединений.
Кислород.
Сера, ее физические и химические свойства.
Соединения серы.
Азот и его свойства.
Аммиак и его свойства.
Соли аммония.
Кислородные соединения азота.
Соли азотной и азотистой кислоты. Азотные удобрения.
Фосфор, его физические и химические свойства.
Соединения фосфора. Фосфорные удобрения.
Углерод, его физические и химические свойства.
Оксиды углерода. Сравнение физических и химических свойств.
Кремний и его соединения.
Решение расчетных задач.
Решение расчетных задач.
Обобщающий урок по теме «Неметаллы».
Контрольная работа № 2 по теме «Неметаллы».
| §15
§16
§17
§18
§19
§20
§21
§22
§23
§24
§25
§26
§27стр.156-157 §27стр.157-158,стр.255-256 §28
Стр.257-259.
§29
§30
§31 |
| Тема 4. Свойства неметаллов и их соединений. (3 часа). Практикум № 2. |
| 48.
49.
50. | 1.
2.
3. |
|
| Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода».
Практическая работа № 5. Экспериментальные задачи по теме «Подгруппа азота и углерода».
Практическая работа № 6 «Получение, собирание и распознавание газов (углекислого газа, аммиака)». |
Стр.186-187
Стр.187-189
Стр.189-192 |
| Тема 5. Органические соединения. (10 часов). |
|
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
|
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
|
|
|
Предмет органической химии.
Предельные углеводороды.
Непредельные углеводороды. Этилен. Спирты.
Предельные одноосновные карбоновые кислоты. Сложны эфиры.
Жиры.
Аминокислоты и белки.
Углеводы.
Полимеры. Контрольная работа № 3 по теме «Органические соединения» |
§32
§33
§34
§35
§36
§37
§38
§39
§40
|
| Тема 6. Обобщение знаний по химии за курс основной школы. (8часов)
|
| 61.
62.
63.
64.
65.
66.
67.
68. | 1.
2.
3.
4.
5.
6.
7.
8. |
|
| Периодическая система химических элементов Д.И. Менделеева.
Типы химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств вещества.
Классификация химических реакций по различным признакам.
Классификация химических веществ.
Оксиды, гидроксиды: состав, классификация и общие химические свойства.
Кислоты, соли: состав, классификация и общие химические свойства.
Итоговая контрольная работа.
Анализ контрольной работы. | Повт. §1, 3, 5. |
|
Повт. §
Повт. §
Повт. §
Повт. §
Повт. §
Повт. §
|
Блок контрольно-измерительных материалов.
Химия 9 класс.: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия.9»/ О.С. Габриелян, П.Н. Берёзкин, А.А. Ушакова и др. – М.: Дрофа, 2010.
Габриелян О.С., Смирнова Т.В. Изучаем химию в 9кл.: Дидактические материалы. – М.: Блик плюс, 2004.
Габриелян О.С., Яшукова А.В.. Рабочая тетрадь. 9кл. К учебнику О.С. Габриеляна «Химия.8». – М.: Дрофа, 2009-2011.
Блок информационно-методического обеспечения.
1. Сборник нормативных документов. Химия / Сост. Э.Д. Днепров, А.Г. Аркадьев. – М.: Дрофа, 2006.
2. Программа курса химии для 8 – 11 классов общеобразовательных учреждений / О.С. Габриелян. – М.: Дрофа, 2007.
3. Пособие по химии для поступающих в ВУЗы / Г.П.Хомченко-М.: Новая волна,2006.
4. Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений. – М.: Дрофа, 2009.
5. Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 9 класс.: Методическое пособие. – М.: Дрофа, 2003г.
6. Химия 9 класс.: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия.9»/ О.С. Габриелян, П.Н. Берёзкин, А.А. Ушакова и др. – М.: Дрофа, 2010.
7. Габриелян О.С., Смирнова Т.В. Изучаем химию в 9 кл.: Дидактические материалы. – М.: Блик плюс, 2004.
8. Габриелян О.С., Яшукова А.В.. Рабочая тетрадь. 9 кл. К учебнику О.С.
9. Габриеляна «Химия.8». – М.: Дрофа, 2009-2011.Габриелян О.С., Рунов Н.Н., Толкунов В.И. Химический эксперимент в школе. 9 класс. – М.: Дрофа, 2005.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (9-й класс) (0.12 MB)
Рабочая программа по химии (9-й класс) (0.12 MB)
 0
0 805
805 4
4 Нравится
0
Нравится
0


