Тема урока: «Молярный объем газов»
Тип урока: комбинированный.
Цель урока: сформировать понятие о молярном объеме и единицах его измерения и как используется данная величина при решении задач.
Задачи урока:
Образовательные:
Проверить качество усвоения знания формул и понятий: количество вещества, моль, молярная масса, число Авогадро молярный объем, закон Авогадро;
Активизировать ранее сформированные навыки решения задач по данной теме.
Развивающие:
Развитие навыков, необходимых при решении расчетных задач: умение выводить производные от формул; умение грамотно оформить задачу;
Развитие познавательного интереса к предмету и навыков самооценки знаний.
Воспитательные:
Организация самостоятельной деятельности обучающихся на уроке;
воспитание взаимовыручки и взаимодействия через игровые и
групповые формы работы.
Продолжить формирования навыков заботы о своем здоровье.
Средства обучения:
Оборудование: формулы(физических величин) на магнитной доске, презентация, раздаточный материал.
Вещества: образцы объемов различных соединений, взятых количеством вещества в 1 моль: сера, углерод (активированный уголь), йод; куб объемом 22,4 л.
Методы и формы обучения: объяснительно-иллюстративный с элементами проблемно-поискового изложения; групповая работа по решению задач.
Используемые педагогические технологии: игровые, групповые, ИКТ, проблемно-поисковый, (дифференцированный, работа по схеме-алгоритму)
ХОД УРОКА
I. Оргмомент.
(слайд 2)
Эпиграф урока:
«Для тех, кто мало знает и этого много, а для тех, кто хочет знать много и этого мало»
Л.Зорина
II. Опрос. Актуализация знаний.
(слайд 3)
Задание 1
Выберите только те элементы, которые образуют простые вещества, находящиеся в газообразном состоянии при н. у. Запишите названия этих элементов в сетку кроссворда таким образом, чтобы в выделенных клетках получилась фамилия учёного. Запишите эту фамилию в ответе одним словом, в именительном падеже, единственном числе, без каких-либо знаков препинания, например Ломоносов
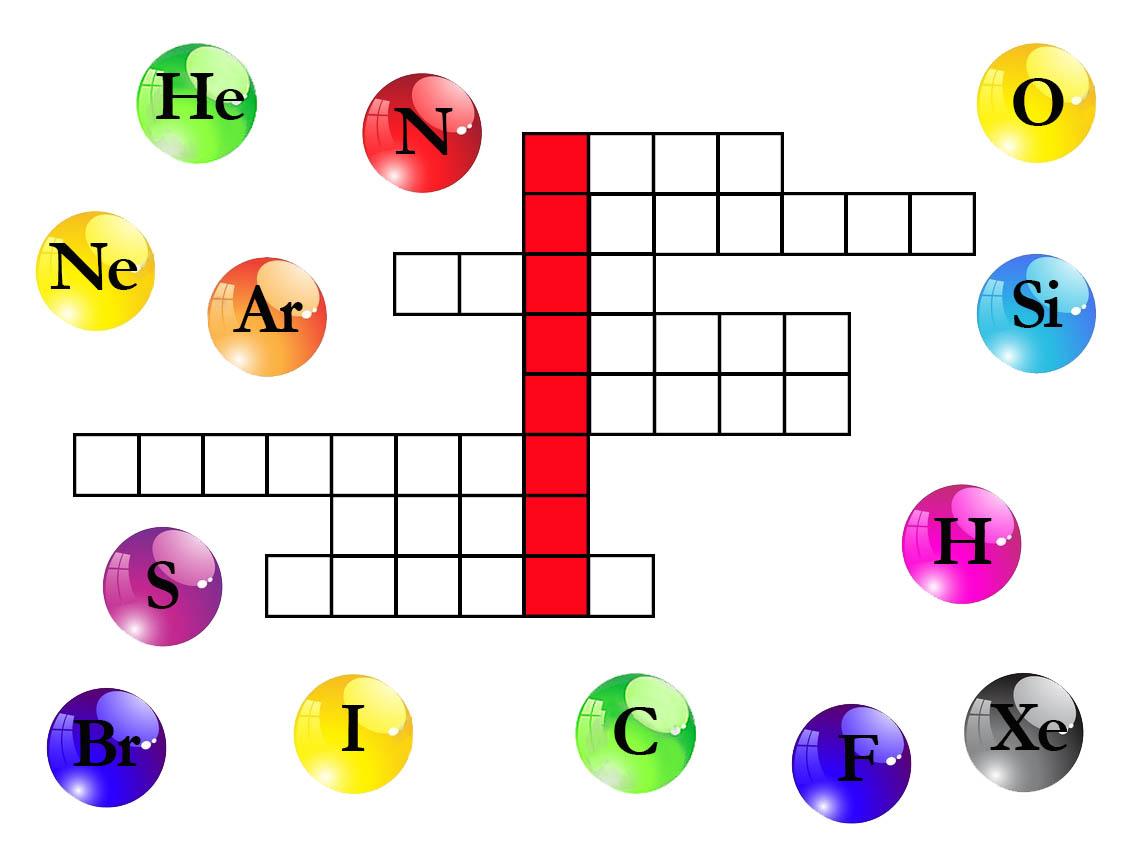
(слайд 4)
Ответ: Авогадро
Т
О
З
А
Д
О
Р
О
Д
О
В
О
Н
Е
Н
Е
Й
И
Л
Г
О
Г
Н
Р
А
К
И
С
Л
О
Р
О
Д
Ф
Т
О
Р
Н
К
С
Е
Н
О
(слайд 5)
Задание 2
При изучении, какого понятия мы уже встречались с этой фамилией?
Какой физический смысл имеет число Авогадро и его числовое значение?
( экспериментально доказано, что 1 моль любого вещества содержит 6.02⋅1023 молекул, атомов или других частиц. Число 6.02⋅1023 названо числом Авогадро в честь итальянского учёного Амедео Авогадро.
Число структурных элементов(молекул, атомов или других частиц) в одном моле любого вещества будет равно 6.02⋅1023 моль-1. Эту величину называют постоянной Авогадро и обозначается NA)
(слайд 6-7)
Задание 3
Восстановите формулы, вставив в них пропущенные физические величины:….
Задание 4
Запишите формулы газообразных веществ и рассмотрите их состав.
Газообразные:
O2, H2, F2, N2 – молекулы состоят из 2-х атомов.
He, Ne, Ar, Xe – молекулы состоят их одного атома.
(слайд 8)
Задание 4
Выберите только те элементы, которые образуют простые вещества, находящиеся в твердом(жидком) агрегатном состоянии. Запишите формулы веществ и рассмотрите их состав.
Твердые: S, C, Si
Активированный уголь - это лекарственное средство, широко используемое в медицинской практике как универсальный антидот, то есть лекарственный препарат, нейтрализующий отравляющее воздействие или передозировку вредных для организма веществ. Изготавливают активированный уголь из натурального сырья при повышенной температуре (до 1000ºС). Полученное вещество практически полностью состоит из углерода, имеет ярко выраженную пористую структуру и обладает отличным адсорбционным и каталитическим действием.
Сера – это химический элемент, от которого в значительной степени зависит состояние кожи. Если наблюдается недостаток этого элемента, кожа со временем становиться дряблой и тусклой, снижаются защитные функции.
А вот какими полезными свойствами обладает сера:
Слабенькое, но мягкое антисептическое действие — главная причина применения медицинской очищенной серы от прыщей. Сера подавляет рост бактерий и уничтожает «всю нечисть», которая является возбудителем прыщей и воспаления.
Противовоспалительное. Сера успокаивает кожу, снимает воспаления в прыщиках, помогая им быстрее созреть.
Отшелушивающее. Сера деликатно устраняет ороговевшие клетки кожи, способствует её обновлению после угревой сыпи.
Яркое подсушивающее действие. Сера сильно сушит кожу, нужно применять её поэтому осторожно. Вот почему серу так любят обладатели жирной кожи.
Помимо этого сера принимает непосредственное участие во многих обменных процессах организма, поддерживает нормальное функционирование пищеварительной и нервной систем.
Жидкие: Br2, I2– молекулы состоят из 2-х атомов.
Элементарный йод обладает выраженными противомикробными свойствами. Для препаратов элементарного йода характерно выраженное местнораздражающее действие на ткани, а в высоких концентрациях - прижигающий эффект.
(слайд 9)

III. Изучение нового материала:
1. Как называют массу 1 моль вещества (молярной) М
2. А как называют объем 1 моль вещества? (молярным) Vm
Тема урока: «Молярный объем газов»
(слайд 10)
|
Амедео Авогадро Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро). ВИДЕО Обращение к учебнику: автор Г.Е. Рудзитис, Ф.Г. Фельдман 8 класс - п. 38(с.126-128) (Запись закона и следствия) Cледствия из закона Авогадро: Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём. Так, 6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л. Такой объём называется молярным объёмом и обозначается Vm Молярный объём – это постоянная величина для веществ – газов при нормальных условиях (н.у.):
Объем 1 кмоля называют киломолярным объемом и измеряют в м3/кмоль, т.е. он равен 22,4 м3/кмоль, а объем 1 ммоля называют миллимолярным объемом, измеряют его в мл/ммоль, т.е. миллимолярный объем равен 22, 4 мл/ммоль. IV. Решение задач Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества: υ = V / Vm = N / Na = m / M M = ρVm Задача №1 Образец: Какой объем занимает 5 моль N2 при н.у.?
Задачи для самостоятельного решения Решите задачи по приведённому образцу: 1. Какой объем занимает 5 моль О2 при н.у.? 2. Какой объем занимает 3,5 моль метана СН4 при н.у.? Задача №2 Образец: Какое количество вещества содержится при н.у. в следующей порции газа: 67,2 л азота?
Задачи для самостоятельного решения Решите задачи по приведённому образцу: 1. Определите количество вещества газа, объем которого при н.у. составляет 2,24 л фтора? 2. Определите количество вещества газа, объем которого при н.у. составляет 224 л угарного газа? Задача №3 Образец: Рассчитайте, какой объем при н.у. займут 340 мг аммиака NH3.?
Задачи для самостоятельного решения Решите задачи по приведённому образцу: 1. Какой объем займут 3,4 г. газа сероводорода H2S при н.у.? 2. Какой объем займут 14,5 кг. газа бутана СH4 при н.у.? Задача №4 Образец: В каком объеме содержится 1,204·1023 молекул водорода Н2 при н.у.?
Задачи для самостоятельного решения Решите задачи по приведённому образцу: 1. В каком объеме содержится 1,806 ·1024 молекул метана – СH4 при н.у.? 2. В каком объеме содержится 2,408·1017 атомов аргона Ar при н.у.? V Рефлексия и подведение итогов: Отмечаем наиболее активных учащихся в обсуждении теоретического материала урока (по жетонам), выборочно собираем тетради для оценивания работы на уроке учащихся при решении расчетных. VI. Домашнее задание: 1. п. 38(с.126-128); 2. Решить задачи по вариантам с 1-6(«Сборник задач и упражнений по химии» М.А. Рябов с.128) 1 вариант: 8.4(а); 8.5(а); 8.6(а) 2 вариант: 8.4(б); 8.5(б); 8.6(б) 3 вариант: 8.4(в); 8.5(в); 8.6(в) 4 вариант: 8.4(г); 8.5(г); 8.6(г) 5 вариант: 8.4(д); 8.5(д); 8.6(д) 6 вариант: 8.4(е); 8.5(е); 8.6(е) Закон Авогадро. Молярный объем.
|

Литература
1. Задачник по химии: 8 класс/ Кузнецова Н.Е., Лёвкин А.Н. – М.: Вентана-Граф, 2012.-128с.:ил
2. Сборник задач и упражнений по химии: 8 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс» /Рябов М.А.- М.: Издательство «экзамен», 2013. – 191с.
3. Олимпиада по химии 8 класс: Международный проект «Videouroki» - «Октябрь 2016»
4. Видеоурок «Молярный урок» 8 класс
5. Коллекция цифровых образовательных ресурсов
Взаимосвязь физических величин «Количество вещества, число частиц и постоянная Авогадро», «Масса, количество вещества и молярная масса».
Задание 1
Выберите только те элементы, которые образуют простые вещества, находящиеся в газообразном состоянии при н. у. Запишите названия этих элементов в сетку кроссворда таким образом, чтобы в выделенных клетках получилась фамилия учёного. Запишите эту фамилию в ответе одним словом, в именительном падеже, единственном числе, без каких-либо знаков препинания, например Ломоносов
Задание 1
Выберите только те элементы, которые образуют простые вещества, находящиеся в газообразном состоянии при н. у. Запишите названия этих элементов в сетку кроссворда таким образом, чтобы в выделенных клетках получилась фамилия учёного. Запишите эту фамилию в ответе одним словом, в именительном падеже, единственном числе, без каких-либо знаков препинания, например Ломоносов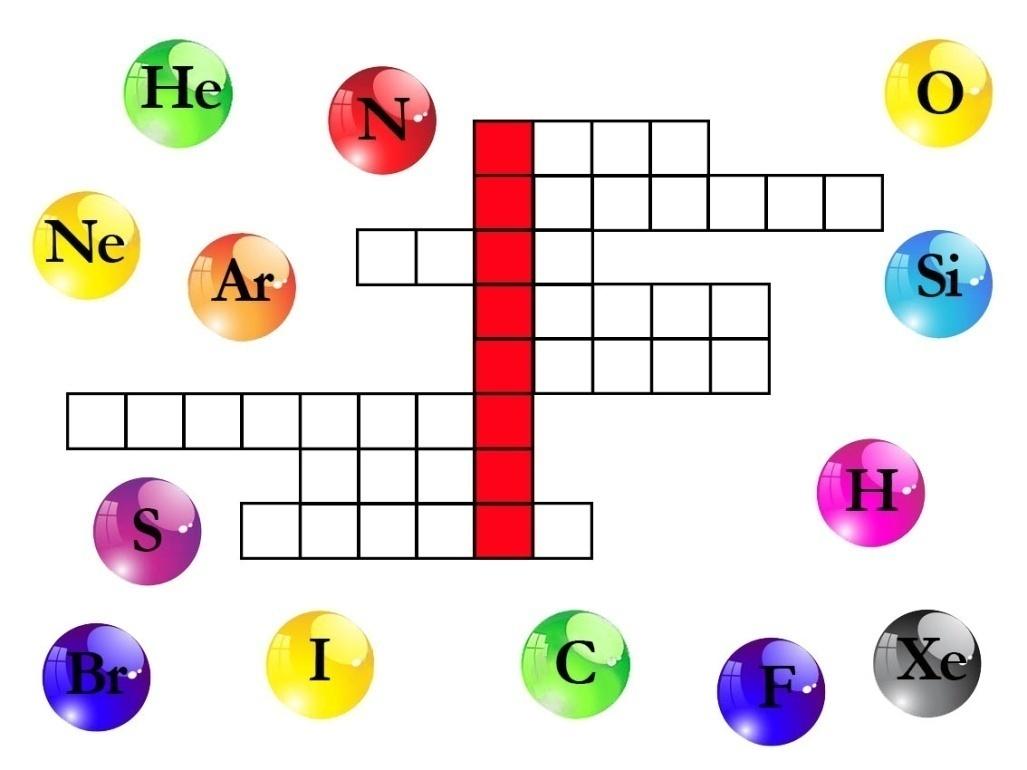
Тема урока: «Молярный объем газов»
Задача №1
Образец: Какой объем занимает 0,2 моль N2 при н.у.?
| Дано: Vm = 22, 4 л/моль ν (N2) = 0,2 моль | Решение: V = ν · Vm V (N2 ) = 0,2 моль · 22,4 л / моль = 4,48 л Ответ: V (N2 ) = 4,48 л |
| Найти: V(N2) - ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем занимают 6 моль О2 при н.у.?
2. Какой объем занимают 3,5 моль Н2 при н.у.?
Задача №2
Образец: Какое количество вещества содержит водород объемом 33,6 л при н.у.?
| Дано: Vm = 22, 4 л/моль V (H2) = 33,6 л | Решение: ν = V / Vm ν (Н2) = 33,6 л / 22,4 л/моль = 1,5 моль Ответ: ν (Н2) = 1,5 моль |
| Найти: ν (H2) - ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество вещества содержит углекислый газ объемом 67,2 л при н.у.?
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
| Дано: Vm = 22, 4 л/моль m (CO) = 56 г | Решение: V = ν · Vm ν = m/M M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν (СО) = 56 г / 28 г/моль = 2 моль V (CO ) = 2 моль · 22,4 л/моль = 44,8 л Ответ: V (CO ) = 44,8 л |
| Найти: V(CO ) - ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. Какой объем займут 16 г. газа О2 при н.у.?
2. Какой объем займут 64 г. газа SО2 при н.у.?
Задача №4
Образец: В каком объеме содержится 3·1023 молекул водорода Н2 при н.у.?
| Дано: Vm = 22, 4 л/моль N = 3·1023 молекул NА = 6,02·1023 моль-1 | Решение: V = ν · Vm ν = N / NА ν (Н2 ) = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль V (Н2 ) = 0,48 моль · 22,4 л/моль = 10,752 л Ответ: V (Н2 ) = 10,752 л |
| Найти: V(Н2 ) - ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
1. В каком объеме содержится 12,04 ·1023 молекул углекислого газа - СО2 при н.у.?
2. В каком объеме содержится 3,01·1023 молекул кислорода - О2 при н.у.?

 Получите свидетельство
Получите свидетельство Вход
Вход












 Молярный объем газов (1.15 MB)
Молярный объем газов (1.15 MB)
 0
0 1146
1146 74
74 Нравится
0
Нравится
0







