
Муниципальное бюджетное общеобразовательное учреждение
Погребская средняя общеобразовательная школа
Согласовано Утверждено
Заместитель директора по УВР Директор школы
____________ Т.Н.Стратий _____________ М.В. Цыганкова
Протокол МС №_______ Приказ № _______
от ______________2013 г. от ________________ 2013 г.
РАБОЧАЯ ПРОГРАММА
ХИМИЯ 8 КЛАСС
Учебник: «Химия. 8 класс: учебник для общеобразоват. учреждений/О.С. Габриелян – М.: Дрофа, 2013 г.
Программа курса химии для 8-11 классов общеобразовательных учреждений. – М.: Дрофа, 2009г.
2013-2014 учебный год
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа курса химии 8 класса разработана на основе Программы курса химии для 8-11 классов общеобразовательных учреждений ( автор О.С Габриелян, 2009), допущенной Министерством образования и науки Российской Федерации и государственного образовательного стандарта.
Рабочая программа дает распределение учебных часов по разделам курса и последовательность изучения тем и разделов химии с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Рассчитана на 105 часов (3 часа в неделю).
Контрольных работ - 6 часов
Практических работ – 9 часов
Форма итоговой аттестации – контрольная работа.
Цели и задачи рабочей программы:
Освоение системы знаний о фундаментальных законах, теориях, фактах химии, необходимых для понимания научной картины мира.
Овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов.
Развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями.
Воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде.
Применение полученных знаний и умений для безопасной работы с веществами в лаборатории, быту и на производстве; решения практических задач в повседневной жизни; предупреждения явлений, наносящих вред здоровью человека и окружающей среде; сознательного выбора профессии, связанной с химией.
Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования – атомах, изотопах, ионах, простых веществах и важнейших соединениях элемента (оксидах и других бинарных соединениях, кислотах, основаниях, солях), о строении вещества (типологии химических связей и видах кристаллических решеток), некоторых закономерностях протекания реакций и их классификации.
СОДЕРЖАНИЕ ОБУЧЕНИЯ
Введение (7 ч)
Химия- наука о веществах, их свойствах и превращениях.
Понятие о химическом элементе и формах его существования: свободных атомах, простых и сложных веществах.
Превращения веществ. Отличие химических реакций от физических явлений. Роль химии в жизни человека. Хемофилия и хемофобия.
Краткие сведения из истории возникновения и развития химии.
Период алхимии. Понятие о философском камне. Химия в XVI в. Развитие Химии на Руси. Роль отечественных ученых в становлении химической науки- работы М.В. Ломоносова, А.М. Бутлерова, Д.И. Менделеева.
Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительные атомная и молекулярная массы. Расчет массовой доли химического элемента по формуле вещества.
Периодическая система химических элементов Д.И. Менделеева, ее структура: малые и большие периоды, группы и подгруппы (главная и побочная). Периодическая система как справочное пособие для получения сведений о химических элементах.
Расчетные задачи.1. Нахождение относительной молекулярной массы вещества по его химической формуле.2. Вычисление массовой доли химического элемента в веществе по его формуле.
Тема 1
Атомы химических элементов (13ч)
Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов.
Опыты Резерфорда. Планетарная модель строения атома.
Состав атомных ядер: протоны и нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Изменение числа протонов в ядре атома- образование новых химических элементов.
Изменение числа нейтронов в ядре атома- образование изотопов. Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов №1-20 периодической системы Д.И. Менделеева. Понятие о завершенном и незавершенном электронном слое (энергетическом уровне).
Периодическая система химических элементов Д.И. Менделеева и строение атомов: физический смысл порядкового номера элемента номера группы, номера периода.
Изменение числа электронов на внешнем электронном уровне атома химического элемента- образование положительных и отрицательных ионов. Ионы, образованные атомами металлов и неметаллов. Причины изменения металлических и неметаллических свойств в периодах и группах.
Образование бинарных соединений. Понятие об ионной связи. Схемы образования ионной связи.
Взаимодействие атомов химических элементов-неметаллов между собой - образование двухатомных молекул простых веществ. Ковалентная неполярная химическая связь. Электронные и структурные формулы.
Взаимодействие атомов химических элементов-неметаллов между собой - образование металлических кристаллов. Понятие о металлической связи.
Демонстрации. Модели атомов химических элементов. Периодическая система химических элементов Д.И. Менделеева.
Тема 2
Простые вещества (9 ч)
Положение металлов и неметаллов в периодической системе химических элементов Д.И. Менделеева. Важнейшие простые вещества – металлы: железо, алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов.
Важнейшие простые вещества – неметаллы, образованные атомами кислорода, водорода, азота, фосфора, углерода. Явление аллотропии. Металлические и неметаллические свойства простых веществ. Относительность деления простых веществ на металлы и неметаллы.
Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Молярный объем газообразных веществ. Кратные единицы количества вещества – миллимоль и киломоль, миллимолярный и киломолярный объемы газообразных веществ.
Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Расчетные задачи. 1. Вычисление молярной массы веществ по химическим формулам. 2. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Демонстрации. Получение озона. Образцы белого и серого олова, белого и красного фосфора. Некоторые металлы и неметаллы количеством вещества
1 моль.
Тема 3
Соединения химических элементов (16 ч)
Степень окисления. Определение степени окисления элементов по химической формуле соединения. Составление формул бинарных соединений, общий способ их называния. Бинарные соединения: оксиды, хлориды, сульфиды и др. Составление их формул. Представители оксидов: вода, углекислый газ и негашеная известь. Представители летучих водородных соединений.
Основания, их состав и названия. Таблица растворимости гидроксидов и солей в воде. Представители щелочей: гидроксиды натрия, калия и кальция. Понятие о качественных реакциях. Индикаторы.
Кислоты, их состав и названия. Классификация кислот: серная, соляная и азотная. Изменение окраски индикаторов в кислотной среде.
Соли как производные кислот и оснований. Их состав и названия. Растворимость солей в воде. Представители солей: хлорид натрия, карбонат и фосфат кальция.
Аморфные и кристаллические вещества.
Межмолекулярные взаимодействия. Типы кристаллических решеток: ионная, атомная, молекулярная и металлическая. Зависимость свойств веществ от типов кристаллических решеток.
Вещества молекулярного и немолекулярного строения. Закон постоянства состава для веществ молекулярного строения.
Чистые вещества и смеси. Примеры жидких, твердых и газообразных смесей. Свойства чистых веществ и смесей. Их состав. Массовая и объемная доли компонента смеси. Расчеты, связанные с использованием понятия «доля».
Расчетные задачи. 1. Расчет массовой и объемной долей компонентов смеси веществ. 2. Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе растворителя. 3. Вычисление массы растворяемого вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества.
Демонстрации. Образцы оксидов, кислот, оснований и солей. Модели кристаллических решеток хлорида натрия, алмаза, графита. Способы разделения смесей. Дистилляция воды.
Лабораторные опыты. 1. Знакомство с образцами веществ разных классов. 2. Разделение смесей.
Тема 4
Изменения, происходящие с веществами (13 ч)
Понятие явлений как изменений, происходящих с веществами. Явления, связанные с изменением кристаллического строения вещества при постоянном его составе, - физические явления. Физические явления в химии: дистилляция, кристаллизация, выпаривание и возгонка веществ, центрифугирование.
Явления, связанные с изменением состава вещества, - химические реакции. Признаки и условия протекания химических реакций. Понятие об экзо- и эндотермических реакциях. Реакции горения как частный случай экзотермических реакций, протекающих с выделением света.
Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление уравнений химических реакций.
Расчеты по химическим уравнениям. Решение задач на нахождение количества вещества, массы или объема продукта реакции по количеству вещества, массе или объему исходного вещества. Расчеты с использованием понятия «доля», когда исходное вещество дано в виде раствора с заданной массовой долей растворенного вещества или содержит определенную долю примесей.
Реакции разложения. Понятие о скорости химических реакций. Катализаторы. Ферменты.
Реакции соединения. Каталитические и некаталитические реакции. Обратимые и необратимые реакции.
Реакции замещения. Электрохимический ряд напряжений металлов, его использование для прогнозирования возможности протекания реакций между металлами и растворами кислот. Реакции вытеснения одних металлов из растворов их солей другими металлами.
Реакции обмена. Реакции нейтрализации. Условия протекания реакций обмена в растворах до конца.
Типы химических реакций (по признаку «число и состав исходных веществ и продуктов реакции») на примере свойств воды. Реакция разложения воды. Реакция соединения – взаимодействие воды с оксидами металлов и неметаллов. Понятие «гидроксиды». Реакции замещения – взаимодействие воды с щелочными металлами. Реакции обмена на примере гидролиза сульфида алюминия и карбида кальция.
Расчетные задачи. 1. Вычисление по химическим уравнениям массы и количества вещества по известной массе или количеству вещества одного из вступающих в реакцию веществ или продуктов реакции. 2. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей. 3. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса раствора и массовая доля растворенного вещества.
Демонстрации. Примеры физических явлений: а) плавление парафина; б) возгонка иода или бензойной кислоты; в) растворение перманганата калия; г) диффузия душистых веществ с горящей лампочки накаливания. Примеры химических явлений: а) горение магния, фосфора; б) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди (II); г) растворение полученного гидроксида в кислоте; д) взаимодействие оксида меди (II) с серной кислотой при нагревании; е) разложение перманганата калия; ж) взаимодействие разбавленных кислот с металлами; з) разложение пероксида водорода; и) электролиз воды.
Лабораторные опыты. 3. Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. 4. Окисление меди в пламени спиртовки или горелки. 5. Помутнение известковой воды от выдыхаемого углекислого газа. 6. Получение углекислого газа взаимодействием соды и кислоты. 7. Замещение меди в растворе хлорида меди (II) железом.
Тема 5
Простейшие операции с веществом (5 ч)
1. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами.
2. Наблюдения за изменениями, происходящими с горящей свечой, и их описание. 3. Анализ почвы и воды. 4. Признаки химических реакций.
5. Приготовление раствора сахара и определение массовой доли его в растворе.
Тема 6
Растворение. Растворы. Свойства растворов электролитов (26 ч)
Растворение как физико-химический процесс. Понятие о гидратах и кристаллогидратах. Растворимость. Насыщенные, ненасыщенные, пересыщенные растворы.
Понятие об электролитической диссоциации. Механизм диссоциации электролитов с различным типом химической связи. Степень электролитической диссоциации.
Кислоты, их классификация. Диссоциация кислот и их свойства в свете теории электролитической диссоциации. Взаимодействие кислот с металлами. Электрохимический ряд напряжений металлов. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями, солями. Использование таблицы растворимости для характеристики химических свойств кислот.
Основания, их классификация. Диссоциация оснований и их свойства в свете теории электролитической диссоциации. Взаимодействие оснований с кислотами, кислотными оксидами и солями. Использование таблицы растворимости для характеристики химических свойств оснований.
Соли, их классификация и диссоциация различных типов солей. Свойства солей в свете теории электролитической диссоциации. Взаимодействие солей с кислотами, основаниями и солями. Использование таблицы растворимости для характеристики химических свойств солей.
Обобщение сведений об оксидах, их классификации и химических свойствах.
Генетические ряды металлов и неметаллов. Генетическая связь между классами неорганических веществ.
Окислительно-восстановительные реакции.
Реакции ионного обмена и окислительно-восстановительные реакции. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Демонстрации. Испытание веществ и их растворов на электропроводность. Движение окрашенных ионов в электрическом поле. Зависимость электропроводности уксусной кислоты от концентрации. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II). Горение магния. Взаимодействие хлорной и сероводородной воды.
Лабораторные опыты. 8. Реакции, характерные для растворов кислот (соляной или серной). 9. Реакции, характерные для растворов щелочей (гидроксидов натрия или калия). 10. Получение и свойства нерастворимого основания, например гидроксида меди (II). 11. Реакции, характерные для растворов солей.
12. Реакции, характерные для основных оксидов. 13. Реакции, характерные для кислотных оксидов.
Тема 7
Практикум №2
Свойства растворов электролитов (4ч)
6. Ионные реакции. 7. Условия протекания химических реакций между растворами электролитов до конца. 8. Свойства кислот, оснований, оксидов и солей. 9. Решение экспериментальных задач.
Тема 8
Портретная галерея великих химиков (6 ч)
Повторение материала 8 класса – основных понятий, законов и теорий через знакомство с жизнью и деятельностью ученых, осуществивших их открытие.
Тема 9
Учебные экскурсии (3ч)
Экскурсия в аптеку, на хлебокомбинат.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ОБУЧАЮЩИХСЯ
В результате изучения химии ученик должен
знать/понимать:
· химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
· важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
· основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь:
· называть: химические элементы, соединения изученных классов;
· объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов
в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
· характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
· определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
· составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И. Менделеева; уравнения химических реакций;
· обращаться с химической посудой и лабораторным оборудованием;
· распознавать опытным путем: кислород, водород, углекислый газ; растворы кислот и щелочей, карбонат-ионы;
· вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической
деятельности и повседневной жизни для:
· безопасного обращения с веществами и материалами;
· экологически грамотного поведения в окружающей среде;
· оценки влияния химического загрязнения окружающей среды на организм человека;
· критической оценки информации о веществах, используемых в быту;
· приготовления растворов заданной концентрации.
РАЗВЕРНУТЫЙ ТЕМАТИЧЕСКИЙ ПЛАН
по учебнику О.С. Габриеляна 8 класс (3 часа в неделю - 105 часов)
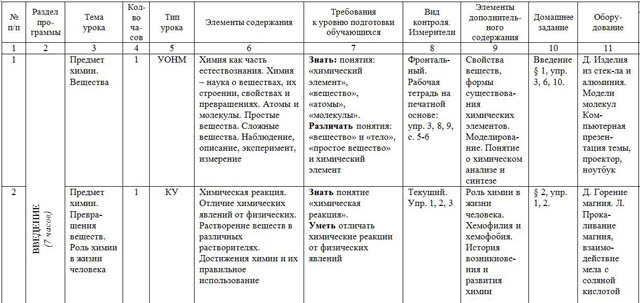
| № п/п | Раздел про- граммы | Тема урока | Кол- во ча-сов | Тип урока | Элементы содержания | Требования к уровню подготовки обучающихся | Вид контроля. Измерители | Элементы дополнитель- ного содержания | Домашнее задание | Обору-дование | Дата |
| план | факт |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 1 | ВВЕДЕНИЕ (7 часов) | Предмет химии. Вещества | 1 | УОНМ | Химия как часть естествознания. Химия – наука о веществах, их строении, свойствах и превращениях. Атомы и молекулы. Простые вещества. Сложные вещества. Наблюдение, описание, эксперимент, измерение | Знать: понятия: «химический элемент», «вещество», «атомы», «молекулы». Различать понятия: «вещество» и «тело», «простое вещество» и химический элемент | Фронталь-ный. Рабочая тетрадь на печатной основе: упр. 3, 8, 9, с. 5-6 | Свойства веществ, формы существова-ния химических элементов. Моделирова-ние. Понятие о химическом анализе и синтезе | Введение § 1, упр. 3, 6, 10. | Д. Изделия из стек-ла и алюминия. Модели молекул Ком-пьютерная презен-тация темы, проектор, ноутбук |
|
|
| 2 | Предмет химии. Превра-щения веществ. Роль химии в жизни человека | 1 | КУ | Химическая реакция. Отличие химических явлений от физических. Растворение веществ в различных растворителях. Достижения химии и их правильное использование | Знать понятие «химическая реакция». Уметь отличать химические реакции от физических явлений | Текущий. Упр. 1, 2, 3 | Роль химии в жизни человека. Хемофилия и хемофобия. История возникнове-ния и развития химии | § 2, упр. 1, 2. | Д. Горение магния. Л. Прока-ливание магния, взаимо-действие мела с соляной кислотой |
|
|
| 3 | ВВЕДЕНИЕ (7 часов) | Краткие сведения по истории развития химии. Основопо ложники отечественной химии | 1 | КУ | История возникновения и развития химии. Роль отечественных ученых в становлении химической науки. Основные законы химии | Знать Основоположников отечественной химии | Текущий.
|
| § 3, упр. 1, 5 | Портреты ученых химиков |
|
|
| 4 | Знаки (символы) химичес ких элементов | 1 | УОНМ | Химический элемент. Язык химии. Знаки химических элементов. Обозначение химических элементов, их названия. Деление химических элементов на металлы и неметаллы. Происхождение названий химических элементов | Знать Обозначение, произношение и названия химических элементов Уметь Записывать символы элементов по названиям и наоборот | Химичес кий диктант | Происхожде-ние названий знаков химических элементов | § 4 до слов: «Каждому химическому элементу отведено в таблице Д.И. Менделеева …» табл. 1, упр. 1,4. | Таблица «Пери-одическая система химиче-ских элементов Менде-леева» |
|
|
| 5 | Перио-дическая система химичес-ких элемен-тов. Знаки химичес-ких эле-ментов | 1 | КУ | Общее знакомство со структурой Периодической таблицы: периоды и группы. Периодическая таблица как справочное пособие для получения сведений о химических элементах | Знать знаки первых 20 химических элементов. Уметь: - определять положение химического элемента в Периодической системе; - называть химические элементы | Фрон-тальный. Таблица 1, с. 32 | Происхожде-ние названий знаков химических элементов | § 4, упр. 5
| Таблица «Пери-одическая система химиче-ских элементов Менде-леева» |
|
|
| 6-7 | Химиче-ские формулы. Относи-тельная атомная масса и молеку-лярная масса | 2 | КУ | Химические формулы. Закон постоянства состава. Качественный и количественный состав вещества. Вычисление относительной молекулярной массы вещества по формуле. Вычисление массовой доли элемента в химическом соединении | Знать: - определение химической формулы вещества; - формулировку закона постоянства состава. Понимать и записывать химические формулы веществ. Уметь: - определять состав веществ по химической формуле; - принадлежность к простым и сложным веществам
| Текущий Упр. 3-6 | Атомная единица массы | § 5, упр. 1, 2, 8.
| ПСХЭ |
|
|
| 8 | АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (13 часов) | Основные сведения о строении атомов | 1 | УОНМ | Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Характеристика нуклонов. Взаимосвязь понятий: протон, нейтрон, массовое число. Строение атома. Ядро (протоны, нейтроны, электроны)
| Уметь объяснять физический смысл атомного номера | Текущий. Упр. 3, 5, с. 43 | Доказательст-ва сложности строения атомов. Опыты Резерфорда | § 6. упр. 3, 5 | Слайд-лекция, ПК, проектор. Модели атомов |
|
|
| 9 | Изотопы как разновид-ности атомов химичес-кого элемента | 1 | КУ | Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента. Изменение числа протонов в ядре – образование новых химических элементов.
| Знать определение понятий «химический элемент», «изотопы» | Фрон-тальный. Для закрепле-ния темы: упр. 1-4 | Ядерные процессы | § 7, упр. 1-3.
| ПСХЭ |
|
|
| 10 | АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (13 часов) | Электро-ны. Строение электрон-ных оболочек атомов химичес-ких элементов № 1-20 | 1 | КУ | Характеристика электронов. Строение электронных оболочек атомов 1-20 элементов ПСХЭ Д.И. Менделеева. Понятие о завершенном и незавершенном электронных уровнях | Уметь: - объяснять физический смысл атомного номера, номеров группы и периода; - составлять схемы строения атомов 1-20 элементов
| Устный. Упр. 1, 2 | Особенности больших периодов | § 8, упр. 3-5
| ПСХЭ |
|
|
| 11 | Периоди-ческая система химичес-ких элементов и строение атомов | 1 | УПЗУ | Периодический закон и Периодическая система химических элементов. Группы и периоды. Строение атома. Простые вещества (Ме и НеМе) | Уметь объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп
| Текущий, Упр. 3, 4, 5, с. 53. Таблица, с. 55 | Причины изменения свойств химических элементов в периодах и группах | § 9 упр. 1 | ПСХЭ |
|
|
| 12-13 | Ионная химическаясвязь | 2 | КУ | Понятие иона. Ионы, образованные атомами металлов и неметаллов. Ионная химическая связь. схемы образования ионных соединений | Знать: - понятие «ионы», «химическая связь»; - определять тип химической связи в соединениях
| Текущий. Упр. 2.
| Водородная связь | § 9, упр. 3.
| Таблицы, компью-терная презен-тация темы, ноутбук |
|
|
| 14 | Ковалент-ная непо-лярная хи-мическая связь | 1 | КУ | Схема образования двухатомных молекул (Н2, Сl2, S2, N2). Электронные и структурные формулы. Ковалентная неполярная химическая связь | Уметь определять тип химической связи в соединениях | Текущий. Упр. 1, 2, 3, | Кратность связи, длина связи. Элек-тронные и структурные формулы | § 10, упр. 1-5. | Таблицы, компью-терная презен-тация темы |
|
|
| 15-16 | АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (13 часов) | Ковалент-ная поляр-ная хими-ческая связь | 2 | КУ | Схемы оборазования молекул соединений (НCl, H2O, NH3 и др.) Ковалентная полярная химическая связь. Электронные и структурные формулы. Понятие об ЭО и ковалентной полярной химической связи.
| Уметь определять тип химической связи в соединениях | Текущий. Упр. 1, 2, 3, 4. Таблица в рабочей тетради, с. 35 | Электроотрицательность | § 11, упр. 1 -4. | Таблицы, компью-терная презен-тация темы, ПК |
|
|
| 17 | Металли-ческая связь | 1 | КУ | Понятие о металлической связи. Относительность деления химической связи на виды
| Уметь определять тип химической связи в соединениях | Текущий. Упр. 1, 3. |
| § 12, упр. 1, 3.
| Таблицы, модели атомов Ме |
|
|
| 18-19 | Обобще-ние и системати-зация знаний по теме «Атомы химичес-ких эле-ментов» | 2 | УПЗУ | Периодический закон и строение атомов. Типы химической связи
| Уметь: - объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; - определять тип химической связи в соединениях | Тематичес-кий | Водородная связь |
| Таблицы, компью-терная презен-тация темы, ПК |
|
|
| 20 | Конт-рольная работа 1. Атомы химичес-ких элементов. | 1 | К | Периодический закон и строение атомов. Типы химической связи
|
| Контроль-ная работа №1 |
|
| ДМ, карточки-задания |
|
|
| 21 | ПРОСТЫЕ ВЕЩЕСТВА (9 часов) | Простые вещества- металлы | 1 | КУ | Простые вещества – металлы. Характеристика положения элементов-металлов в Периодической системе. Строение атомов металлов. Металлическая связь; физические свойства металлов-простых веществ. | Уметь: - характеризовать химические элементы на основе положения в Периодической системе и особенностей строения их атомов; - объяснять связь между составом, строением и свойствами веществ | Текущий. Упр. 1-3 |
| § 13, упр. 1-4.
| Д. Коллек-ция металлов |
|
|
| 22 | Простые вещества – неметаллы | 1 | КУ | Простые вещества – неметаллы. Положение элементов-неметаллов в Периодической системе. Строение их атомов. Ковалентная связь. Физические свойства неметаллов- простых веществ. Химические формулы. Расчет относительной молекулярной массы. | Текущий. Упр. 3 |
| § 14, упр. 3.
| Образцы неметаллов |
|
|
| 23 | Аллотро- пия | 1 | УОНМ | Понятие аллотропии на примере модификаций кислорода. Аллотропия фосфора, углерода, олова. Относительность понятий «металлические» и «неметаллические» свойства | Знать понятие аллотропия, причины существования аллотропных модификаций простых веществ | Текущий |
| § 14 до конца, упр. 4
| Д. Получение и свойства белого и красного фосфора, белого и серого олова. |
|
|
| 24 | Количест-во вещества. Моль. | 1 | УОНМ | Количество вещества и единицы ее измерения: моль, моль, кмоль | Знать понятияе «моль» Уметь вычислять количество вещества, массу по количеству вещества | Упр. 2 (а, б), 3 (а, б).
| Постоянная Авогадро, киломоль, миллимоль | § 15, упр. 2 (в,г), 3 (в). | Д. Хими-ческие соединения количес-твом вещества 1 моль
|
|
|
|
25 | Молярная масса вещества | 1 | УОНМ | Расчет молярных масс веществ по их формулам. Миллимолярная и киломолярная массы. Выполнение упражнений с использованием понятий «постоянная Авогадро», «количество вещества», «масса», «молярная масса» | Знать понятие «молярная масса». Уметь вычислять количество вещества, массу по количеству вещества | провероч ная работа по карточкам |
| § 15 до конца |
|
|
|
| 26 | Молярный объем газообразных веществ | 1 | УОП | Понятие о молярном объеме газов. Нормальные условия. Миллимолярный и киломолярный объем. Выполнение упражнений с использованием понятий «объем», «молярный объем», «масса», «количество вещества», «молярная масса» | Знать понятие «молярный объем». Уметь вычислять объем по количеству вещества или массе | Текущий. Упр. 1 (а), 2 (а, в), 4, 5 | Миллимоляр-ный и киломоляр-ный объемы газов | § 16, упр. 1 (б), 2 (б,г), 4, 5.
|
|
|
|
| 27 | Урок-упражне ние. Решение задач по формуле | 1 | УПП | Количество вещества. Молярная масса. Молярный объем. Решение задач и упражнений с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро» | Знать изученные понятия. Уметь производить вычисления | Письмен-ный.
|
| § 15, 16.
| Таблицы с формулами
|
|
|
| 28 | ПРОСТЫЕ ВЕЩЕСТВА (9 часов) | Обобщение и систематизация знаний по теме «Простые вещества» | 1 | УПЗУ | Количество вещества. Молярная масса. Молярный объем. Решение задач и упражнений, подготовка к контрольной работе | Знать понятия «моль», «молярная масса», «молярный объем». Уметь вычислять количество вещества, массу, объем по количеству вещества, массе, объему | Тематичес-кий |
| Повторить § 13-16 | ДМ |
|
|
| 29 | Контроль-ная работа 2. Простые вещества | 1 | К | Количество вещества. Молярная масса. Молярный объем | Знать понятия «моль», «молярная масса», «молярный объем». Уметь вычислять количество вещества, массу, объем по известному количеству вещества, массе, объему | Кон-трольная работа 2 |
|
| ДМ, карточки-задания |
|
|
| 30 | СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (16 часов) | Степень окисления. | 1 | УИНМ | Понятие о степени окисления. Составление формул по степени окисления элементов. Определение степени окисления элементов по формулам химических соединений | Уметь: - определять степень окисления элемента в соединении;
| Текущий. Упр. 1, 2, 4 |
| § 17, упр. 2, 5, 6.
| ПСХЭ |
|
|
| 31 | Бинарные соединения металлов и неметаллов | 1 | УОНМ | Составление формул бинарных соединений, общий способ их названий | Уметь: - определять степень окисления элемента в соединении; - называть бинарные соединения | Письменный |
| § 17 до конца упр. 3. | ПСХЭ |
|
|
| 32 | Оксиды. Летучие водород-ные соединения | 1 | КУ | Составление формул, их названия. Расчеты по формулам. Характеристика важнейших соединений. Представители их: Н2О, СО2, СаО, НСl, NH3 | Уметь: - называть оксиды, - определять состав вещества по их формулам, степень окисления | Текущий. Упр. 1, 5.
| Гидриды | § 18, упр. 1, 4, 5.
| Д. Образцы оксидов. Взаимодействие оксида магния с кислотами |
|
|
| 33 | СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (16 часов) | Основания | 1 | КУ | Основания. Состав и названия оснований, их классификация. Ионы. Катионы и анионы. Определение характера среды. Индикаторы. Расчеты по формулам оснований. Представители: NaOH, KOH, Ca(OH)2 | Уметь: - называть основания; - определять состав вещества по их формулам, степень окисления; - распознавать опытным путем растворы щелочей | Текущий. Упр. 2, 3, 4; таблица 4. |
| § 19, упр. 1,5,6 | Д. Образцы оснований. Получение осадков нераствори-мых гидрок-сидов. Взаи-модействие углекислого газа с известковой водой |
|
|
| 34 | Кислоты | 1 | КУ | Кислоты. Определение характера среды. Индикаторы. Состав и названия кислот. Их классификация. Расчеты по формулам. Представители кислот: HCl, H2SO4, H2CO3 | Знать формулы кислот. Уметь: - называть кислоты; - определять степень окисления элемента в соединении; - распознавать опытным путем растворы кислот | Работа с ДМ. Упр. 1,3; таблица 5, |
| § 20, упр. 2, 4, 5, таблица 5. | Д. Образцы кислот, нейтрализа-ция щелочи кислотой в присутствии индикато-ров. Л. Знакомство с образцами в-в разных классов |
|
|
| 35-36 | Соли как производные кислот и оснований | 2 | КУ | Соли. Составление формул по степени окисления. Состав и названия солей. Представители солей. | Уметь называть соли; составлять формулы солей | Работа с ДМ. |
| § 21, упр. 1, 2, 3.
| Д. Образцы солей. Таблица раствори-мости |
|
|
| 37 | Урок-упражне ние | 1 | УПЗУ | Основные классы неорганических соединений. Классификация сложных веществ, определение принадлежности соединений к различным классам по их формулам. Упражнения в составлении формул по названиям и названий веществ по формулам. Расчеты по формулам соединений | Знать формулы оксидов, кислот, оснований, солей. Уметь: - называть соедине-ния изученных классов; - определять принадлежность вещества к определенному классу; - составлять формулы веществ | Обобщаю-щий |
| § 18-21. упр. 1-2, с. 73 |
|
|
|
| 38 | СОЕДИНЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (16 часов) | Аморфные и кристал-лические вещества | 1 | УИНМ | Вещества в твердом, жидком и газообразном состоянии. Кристаллические и аморфные вещества. Закон постоянства состава веществ. Свойства веществ с разным типом кристаллических решеток, их принадлежность к разным классам соединений. | Знать классификацию веществ. Уметь использовать знания для критической оценки информации о веществах, применяемых в быту | Текущий. Упр. 1, 2 | Типы кристалли-ческих решеток (атомная, молекулярная, ионная и металличес-кая) | § 22, упр. 3-5 | Таблица «Кристалл-лические решетки», модели кристалли-ческих решеток. Д. Возгонка йода |
|
|
| 39 | Чистые вещества и смеси | 1 | КУ | Чистые вещества и смеси веществ. Понятия о чистом веществе и смеси, их отличия. Примеры жидких и газообразных смесей. Способы разделения смесей. | Уметь использовать знания для критической оценки информации о веществах, применяемых в быту | Текущий. Упр. 1, 2 | Природные смеси: воздух, природный газ, нефть, природные воды | § 23. упр. 1-4, | Д. Примеры чистых веществ и смесей. Л. «Разделение смесей» (сера, железные стружки, вода, магнит) |
|
|
| 40-42 | Массовая и объемная доля компонен-тов смеси, в том числе и доля примесей | 3 | КУ | Понятие о доле компонента в смеси. Вычисление ее в смеси и расчет массы или объема вещества в смеси по его доле. Массовая доля растворенного вещества | Уметь вычислять массовую долю вещества в растворе, вычислять m, V, v продукта реакции по m, V, v исходного вещества, содержащего примеси | Текущий. Упр. 2.
| Объемная доля | § 24, упр. 3- 5
| Таблицы |
|
|
| 43 | Расчеты, связанные с понятием «доля» (ω, φ) | 1 | УПЗУ | Решение задач и упражнений на расчет доли (массовой или объемной) и нахождение массы (объема) компонента смеси | Уметь вычислять массовую (объемную) долю компонента в смеси | письменная работа |
| § 24, упр. 6-7 |
|
|
|
| 44 | Обобщение и системати зация знаний по теме | 1 | УПЗУ | Решение задач и упражнений. Подготовка к контрольной работе | Знать формулы оксидов, кислот, оснований, солей. Уметь: - называть соедине-ния изученных классов; - определять принадлежность вещества к определенному классу; - составлять формулы веществ | письменный |
| повторить § 17- § 24
|
|
|
|
| 45 | Контрольная работа № 3 по теме «Классы химических соедине ний. Расчеты по химичес ким формулам» | 1 | К |
| Знать формулы оксидов, кислот, оснований, солей. Уметь: - называть соедине-ния изученных классов; - определять принадлежность вещества к определенному классу; - составлять формулы веществ; - проводить расчеты по химическим формулам. | Кон-трольная работа 3 |
| Повто-рить § 17-24 | ДМ, карточки-задания |
|
|
|
46 | ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ (13 часов) | Физичес кие явления | 1 | УОНМ | Способы очистки веществ, основанные на их физических свойствах. Очистка питьевой воды. Перегонка нефти | Знать способы очистки веществ, основанные на их физических свойствах | Текущий |
| § 25 упр. 2-4 | Д. Плавление парафина. Диффузия пахучих веществ Л. Сравнение скорости испарения капель воды и спирта с фильтрова льной бумаги |
|
|
| 47-48 | Химичес кие реакции | 2 | КУ | Понятие о химических явлениях, их отличия от физических. Химическая реакция. Условия и признаки химических реакций. Классификация химических реакций по поглощению или выделению энергии | Знать понятия «химическая реакция», «классификация химических реакций» | Текущий. Упр. 1-3 |
| § 26, упр. 3-5.
| Слайд-лекция, ПК, проектор. Д. примеры химических реакций |
|
|
| 49 | Закон сохранения массы веществ. Химичес-кие уравнения | 1 | КУ | Количественная сторона химических реакций в свете учения об атомах и молекулах. Сохранение массы веществ при химических реакциях. Уравнение и схема химической реакции | Знать закон сохранения массы веществ | Текущий, работа с ДМ. |
| § 27. упр. 1 | ДМ
|
|
|
| 50 | Реакции разложения | 1 | КУ | Сущность реакций разложения. Реакции разложения. Получение кислорода. Составление уравнений реакций, проделанных учителем | Уметь составлять уравнения химических реакций | Текущий. Упр. 1, 4 | Понятие о скорости химических реакций. Катализаторы. Ферменты | § 27 – реакции разложения | Д. Разложение перманга-ната калия
|
|
|
| 51 | ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ (13 часов) | Реакции соединения | 1 | КУ | Сущность реакций соединения. Составление уравнений реакций, проделанных учителем | Уметь: - составлять уравнения химических реакций; - определять тип химической реакции | Текущий. Упр. 1-3 | Каталитичес-кие и некаталитические реакции, обратимые и необратимые реакции | § 27- реакции соединения | Д. Горение магния Л. Окисление меди в пламени спиртовки |
|
|
| 52 | Реакции замещения | 1 | КУ | Реакции замещения. Общие химические свойства металлов: реакции с кислотами, солями. Ряд напряжений металлов. Составление уравнений реакций, проделанных учителем | Уметь: - составлять уравнения химических реакций; - характеризовать химические свойства металлов (взаимодействие с кислотами, солями) | Работа с ДМ. |
| § 27- реакции замещения | Л. Взаимодей-ствие железа с сульфатом меди (II)
|
|
|
| 53 | Реакции обмена | 1 | КУ | Сущность реакций обмена. Составление уравнений реакций, проделанных учителем. Реакции нейтрализации. Условия течения реакций между растворами кислот, щелочей и солей до конца | Уметь: - составлять уравнения химических реакций; - характеризовать химические свойства металлов (взаимодействие с кислотами, солями) | Текущий. упр. 1, 3, 4.
|
| § 27-реакции обмена, упр. 3- 4, 5.
| Д. Нейтрали-зация щелочи кислотой в присутствии индикатора Л. Помутнение известковой воды от выдыхаемо го СО2. Л.Получе- ние СО2 взаимодействием соды и кислоты |
|
|
| 54-55 | Расчеты по химичес-ким уравнениям | 2 | УОП | Вычисления по химическим уравнениям массы, объема или количества одного из продуктов реакции по массе исходного вещества | Уметь вычислять количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции | Текущий. § 28, упр. 3. § 27, упр. 4. |
| § 28, упр. 2, 4. | Задачники
|
|
|
| 56-57 | ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ С ВЕЩЕСТВАМИ (13 часов) | Обобщение и система-тизация знаний по теме «Типы химичес-ких реакций» | 2 | УПЗУ | Простые и сложные вещества. Основные классы неорганических веществ. Химические реакции, классификация химических реакций по числу и составу исходных и полученных веществ. Уравнения химических реакций | Уметь: - составлять формулы веществ, уравнения химических реакций; - определять тип химической реакции; - решать расчетные задачи на установление простейшей формулы вещества по массовым долям элементов | Тематичес-кий |
| Повто-рить § 27 |
|
|
|
| 58 | Контроль-ная работа 4. «Типы химических реакций. Расчеты по химичес- ким урав- нениям» | 1 | К | Типы химических реакций. Химические реакции. Уравнения химических реакций |
| Контроль-ная работа 4 |
| Повто-рить § 27 | ДМ, карточки-задания |
|
|
| 59 | ПРОСТЕЙШИЕ ОПЕРАЦИИ С ВЕЩЕСТВОМ (5 часов) | Практическая работа №1 «Правила по ТБ при работе в химическом кабинете. Приемы обращения с нагревательными прибора ми» | 1 | П.р. | Правила по технике безопасности при работе в химическом кабинете. Приемы обращения с нагревательными приборами и лабораторным оборудованием | Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием | Практичес-кая работа №1 |
| П.р. №2 | Химическая посуда и оборудование |
|
|
| 60 | Практическая работа №2 «Наблюдения за изменениями, происходящими с горящей свечой, и их описание» | 1 | П.р. | Правила по технике безопасности при работе в химическом кабинете. Формирование важнейшего метода познания химических явлений – наблюдения. Формировать приемы проведения качественных реакций по обнаружению продуктов горения свечи… | Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием | Практичес-кая работа №2 |
| П.р. №3 | Химическая посуда и оборудование |
|
|
| 61 | Практическая работа №3 «Анализ почвы и воды» | 1 | П.р. | Правила по технике безопасности при работе в химическом кабинете. Получение почвенной вытяжки и опыты с ней
| Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
| Практичес-кая работа №3 |
| П.р. №4 | Химическая посуда и оборудование |
|
|
| 62 | Практическая работа №4 «Признаки химичес ких реакций» | 1 | П.р. | Правила по технике безопасности при работе в химическом кабинете. Закрепление на практике знание признаков химических реакций. Запись уравнений проделанных реакций и определение их типа.
| Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
| Практичес-кая работа №4 |
| П.р. №5 | Химическая посуда и оборудование |
|
|
| 63 | Практи-ческая работа №5. Приготов-ление раствора сахара с заданной массовой долей растворен-ного вещества | 1 | Практи-ческая работа | Взвешивание. Приготовление растворов | Уметь обращаться с химической посудой и оборудованием | Практичес-кая работа 5 |
|
| Вода, сахар, весы, мерный цилиндр, стеклянная палочка, весы |
|
|
| 64 | РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ (26 часов) | Растворе-ние как физико-химичес-кий процесс. | 1 | УОНМ | Растворы. Гидраты. Кристаллогидраты. Тепловые явления при растворении. | Знать понятия «растворы», «гидраты», «кристаллогидраты», | Текущий. Упр. 2 | Физическая и химическая теория растворов. Гидраты и кристалло-гидраты.
| § 34, упр. 2.
| ПСХЭ, таблица раствори-мости |
|
|
| 65 | Растворимость. Типы растворов. | 1 | УОНМ | Зависимость растворимости веществ от температуры. Кривые растворимости. Ненасыщенные, Насыщенные и пересыщенные растворы. Различная растворимость веществ в воде | Знать классификацию веществ по растворимости | Текущий | Насыщенные, ненасыщен-ные и перенасы-щенные растворы
|
| таблица раствори-мости |
|
|
| 66-67 | Электроли-тическая диссоциа ция | 2 | КУ | Электролиты и неэлектролиты. Механизм диссоциации веществ с разным видом связи. Степень электролитической диссоциации. Сильные и слабые электролиты | Знать понятия «электролиты» и «неэлектролиты», «электролитическая диссоциация» | Текущий. Упр. 1-2 | Механизм ЭД, степень ЭД, сильные и слабые электролиты | § 35, упр. 3-6.
| ПСХЭ, таблица раствори-мости
|
|
|
| 68 | Основные положения теории ЭД | 1 | КУ | Электролитическая диссоциация кислот, щелочей и солей в водных растворах. Ионы. Свойства ионов. Катионы и Анионы | Знать понятия «ион», «электролитическая диссоциация» | Фронталь-ный. Упр. 2-3 | Ионы простые и сложные, гидратиро-ванные и негидратиро-ванные | § 36, упр. 4, 5.
| Портреты Аррениуса и Менделеева |
|
|
| 69-70 | Ионные уравнения реакций | 2 | КУ | Реакции ионного обмена, идущие до конца. Запись уравнений реакций (молекулярных и ионных) с использованием таблицы растворимости | Уметь: - составлять уравнения реакций; - определять возможность протекания реакций ионного обмена; - объяснять сущность реакций ионного обмена | Работа с ДМ. Упр. 1
| Реакция нейтрализа-ции | § 37, упр. 2-5.
|
|
|
|
| 71-72 | Кислоты в свете ТЭД, их классифи-кация, свойства | 2 | КУ | Кислоты. Электролитическая диссоциация кислот. Реакции ионного обмена. Определение характера среды. Индикаторы. Ряд напряжений металлов | Знать формулы кислот. Уметь: - называть кислоты; - характеризовать химические свойства кислот; - составлять уравнения химических реакций; - распознавать опытным путем растворы кислот
| Текущий. Упр. 1, 2 |
| § 38, упр. 3- 6.
| Л. Реакции, характер ные для растворов кислот (соляной или серной) |
|
|
| 73-74 | РАСТВОРЕНИЕ. РАСТВОРЫ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ (16 часов) | Основания в свете ТЭД; их классифи-кация, свойства | 2 | КУ | Основания. ЭД щелочей. Определение характера среды. Индикаторы. Реакции ионного обмена | Уметь: - называть основания; - характеризовать химические свойства оснований; - составлять уравнения химических реакций; - распознавать опытным путем растворы щелочей | Письмен-ный. Упр. 2, 3. |
| § 39, упр. 4, 5. | Л. Реакции, характерные для растворов щелочей. Получение и свойства осадков нераство-римых гидроксидов
|
|
|
| 75-76 | Соли в свете ТЭД, их свойства | 2 | КУ | Соли. ЭД солей в водных растворах. Ряд напряжений металлов | Уметь: - называть соли; - характеризовать химические свойства солей; - определять возможность протекания реакций ионного обмена | Устный. Упр. 2, 4.
| Соли кислые и основные. Диссоциация кислых и основных солей | § 41, упр. 1,3, 4, 5.
| Л. Реакции, характкер ные для растворов солей |
|
|
| 77-78 | Оксиды, их классифи-кация, свойства
| 2 | КУ | Оксиды. Состав оксидов, их классификация: несолеобразующие и солеобразующие (кислотные и основные). Свойства кислотных и основных оксидов | Уметь: - называть оксиды; - составлять формулы, уравнения реакций | Текущий. упр. 1, 2 | Оксиды несолеобра-зующие и солеобразу-ющие | § 40, упр. 3-5.
| Д. Образцы оксидов Л. Реакции, характер ные для основных и кислотных оксидов |
|
|
| 79-80 | Генетичес-кая связь между классами неоргани-ческих веществ
| 2 | УПЗУ | Основные классы неорганических веществ | Уметь: - называть соединения изученных классов; - составлять уравнения химических реакций | Работа по карточкам. |
| § 42, упр. 1-4.
| Таблицы |
|
|
| 81 | Обобщение и систематизация знаний | 1 | УПЗУ | Решение расчетных задач по уравнениям, характеризующим свойства основных классов соединений и выполнение упражнений этого плана и на генетическую связь. Подготовка к контрольной работе | Уметь: - называть соединения изученных классов; - составлять уравнения химических реакций |
|
|
|
|
|
|
| 82 | Контрольная работа № 5 | 1 | контро льная работа |
|
| Контрольная работа № 5 |
|
|
|
|
|
| 83 | Классификация химичес ких реакций | 1 | УОНМ | Различные признаки классификации химических реакций | Знать классификации химических реакций по различным признакам |
|
|
| Д. Примеры реакций соединения, разложения, замещения, обмена, гомо- и гетерогенных; экзо- и эндотермических… |
|
|
| 84 | Окисли-тельно-восстано-вительные реакции | 1 | УОНМ | Классификация реакций по изменению степени окисления: окислительно-восстановительные реакции. Окислитель, восстановитель | Знать понятия «окислитель», восстановитель», «восстановитель», «окисление» и «восстановление». Уметь: - определять степень окисления элемента в соединении; - составлять уравнения химических реакций
| Текущий. Упр. 2, 3 |
| § 43, упр. 1, 2, 3 | Слайд- презентация ПК, проектор |
|
|
| 85-86 | Упражне-ния в составле-нии окисли-тельно восстано-вительных реакций | 2 | УОП |
|
| Работа с ДМ.
|
| § 43. упр. 4-8 | ДМ |
|
|
| 87-88 | РАСТВОРЕНИЕ. РАСТВОРЫ (26 часов)
(2 часа) | Свойства простых веществ- металлов и неметаллов, кислот, солей в свете ОВР | 2 | КУ | Классификация реакций по изменению степени окисления: окислительно-восстановительные реакции. Окислитель, восстановитель | Знать понятия «окислитель», «восстановитель», «окисление» и «восстановление». Уметь: - определять степень окисления элемента в соединении; - составлять уравнения химических реакций
| Текущий. Упр. 4-8 |
| § 43, упр. 4-8. Рабочая тетрадь: упр. 1-4, с. 164 | ДМ |
|
|
| 89 | Обобщение и системати-зация знаний по курсу 8 класса, решение расчетных задач | 1 | УПЗУ |
| Уметь: - вычислять массу, объем и количество вещества по уравнениям реакций; - определять степень окисления элемента в соединении; - составлять уравнения химических реакций
| Темати-ческий |
| П.р. № 6 | ДМ |
|
|
| 90 | ХИМИЧЕСКИЙ ПРАКТИКУМ №2 «СВОЙСТВА ЭЛЕКТРОЛИТОВ» (4 ЧАСА) | Практическая работа № 6 Ионные реакции
| 1 | практи ческая работа | Правила по технике безопасности при работе в химическом кабинете.
| Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
|
|
| П.р. № 7 | Химическая посуда и оборудование, реактивы |
|
|
| 91 | Практическая работа № 7 Условия протекания химических реакций между растворами электролитов до конца
| 1 | практи ческая работа | Правила по технике безопасности при работе в химическом кабинете. | Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
|
|
| П.р. № 8 | Химическая посуда и оборудование, реактивы |
|
|
| 92 | Практическая работа № 8 Свойства кислот, оснований, оксидов и солей
| 1 | практи ческая работа | Правила по технике безопасности при работе в химическом кабинете. | Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
|
|
| П.р. № 9 | Химическая посуда и оборудование, реактивы |
|
|
| 93 | Практическая работа № 9 «Решение экспериментальных задач»
| 1 | практи ческая работа | Правила по технике безопасности при работе в химическом кабинете. | Знать правила техники безопасности при работе в химическом кабинете Уметь обращаться с химической посудой и оборудованием
|
|
|
| Химическая посуда и оборудование, реактивы |
|
|
| 94 |
| Итоговая контрольная работа за курс химии 8 класса | 1 | контро льная работа |
|
|
|
|
|
|
|
|
| 95-100 | Портрет ная галерея великих химиков
| 6 |
| Повторение материала 8 класса – основных понятий, законов и теорий через знакомство с жизнью и деятельностью ученых, осуществивших их открытие |
|
|
|
|
|
|
|
| 101-103 |
| Учебные экскурсии | 3 |
| Экскурсии в аптеку, на хлебозавод |
|
|
|
|
|
|
|
| 104-105 |
| Резервное время | 2 |
|
|
|
|
|
|
|
|
|
ЛИТЕРАТУРА
1. Химия. 8 класс: учебник для общеобразовательных учреждений / О.С. Габриелян. – М.: Дрофа, 2013.
2. Сборник материалов по реализации федерального компонента государственного стандарта общего образования в образовательных учреждениях Волгоградской области– Волгоград: Учитель, 2006.
3. Настольная книга учителя. Химия. 8 класс: методическое пособие / О.С. Габриелян, Н.П. Воскобойникова. – М.: Дрофа, 2004.
4. Химия. 8 класс: контрольные и проверочные работы / О.С. Габриелян и др. – М.: Дрофа, 2010.
5. Химия. 8 класс: рабочая тетрадь к учебнику О.С. Габриеляна/ О.С. Габриелян, А.В. Яшукова. – М.: Дрофа, 2011.
6. Химия. 8 класс: карточки заданий к учебнику О.С. Габриеляна/ Л.И. Некрасова. – Саратов: Лицей, 2010.
7. Химия 8 класс: тетрадь для лабораторных опытов и практических работ/ О.С. Габриелян, А.В. Яшукова. – М.: Дрофа, 2011.
8. Уроки химии по интегральной технологии. 8 кл.: метод. пособие/ Т.К. Толкачева, Л.Г. Лазыкина, З.К. Левитина и др. – М.: Дрофа, 2007

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа по химии (8 класс) (0.37 MB)
Рабочая программа по химии (8 класс) (0.37 MB)
 0
0 484
484 104
104 Нравится
0
Нравится
0




