Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскатьфилософский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи.
Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте.
Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Картина Джозефа Райта «Алхимик, открывающий фосфор» предположительно описывающая открытие фосфора Хеннигом Брандом, 1771 год
Несколько позже фосфор был получен другим немецким химиком —Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.

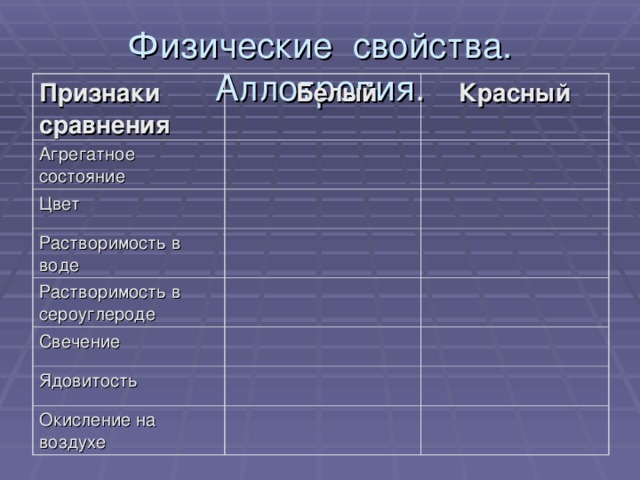
Фосфин
с водородом фосфор непосредственно не реагирует,
фосфин РН3 можно получить косвенно, например:
Ca3P2+6HCl=3CaCl2 +2PH3
Определите степень окисления каждого элемента.
Является ли эта реакция окислительно-восстановительной?
Фосфин - очень ядовитый газ с неприятным запахом!

 Получите свидетельство
Получите свидетельство Вход
Вход





















 Открытие фосфора (3.42 MB)
Открытие фосфора (3.42 MB)
 0
0 1229
1229 23
23 Нравится
0
Нравится
0





