
АТФ

«Чудовище лежало перед нами…
Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я дотронулся до этой светящейся головы и, подняв руку, увидел, что мои пальцы тоже засветились в темноте.
- Фосфор, – сказал я».
Возможные предметы : пачка стирального порошка, кусочек сыра, камень бирюза, фрагмент структуры АТФ (картинка или шаростержневая модель), книга А. КонанДойля “Собака Баскервилей”, пачка чая.
Конан Дойль «Собака Баскервилей» 1. О каком аллотропном видоизменении шла речь в отрывке. 2. С каким свойством фосфора связана эта фантастическая история? 3. Какая ошибка была допущена автором?

Фосфор – элемент жизни и мысли.
А.Е.Ферсман
ФОСФОР
Цель: Сформировать представление о фосфоре как о простом веществе

СОДЕРЖАНИЕ:
- Положение фосфора в ПС
- Открытие фосфора
- Нахождение в природе,
- Аллотропные модификации фосфора
- Химические свойства
- Получение фосфора
- Применение фосфора и его соединений
- Соединения фосфора и их свойства
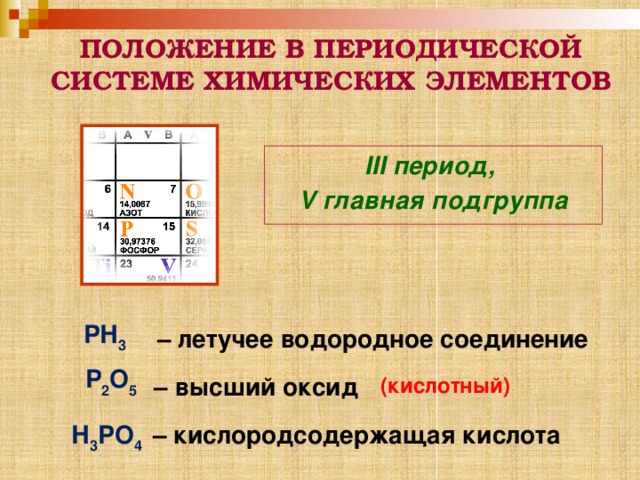
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
III период,
V главная подгруппа
РН 3
– летучее водородное соединение
Р 2 О 5
– высший оксид
(кислотный)
– кислородсодержащая кислота
Н 3 РО 4

c Степени окисления
+ +3, +5, -3
1 3s 2 3p 3

ОТКРЫТИЕ ФОСФОРА
Фосфор был открыт немецким алхимиком
Х. Брандом в 1669 г.
От греческого « фосфор» – «светоносный» .
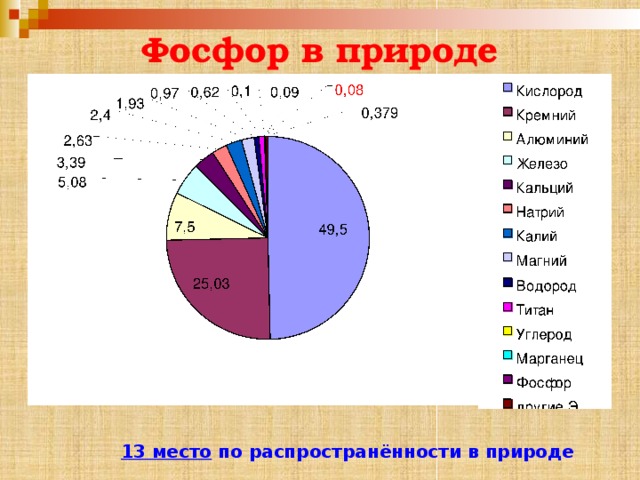
Фосфор в природе
13 место по распространённости в природе

Минералы фосфора
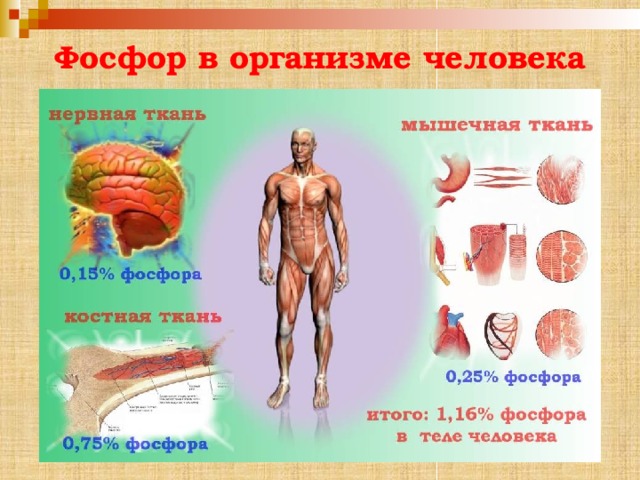
Фосфор в организме человека
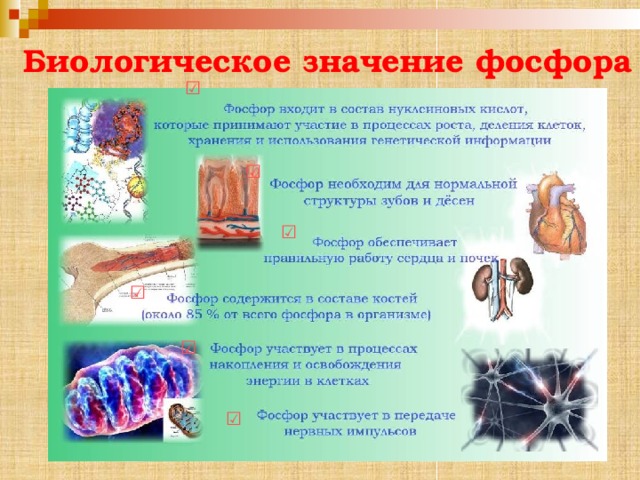
Биологическое значение фосфора
☑
☑
☑
☑
☑
☑
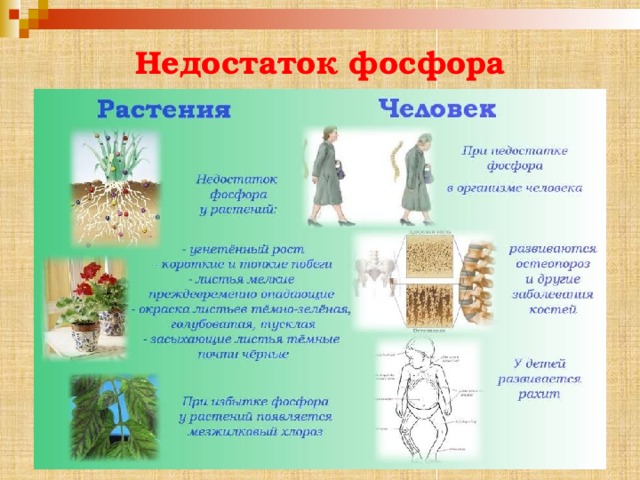
Недостаток фосфора



Задача:
Какова масса фосфора в вашем теле, если известно, что фосфор составляет ≈1% от массы тела?
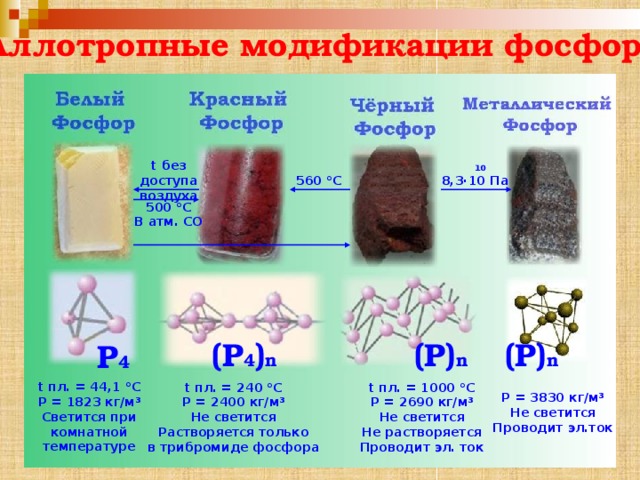
Аллотропные модификации фосфора
t без доступа воздуха
10
8,3·10 Па
560 °C
500 °C
В атм. СО
(P 4 ) n
(P) n
(P) n
P 4
t пл. = 44,1 °С
Ρ = 1823 кг/м³
Светится при
комнатной
температуре
t пл. = 240 °С
t пл. = 1000 °С
Ρ = 2400 кг/м³
Ρ = 2690 кг/м³
Не светится
Не светится
Не растворяется
Растворяется только
в трибромиде фосфора
Проводит эл. ток
Ρ = 3830 кг/м³
Не светится
Проводит эл.ток
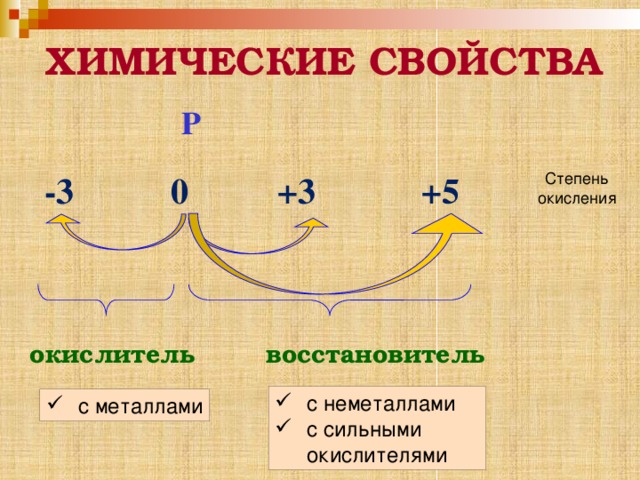
ХИМИЧЕСКИЕ СВОЙСТВА
Р
-3 0 +3 +5
Степень окисления
окислитель
восстановитель
- с неметаллами
- с сильными окислителями

ХИМИЧЕСКИЕ СВОЙСТВА
с Металлами
3Са+ 2Р = Са 3 Р 2
Са + Р =
3Mg + 2Р = Mg 3 Р 2
Mg + Р =

ХИМИЧЕСКИЕ СВОЙСТВА
с неМеталлами
P + O 2 =
P + Сl 2 =
4P + 5O 2 = 2P 2 O 5
2P + 5Cl 2 = 2PCl 5

с сильными окислителями
P(кр.) + HNO 3 (конц.) = H 3 PO 4 + NO 2 ↑ + H 2 O
P(кр.) + 5HNO 3 (конц.) = H 3 PO 4 + 5NO 2 ↑ + H 2 O
P + H 2 SO 4 (к) = H 3 PO 4 + SO 2 ↑ + H 2 O
2P + 5H 2 SO 4 (к) = 2H 3 PO 4 + 5SO 2 ↑ +2H 2 O
Расставьте коэффициенты методом электронного баланса:

При обычных условиях красный фосфор устойчив.
Расставьте коэффициенты методом электронного баланса:
Р + КСlO 3 = KCl + P 2 O 5
6Р + 5КСlO 3 = 5KCl + 3P 2 O 5
При трении спичечной головки о боковую поверхность коробка, происходит воспламенение:
17

Расставьте коэффициенты методом электронного баланса:
8P + 12H 2 O = 5PH 3 + 3 H 3 РО 4
P + H 2 O = PH 3 + H 3 РО 4
фосфин
- В холодных концентрированных растворах щелочей
4P + 3КOН + 3Н 2 О = PH 3 + 3К H 2 РО 2
P + КOН + Н 2 О = PH 3 + К H 2 РО 2
Гипофосфит калия
реакция диспропорционирования

ПОЛУЧЕНИЕ
- Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
2Ca 3 (PO 4 ) 2 +10C+ 6SiO 2 → P 4 +10CO + 6CaSiO 3
Образующиеся пары белого фосфора конденсируются в приёмнике под водой.
- Можно подвергнуть восстановлению, например метафосфорную кислоту:
4HPO 3 + 12C → 4P + 2H 2 + 12CO

ПРИМЕНЕНИЕ ФОСФОРА

Общая характеристика фосфора
- Фосфор- элемент V группы, главной подгруппы.
- Заряд ядра атома фосфора равен +15 .
- В ядре атома фосфора 15 протонов.
- В ядре атома фосфора 16 нейтронов.
- В атоме фосфора 15 электронов.
- Атом фосфора имеет 3 энергетических уровня.
- Электронная оболочка имеет строение 2е, 8е, 5е .
- На внешнем уровне в атоме фосфора 5 электронов.
- Высшая степень окисления атома фосфора равна +5 .
- Простое вещество является неметаллом .
- Высший оксид и гидроксид фосфора имеют кислотный характер.

 Получите свидетельство
Получите свидетельство Вход
Вход




































 Фосфор (презентация) (3.18 MB)
Фосфор (презентация) (3.18 MB)
 0
0 1577
1577 72
72 Нравится
0
Нравится
0


