Основные соединения серы

Цели урока:
Обучающие: изучить строение основных соединений серы; изучить распространение соединений серы в природе, применение основных соединений серы и их воздействие на окружающую среду.
Развивающие: развить представление учащихся о важнейших соединениях серы.
Воспитательные: продемонстрировать практическую направленность знаний о соединениях серы.
Основные соединения серы:
- Н 2 S – сероводород;
- SO 2 - серный газ;
- SO 3 - сернистый ангидрид;
- Н 2 SO 3 - сернистая кислота;
- Н 2 SO 4 - серная кислота
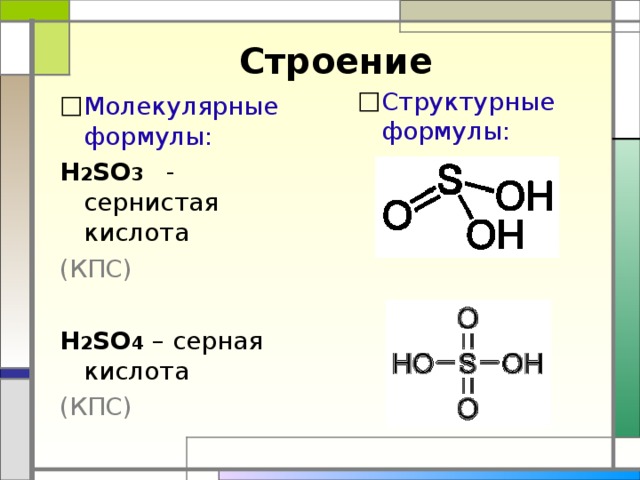
Строение
- Структурные формулы:
- Молекулярные формулы:
Н 2 SO 3 - сернистая кислота
(КПС)
Н 2 SO 4 – серная кислота
(КПС)
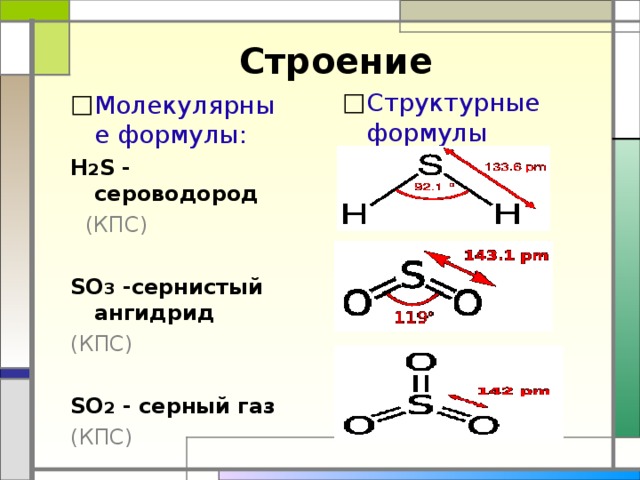
Строение
- Структурные формулы
- Молекулярные формулы:
Н 2 S - сероводород
(КПС)
SO 3 -сернистый ангидрид
(КПС)
SO 2 - серный газ
(КПС)
Сернистый газ
SO 2 – оксид серы(IV), диоксид серы
Бесцветный газ с характерным резким запахом.
Очень токсичен. Тяжелее воздуха в 2 раза.
Растворяется в воде 1:40
(образуя при этом сернистую кислоту)
Растворяется также в этаноле, серной кислоте. SO 2 - один из основных компонентов вулканических газов.
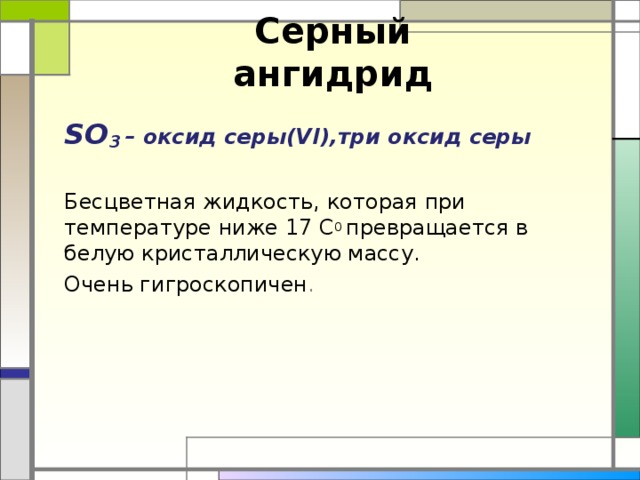
Серный ангидрид
SO 3 – оксид серы(VI),три оксид серы
Бесцветная жидкость, которая при температуре ниже 17 С 0 превращается в белую кристаллическую массу.
Очень гигроскопичен .

Химические свойства
Кислотно-основные свойства
- С водой
- О основаниями
- С основными оксидами

SO 3 — типичный кислотный оксид, ангидрид серной кислоты
- Кислотно-основные:
- с водой :
SO 3 + H 2 O → H 2 SO 4
- с основаниями:
2 KOH + SO 3 → K 2 SO 4 + H 2 O,
- С основными и амфотерными оксидами:
CaO + SO 3 → CaSO 4 ,
3 SO 3 + Al 2 O 3 → Al 2 (SO 4 ) 3

Окислительно-восстановительные свойства
Расставьте коэффициенты методом электронного баланса
SO 2
SO 3
Как окислитель:
SO 2 + H 2 S = S + H 2 O
Как восстановитель:
SO 2 + Cl 2 + H 2 O = H 2 SO 4 + HCl
Только окислитель!
SO 3 + H 2 S = SO 2 + H 2 O

СЕРОВОДОРОД
Бесцветный газ с резким запахом тухлых яиц
Термически неустойчив, плохо растворим в воде(1:2,5) Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения - 60,35 °С,
плотность 0,938 г/см3 (-81 °С)
Водный раствор – сероводородная кислота (слабая)

Соли сероводородной кислоты
Диссоциация H 2 S
H 2 S H + + HS (I ступень )
HS - H + + S 2- (II ступень)
-
СОЛИ
Сульфиды Гидросульфиды
Na 2 S Ba(HS) 2
Сульфид натрия гидросульфид бария

Химические свойства
H 2 S является очень слабой кислотой:
- H 2 S → HS − + H +
Сероводород — сильный восстановитель.
- На воздухе горит синим пламенем:
H 2 S + О 2 = Н 2 О + SO 2
- при недостатке кислорода
H 2 S + O 2 = S + H 2 O
(на этой реакции основан промышленный способ получения серы).
Расставьте коэффициенты методом электронного баланса
Нахождение соединений серы
в природе
Сульфидная сера
Сульфатная сера
Самородная
сера
Халькопирит
Киноварь
HgS
CuFeS 2
Гипс
Сфалерит
Галенит
CaSO 4 •2H 2 O
ZnS
PbS

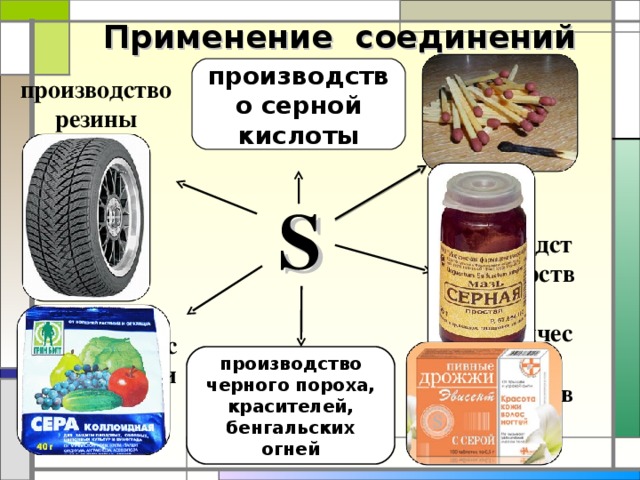
Применение соединений серы
производство серной кислоты
производство резины
S
производство лекарств и косметических препаратов
для борьбы с вредителями растений
производство черного пороха, красителей, бенгальских огней
15

 Получите свидетельство
Получите свидетельство Вход
Вход











 Основные соединения серы (1.07 MB)
Основные соединения серы (1.07 MB)
 0
0 4901
4901 53
53 Нравится
0
Нравится
0



