
Основания
Класс: 8
Учитель: Мазаева Имани Вахаевна,
учитель химии МБОУ «СОШ №53» г. Грозного

Цель урока:
- Познакомить учащихся с новым классом неорганических соединений – основаниями.
- Рассмотреть классификацию, состав и номенклатуру оснований .
- Изучить изменение цвета индикаторов в растворе щелочей.
- Воспитать умение работать коллективно (в группах), оценивать свои возможности и знания товарищей.

Оборудование
- Образцы оснований;
- Пробирки;
- Индикаторы;
- Штатив для пробирок;
- Инструкция «Техника безопасности при работе с основаниями»;
- Таблица «Окраска индикатора в воде, растворах кислот и щелочей»;
- Учебник;
- Дидактический материал.

План урока
- Состав, названия и определение оснований.
- Классификация оснований.
- Индикаторы.
- Физические свойства оснований, их значение в жизни человека.

Определение. Номенклатура
- Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов .
- M(OH) n, где M – металл, n – число групп OH - и в то же время численное значение заряда иона (степени окисления) металла
- Например: К +1 OH, Мg +2 (OH) 2 , Al +3 (OH) 3
- Название: «гидроксид» + «металла» (степень окисления, если переменная)
- Cu(OH) 2 – гидроксид меди два

Определение оснований
Гидроксиды
К ОН Ca( ОН ) 2 Al( ОН ) 3 Ba( ОН ) 2
K OH K + + OH -
Ba (ОН) 2 Ba +2 + 2 OH -

Выберите формулы оснований. Назовите их.
- НСl, NaOH, Na 2 O, Ca(OH) 2 , H 2 SO 4 , P 2 O 5 , Fe(OH) 3 , MgO, Cи(OH) 2

Основания
- NaOH – гидроксид натрия
- Mg(OH) 2 – гидроксид магния
- Fe(OH) 3 – гидроксид железа (II)
- Cu(OH) 2 – гидроксид меди (III)
Найдите ошибку!
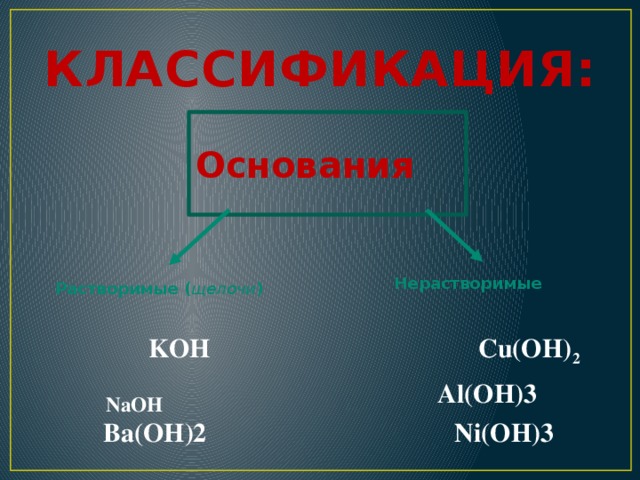
КЛАССИФИКАЦИЯ:
Основания
Нерастворимые
Растворимые ( щелочи )
KOH Cu(OH) 2
NaOH Al(OH)3
Ba(OH)2 Ni(OH)3
LiOH Fe(OH)2

Таблица растворимости кислот, оснований, солей

По какому признаку основания разделены на группы?
?
?
?
Al(OH)3
Fe(OH)3
Cu(OH)2
Ba(OH)2
Pb(OH)2
Fe(OH)2
NaOH
KOH
LiOH
СsOH
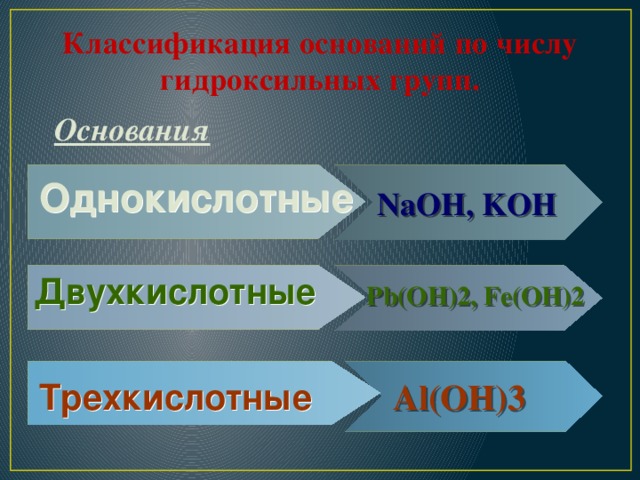
Классификация оснований по числу гидроксильных групп.
Основания
Однокислотные
NaOH, KOH
Двухкислотные
Pb(OH)2, Fe(OH)2
Трехкислотные
Al(OH)3

Физические свойства оснований
КОН
Агрегатное состояние:
Все твердые вещества
Белого – КОН ,
Голубого - Cu(OH)2
Красно-бурого - Fe(OH)3
- Запах – ?
- Вкус – ? (горький, солоноватый)
- Растворимость в воде - ?
Cu(OH)2

Физкультминутка

Химические свойства нерастворимых оснований.
1). Разлагаются при нагревании.
2). Взаимодействуют с кислотами (реакция нейтрализации).

Химические свойства щелочей.
1). Изменяют окраску индикаторов.
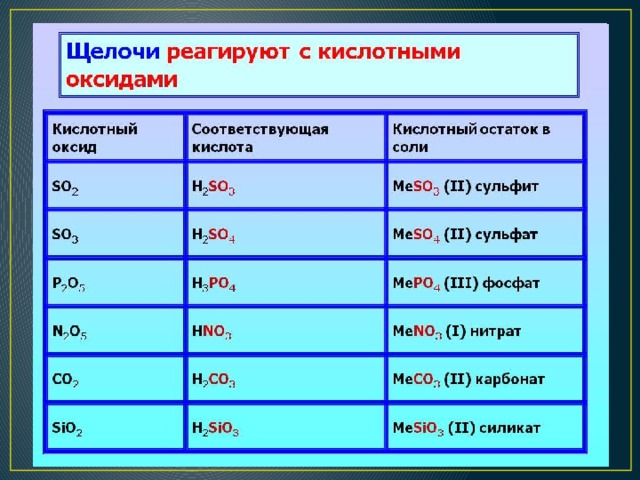
Взаимодействуют с:
2). кислотами (реакция нейтрализации),
3). кислотными оксидами,
4). солями.

Правила ТБ при обращении с основаниями
- Растворимые основания – щелочи – могут вызвать химический ожог при попадании на незащищенные участки кожи рук и лица. Они могут разъесть кожу, ткань, бумагу и другие материалы.

Что делать?
- В случае попадания щелочи на одежду или участок кожи следует немедленно сообщить учителю о случившемся и сделать следующее: тщательно и обильно промыть участок кожи водой из-под крана, затем обработать это место нейтрализующим раствором борной кислоты, вновь промыть водой и смазать место ожога вазелиновым маслом. Обязательно обратиться в медпункт школы для наблюдения и оказания дальнейшей медицинской помощи.
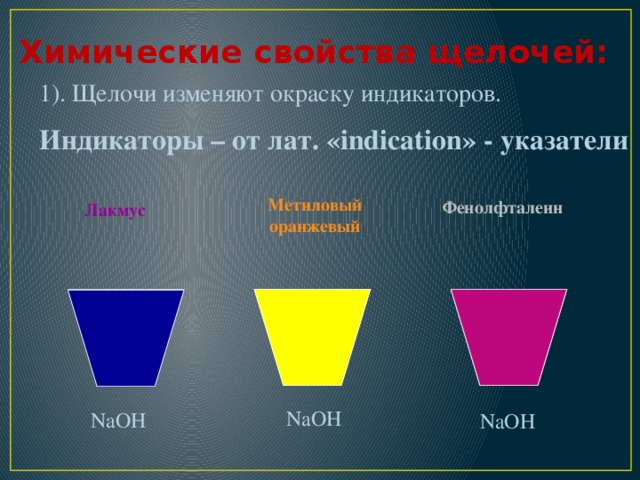
Химические свойства щелочей:
1). Щелочи изменяют окраску индикаторов.
Индикаторы – от лат. «indication» - указатели
Метиловый оранжевый
Фенолфталеин
Лакмус
NaOH
NaOH
NaOH

Химические свойства щелочей :
Ва(ОН) 2 + 2НСl = ВаСl 2 + 2Н 2 О
хлорид бария

Выполните задание. Допишите уравнения реакций. Назовите вещества.
2 ВАРИАНТ
1). КOH + HNO 3 =
2). KOH + N 2 O 5 =
3). KOH + Cu(NO 3 ) 2 =
4). KOH + лакмус =
5). Pb(OH) 2 =
1 ВАРИАНТ
1). NaOH + H 2 SO 4 =
2). NaOH + SO 3 =
3). NaOH + CuSO 4 =
4). NaOH + фенол-фталеин =
5). Mg(OH) 2 =
t
t

Д/З § 39, у. 2, 5, 6, 11 * с. 174-175.

Спасибо за урок!


 Получите свидетельство
Получите свидетельство Вход
Вход



































 Основания (презентация) (1.1 MB)
Основания (презентация) (1.1 MB)
 0
0 1109
1109 104
104 Нравится
0
Нравится
0



