Задание 1.
Сколько литров водорода выделится при взаимодействии 130 граммов цинка с соляной кислотой?
(10 баллов)
Задание 2.
С какими из перечисленных веществ будет реагировать вода:
Na; HCl; Zn; CuO; Cu; CaO; Ca; SiO2
Напишите уравнение реакций. (30 баллов)
Задание 3.
Запишите три уравнения реакций, которые возможны между данными веществами:
MgO; CaCO3; HCl; NaOH; SO3.(40 баллов)
Задание 4.
Из атомов мир создавала Природа.
Два атома легких взяла водорода
Прибавила атом один кислорода
И… получилась частица …воды,
Стал кислород чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород как ни странно,
Из голубой глубины океана.
Запишите уравнения возможных химических реакций. Расставьте коэффициенты.
(10 баллов)
Задание 5.
Осуществите превращения:
Zn→ZnCl2→Zn(OH)2→Na[Zn(OH)3]
S→SO2→H2SO3→Na2SO3
(20 баллов)
Задание 6.
Проволока сечением 1 мм2 выдерживает груз 400 кг из:

а) стали (Fe, C)
б) стали (Fe, C, Cr, Ni и т.д.)
(20 баллов)
Задание 7.
Определите массу алюминия, который потребуется для получения 156 граммов хрома из оксида хрома (III).
(10 баллов)
Задание 8.
Закончите уравнения реакций:
Zn(OH)2+HCl→
Zn(OH)2+NaOH→
ZnO+HCl→
ZnO+NaOH+H2O→
ZnO+SO3→
(15 баллов)
Задание 9.
Миша с пеленок был заядлым эксперементатором. Однажды он решил получить кристаллы йода из 5%-го спиртового раствора йода путем выпаривания спирта.
В выпарную чашку он вылили из флакончика 25 граммов раствора и начал процесс выпаривания.
Объясните, почему в конце работы у Мишы округлились глаза, и было недоумевающее лицо. Сколько граммов йода мог бы получить Миша теоретически?
(5 баллов)
Задание 10.
Назвать три легких конструкционных металла.
(10 баллов)
Итого 170 баллов.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход


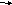
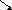 aCO3+2HCl=CaCl2+CO3 CO2 HCl+NaOH=NaCl+H2O
aCO3+2HCl=CaCl2+CO3 CO2 HCl+NaOH=NaCl+H2O









 Олимпиада по химии (0.12 MB)
Олимпиада по химии (0.12 MB)
 0
0 1239
1239 55
55 Нравится
0
Нравится
0



