
Одноатомные Спирты
Автор: Фарафонтова Светлана Юрьевна
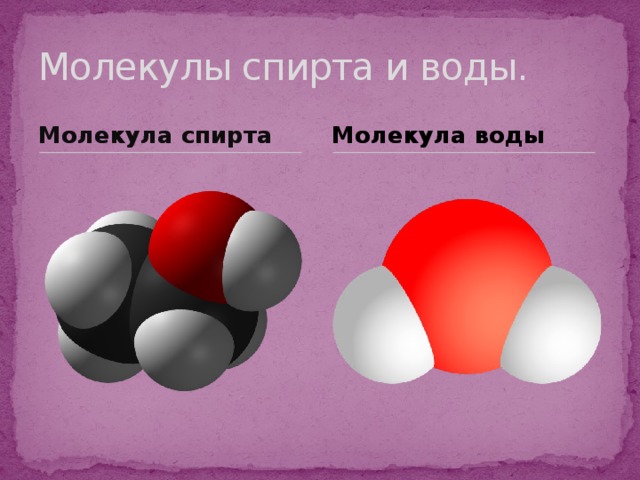
Молекулы спирта и воды.
Молекула спирта
Молекула воды

Классификация спиртов
- 1. По числу гидроксильных групп:
-одноатомные спирты (метанол);
- двухатомные спирты (этиленгликоль);
-трехатомные спирты (глицерин);
- четырёхатомные спирты (пентаэритрит);
- многоатомные спирты (пятиатомный спирт: ксилит).
2.В зависимости от насыщенности углеводородного заместителя :
-предельные или насыщенные спирты (бутанол);
- непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт);
- ароматические спирты (бензиловый спирт).
- 3.В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
-алициклические спирты (циклогексанол);
- алифатические или ациклические спирты (этанол).
- 4.В зависимости от того, при каком атоме углерода находится гидроксильная группа:
- первичные спирты (пропанол);
- вторичные спирты (изопропиловый спирт);
- третичные спирты (2-метилпропан-2-ол).

Номенклатура спиртов
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов ,с добавлением суффикса «-ол» , положение которого указывается арабской цифрой .
Правила построения названия спиртов (функциональная группа -OH ):
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке

Способы получения спирта:
1. Реакции окисления - основаны на окислении углеводородов (реже - галогенпроизводных углеводородов), содержащих кратные или активированные C-H связи;
2.Реакции восстановления - восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
3.Реакции гидратации - кислотно-катализируемое присоединение воды к алкенам (гидратация);
4.Реакции присоединения - присоединение синтез-газа, формальдегида.

Химические свойства спиртов:
Все химические свойства спиртов можно разделить на три группы:
1.С разрывом связи О-Н
2R−OH + 2Na → 2R−О − Na + + H 2 ↑
2.С разрывом связи С-OН (этерификация)
H2SO4
C2H5OH+ CH3COOH → CH3COOC2H5 + H2O
3.С разрывом связи –СОН
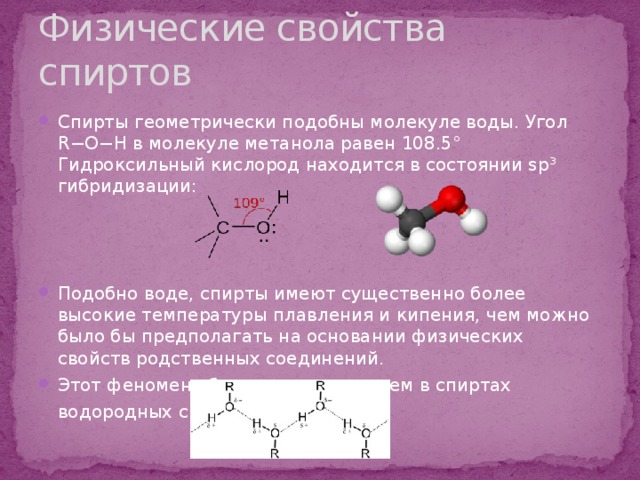
Физические свойства спиртов
- Спирты геометрически подобны молекуле воды. Угол R−O−H в молекуле метанола равен 108.5° Гидроксильный кислород находится в состоянии sp³ гибридизации:
- Подобно воде, спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений.
- Этот феномен объясняется наличием в спиртах водородных связей .

Дегидратация спиртов
В присутствии катализаторов (таких, как оксид алюминия или безводная серная кислота) спирты могут подвергаться реакции элиминирования, с разрывом связи C-O и образованием алкенов. Например, дегидратация этилового спирта приводит к образованию этилена (показан механизм элиминации под действием кислотного катализатора):
Реакция протекает в соответствии с правилом Зайцева, согласно которому образуется наиболее стабильный углеводород.
Спирты сами являются нуклеофильными агентами, поэтому протонированная гидроксигруппа R-OH 2 + может реагировать с молекулой спирта R-OH с образованием простого эфира и отщеплением воды. Эта реакция используется в основном при получении диэтилового эфира.
C2H5OH + HOC2H5 → C2H5OC2H5 + H2O
![Окисление 1.Первичные спирты (R-CH2-OH) могут быть окислены до альдегидов (R-CHO), а дальнейшее окисление, которое часто бывает трудно приостановить, приводит к карбоновым кислотам (R−CO 2 H). CH3-CH2OH + [O] → CH3COH; CH3COH + [O] → CH3COOH. 2.Окисление вторичных спиртов (R 1 R 2 CH−OH) как правило заканчивается на стадии кетонов (R 1 R 2 C=O) без разрыва углеводородной цепи. 3.Третичные спирты (R 1 R 2 R 3 C-OH) устойчивы к окислению, а при вступлении в реакцию образуют смесь карбоновых кислот.](https://fsd.videouroki.net/html/2013/02/14/98660989/img8.jpg)
Окисление
1.Первичные спирты (R-CH2-OH) могут быть окислены до альдегидов (R-CHO), а дальнейшее окисление, которое часто бывает трудно приостановить, приводит к карбоновым кислотам (R−CO 2 H).
CH3-CH2OH + [O] → CH3COH;
CH3COH + [O] → CH3COOH.
2.Окисление вторичных спиртов (R 1 R 2 CH−OH) как правило заканчивается на стадии кетонов (R 1 R 2 C=O) без разрыва углеводородной цепи.
3.Третичные спирты (R 1 R 2 R 3 C-OH) устойчивы к окислению, а при вступлении в реакцию образуют смесь карбоновых кислот.

Применение спиртов
Области использования спиртов многочисленны и разнообразны, особенно учитывая широчайший спектр соединений, относящихся к этому классу. Вместе с тем, с промышленной точки зрения, только небольшой ряд спиртов вносит заметный вклад в глобальную мировую экономику.
этиловый спирт:
1. Прямое использование в качестве топлива.
2. В качестве растворителя.
3. Синтез органических соединений.
метиловый спирт
1. Синтез простых эфиров - оксигенирующих компонентов бензина (2-метокси-2-метилбутан и 2-метокси-2-метилпропан).
2. Синтез уксусной кислоты и уксусного ангидрида.
3. Прямое использование в качестве топлива .

Применение спиртов:


 Получите свидетельство
Получите свидетельство Вход
Вход










![Окисление 1.Первичные спирты (R-CH2-OH) могут быть окислены до альдегидов (R-CHO), а дальнейшее окисление, которое часто бывает трудно приостановить, приводит к карбоновым кислотам (R−CO 2 H). CH3-CH2OH + [O] → CH3COH; CH3COH + [O] → CH3COOH. 2.Окисление вторичных спиртов (R 1 R 2 CH−OH) как правило заканчивается на стадии кетонов (R 1 R 2 C=O) без разрыва углеводородной цепи. 3.Третичные спирты (R 1 R 2 R 3 C-OH) устойчивы к окислению, а при вступлении в реакцию образуют смесь карбоновых кислот.](https://fsd.videouroki.net/html/2013/02/14/98660989/img8.jpg)











 Одноатомные спирты (0.76 MB)
Одноатомные спирты (0.76 MB)
 0
0 1108
1108 58
58 Нравится
0
Нравится
0





