Цели:
Повторить строение молекулы серной кислоты, рассмотреть ее физические и химические свойства в свете теории электролитической диссоциации и с точки зрения окислительно-восстановительных процессов.
Оборудование: «Схема-конспект урока», карточки.
Использованные технологии: практико-ориентированное обучение
Реактивы: Серная кислота концентрированная и разбавленная; цинк; медь; железо; р-р гидроксида натрия; индикаторы; р-р хлорида бария; стеклянные трубочки; сахар; стаканы; р-р карбоната натрия; вода.
Ход урока
1. Оргмомент
2. Повторение пройденного материала.
Учитель: Ребята! Прежде, чем мы приступили к изучению нового материала, давайте вспомним некоторые химические понятия – электролитическая диссоциация, электролит, степень окисления, окислитель, ион гидроксония.
(фронтальная беседа, выслушиваю ответы учащихся)
3. Изучение нового материала.
Учитель: Теперь смело можем перейти к теме сегодняшнего урока.
«Нужна нам везде и всегда сильнейшая серная кислота.
И я рассказать вам хочу о ней, хоть много у меня и других идей. Свойства серной кислоты будут вам сейчас даны.
Их вы помните всегда – не забудьте никогда!»
Итак, запишите тему «Свойства серной кислоты». Серная кислота – это один из важнейших продуктов химической технологии, который находит широкое применение. Чтобы разумно использовать вещество, прежде всего, необходимо знать его свойства. Как и всегда при изучении химических соединений, мы рассмотрим:
Физические свойства
Химические свойства: 1) общие с другими кислотами; 2) специфические свойства.
Вашим путеводителем и помощником будет схема – конспект, который вы составите вместе со мной, но прочтет его кто-то, чью фамилию я вытащу написанную на этих листочках.
Итак, 1. физические свойства серной кислоты:
Н2SО4, маслянистая жидкость, кристаллизуется при tпл 10,30С, рлотность1,83 г/мл, сильно разогревается при растворении в воде, образуя гидраты
![]() Н2SО4. п Н2О.
Н2SО4. п Н2О.
Структурная формула серной кислоты:
Ребята, какие электролиты, с точки зрения ТЭД называются кислотами?
(выслушиваю ответы учащихся)
Назовите, с какими веществами реагирует раствор серной кислоты?
(выслушиваю ответы учащихся)
Назовите условия реакции ионного обмена? (выслушиваю ответы учащихся)
2. Химические свойства: 1) общие с другими кислотами
Свойство кислот – диссоциация растворов кислот.
Ребята, напишите упрощенное уравнение диссоциации многоосновных кислот? (вызываю к доске ученика)
Учитель: «Есть кислоты разные со свойствами разнообразными
Но их всех объединяет водорода катион
Кислую среду раствора, обуславливает он»
Чему равна основность серной кислоты? Сколько ступеней диссоциации серной кислоты можно наблюдать? (выслушиваю ответы учащихся)
Учитель: Известно, что окраска индикаторов изменяется в зависимости от кислотности среды. Угадайте о каком индикаторе это четверостишье:
«От щелочи я желт, как в лихорадке,
Краснею от кислот, как от стыда,
И я бросаюсь в воду без оглядки,
Чтоб не могла заесть меня среда» (выслушиваю ответы учащихся).
Лабораторный опыт – используя имеющиеся индикаторы на столах учеников, определяют какой из индикаторов лучше подходит для определения среды раствора кислоты. (ученики выполняют эксперимент, оформляют записи)
Свойство кислот – взаимодействие металлов с раствором серной кислоты.
Лабораторный опыт – ребята, используя имеющиеся реактивы, проведите химическую реакцию. Докажите, что ион Н+ проявляет свойства окислителя?
(ученики выполняют эксперимент, оформляют записи)
«Как и любая другая кислота,
С металлами до водорода реагирует она.
В результате водород замещается
И окислителем в этой реакции является»
Какие признаки реакции вы наблюдаете? Запишите уравнение в молекулярном виде? Составьте схему окислительно-восстановительной реакции?
(вызываю к доске ученика для записи уравнений реакции)
Fe + Н2SО4 = FeSО4 + Н2
Zn + Н2SО4 = ZnSО4 + Н2
Свойство кислот – взаимодействие с основными оксидами раствора серной кислоты.
«Если взять оксид металла с кислотой,
То реакция пойдет сама собой.
При этом металла сульфат и вода
Образуется всегда!»
Лабораторный опыт – ребята, используя имеющиеся реактивы, проведите химическую реакцию. (ученики выполняют эксперимент, оформляют записи, вызываю к доске ученика для записи уравнения реакции молекулярном, полном и сокращенном ионом виде)
СиО + Н2SО4 = Си SО4 + Н2О
СиО + 2Н + + SО42 – = Си2+ + SО42- + Н2О
СиО + 2Н + = Си2+ + Н2О
Свойство кислот – взаимодействие щелочей и нерастворимых оснований с растворами серной кислоты.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход


 2SО4. п Н2О.
2SО4. п Н2О. 

 – О О
– О О S
S 
 – О О
– О О
 ОН + Н2SО4 Н3О+ + НSО4-
ОН + Н2SО4 Н3О+ + НSО4-
 НSО4- Н + + SО42 –
НSО4- Н + + SО42 – 
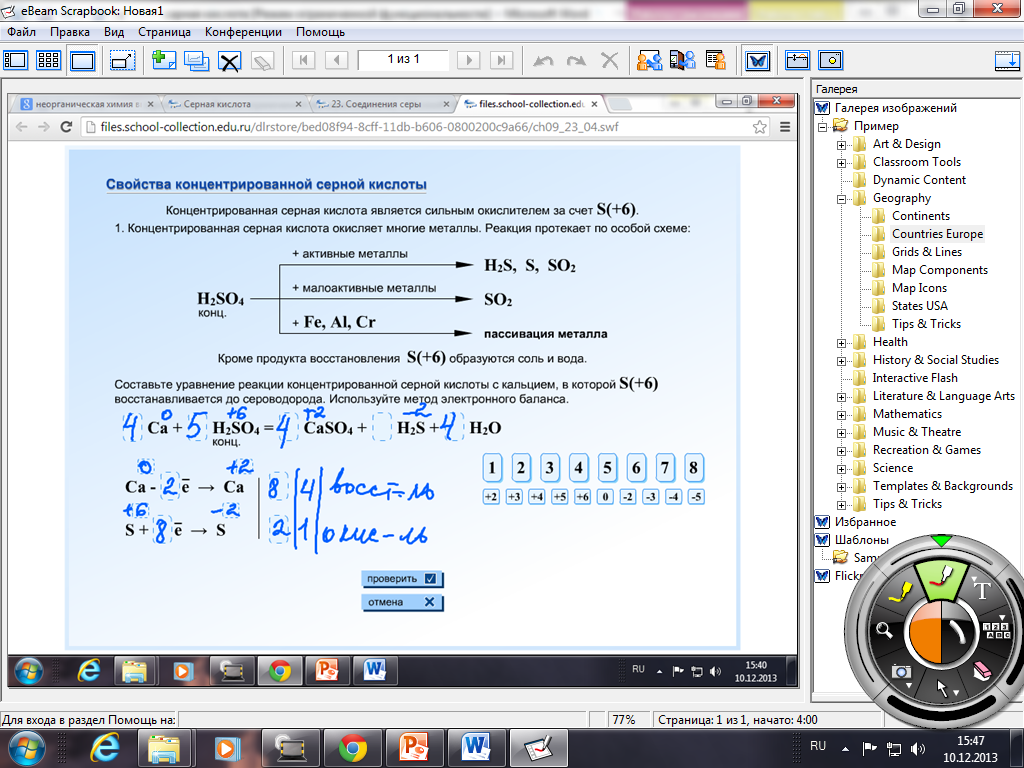
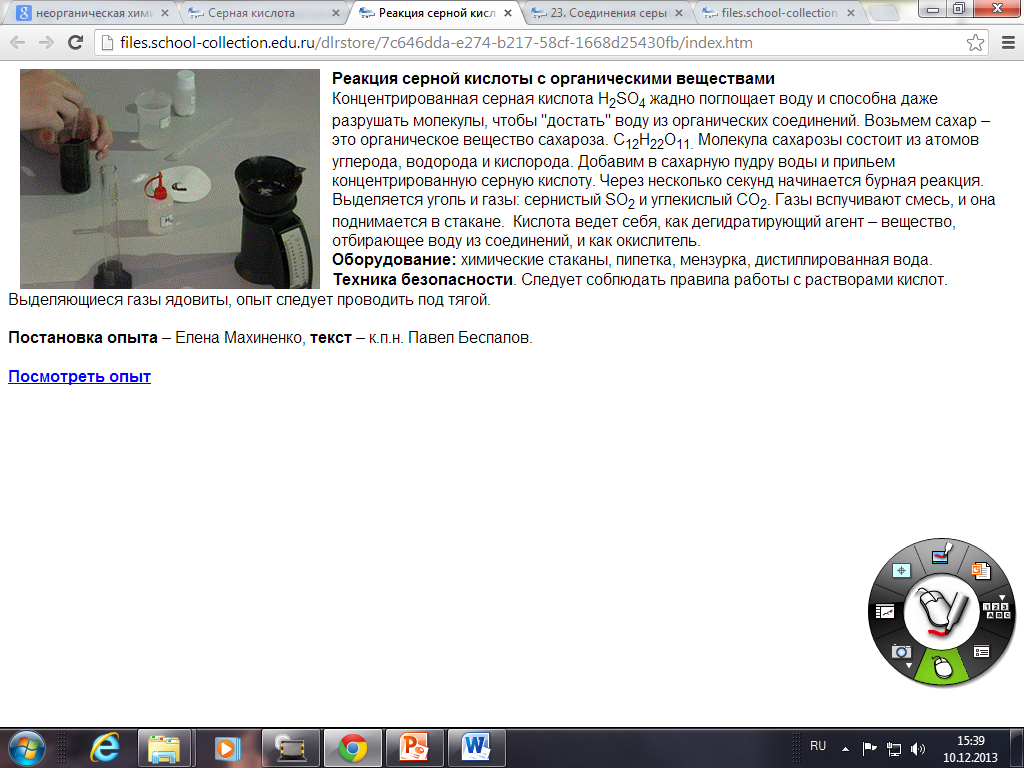
 Н 2О + Н2SО4 Н2SО4 . Н2О +Q
Н 2О + Н2SО4 Н2SО4 . Н2О +Q








 Неметаллы. Серная кислота (0.91 MB)
Неметаллы. Серная кислота (0.91 MB)
 0
0 610
610 82
82 Нравится
0
Нравится
0










