
Кузнецов В. А.

Химические реакции квалифицируют по следующим признакам:
1. Изменению степени окисления атомов, входящих в состав реагирующих веществ(окислительно– восстановительные реакции).
2. Числу и составу исходных и образующихся веществ ( реакции разложения, соединения, замещения, обмена).
3. Тепловому эффекту (экзотермические и эндотермические).
4. Признаку обратимости (обратимые и необратимые)

Все химические реакции подразделяются на такие, в которых происходит изменение степени окисления и в которых это не происходит .
Процессы, в результате которых происходит изменение степени окисления, т. е. переход или смещение электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью, называются окислительно – восстановительными реакциями.

Различных окислительно – восстановительных реакций.
Окислительно – восстановительные реакции
соединения
разложения
замещения
2Hg +2 O -2 t 2Hg 0 + O 2 0
восстановитель
окисляется
окислитель, восстанавливается
Это реакция разложения

Реакции соединения:
4Li 0 +O 2 0 2Li 2 +1 O -2
2Al 0 + 3S 0 t Al 2 +3 S 3 -2
C 0 + 2H 2 0 t C -4 H 4 +1

Реакции замещения:
Zn 0 + 2H +1 Cl Zn +2 Cl 2 + H 2 0
2CH 3 COOH + Mg 0 (CH 3 COO) 2 Mg + H 2 0
2CH 3 COO - + 2H + + Mg 0 2CH 3 COO - + Mg 2+ + H 2 0
Mg 0 + 2H + Mg 2+ + H 2 0

Химические реакции
соединения
разложения
Реакциями разложения Называются реакции, в результате которых из одного вещества образуются два или несколько других веществ.
Реакциями соединения называются реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество.
2Fe 0 +3Cl 2 0 2Fe +3 Cl 3 -1
2KCl +5 O 3 -2 t 2KCl -1 + 3O 2 0
C 2 H 2 + H 2 O катализатор уксусная кислота
2CH 4 t C 2 H 2 + 3H 2
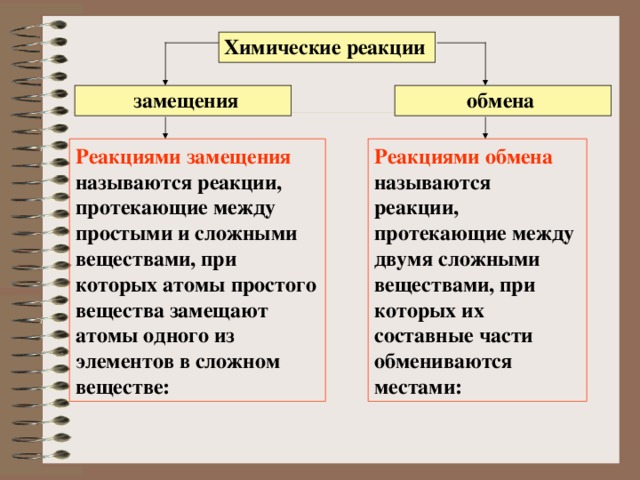
Химические реакции
обмена
замещения
Реакциями замещения называются реакции, протекающие между простыми и сложными веществами, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Реакциями обмена называются реакции, протекающие между двумя сложными веществами, при которых их составные части обмениваются местами:

Реакции замещения
2Ag +1 NO 3 + Fe 0 Fe 2+ (NO 3 ) 2 + 2Ag 0
CH 4 + Cl 2 свет CH 3 Cl + HCl
Реакции обмена
Fe 2 (SO 4 ) 3 + 3 BaCl 2 3BaSO 4 +2 FeCl 3
Ba 2+ + SO 4 2- BaSO 4
HCOON + NaOH HCOONa + H 2 O
H + + OH - H 2 O
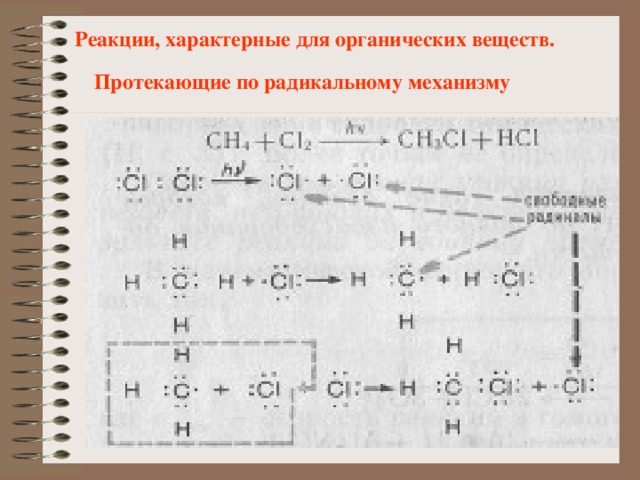
Реакции, характерные для органических веществ.
Протекающие по радикальному механизму
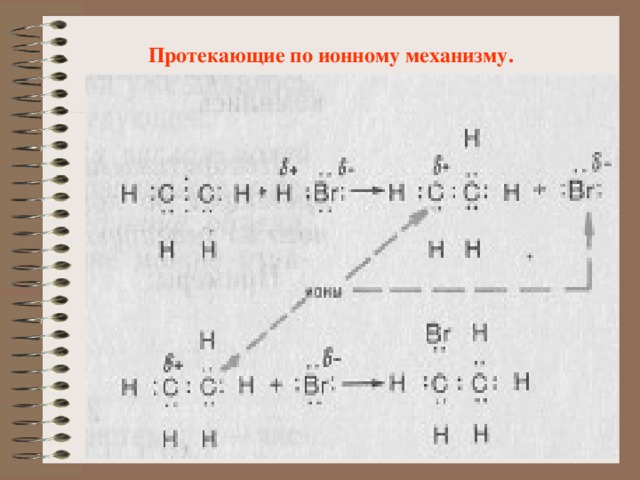
Протекающие по ионному механизму.

В неорганической химии некоторые реакции тоже
протекают по радикальному механизму.
Например взаимодействие хлора с водородом:

Химические реакции протекают с выделением теплоты, а
другие – с поглощением.
Количество теплоты, которое выделяется в результате реакции, называется тепловым эффектом данной химической реакции.
По тепловому эффекту реакции подразделяют на две группы: экзотермические и эндотермические.
Экзотермическими называются реакции, которые протекают с выделением теплоты.
H 2 + Cl 2 = 2HCl +184,6 кДж
Эндотермическими называются реакции, которые протекают с поглощением теплоты.
1/2N 2 + 1/2O 2 = NO – 90,4 кДж

На практике пользуются понятиями «теплота образования»
и «теплота сгорания».
Теплотой образования называется количество теплоты,
которое выделяется или поглощается при образовании одного
моля соединения из простых веществ.
Теплотой сгорания называется количество теплоты, которое
выделяется при сгорании одного моля вещества.
Химические уравнения, в которых указано количество теплоты,
выделяемое или поглощаемое при реакции, называются
термохимическими.

Необратимыми называются такие реакции, которые
протекают до конца, т.е. до полного израсходования
одного из реагирующих веществ.
2KCl +5 O 3 -2 t 2K -1 Cl + 3O 2 0
AlCl 3 + 3AgNO 3 3AgCl + Al(NO 3 ) 3
Al 3+ + 3Cl - + 3Ag + + 3NO 3 - 3AgCl + Al 3+ + 3NO 3 -
Ag + + Cl - AgCl

Химические реакции, протекающие при данных условиях
во взаимно противоположных направлениях,
называются обратимыми.
N 2 + 3H 2 2NH 3 + Q
N 2 + O 2 2NO - Q
O H 2 SO 4 , t O
CH 3 C + C 2 H 5 O H CH 3 C + H 2 O
OH O C 2 H 5


 Получите свидетельство
Получите свидетельство Вход
Вход



























 Классификация химических реакций (0.4 MB)
Классификация химических реакций (0.4 MB)
 0
0 1303
1303 60
60 Нравится
0
Нравится
0





