МКОУ Мараканская ООМШ
Методическая разработка урока
Химии в 8 классе на тему:
«Типы химических реакций».
Выполнила: учитель I категории
Унтерова Е.В.
Маракан 2014г.
МКОУ Мараканская ООМШ
Разработка урока по теме: «Типы химических реакций».
Девиз:Человеческий ум, «растянутый» новой идеей, никогда не сможет вернуться к своим прежним размерам. (Оливер УэндлиХоумз)
Цели урока:
Образовательная:
Закрепить и расширить знания учащихся о химических реакциях, их признаках и условиях протекания;
Научить выделять существенные признаки, которые могут быть положены в основу классификации химических реакций;
Рассмотреть классификацию химических реакций по числу и составу реагирующих и образующихся веществ;
Продолжить отрабатывать умение учащихся расставлять коэффициенты;
Развивающая :
развивать научное мышление обучающихся через установление причинно-следственных связей;
эксперимент и анализ эмпирических данных, умений анализировать результаты наблюдаемых опытов.
Воспитательные :
Задачи:
1) обобщить и систематизировать знания о типах химических реакций, закрепить умения составлять уравнения химических реакций и расставлять коэффициенты в уравнениях химических реакций.
2) сформировать комплекс общеучебных познавательных умений - логически мыслить, анализировать, сравнивать, обобщать, делать выводы, аргументировать и отстаивать свою точку зрения.
3)совершенствовать коммуникативные и организационные умения (правильное использование химической терминологии и символики, потребности вести диалог, выслушивать оппонента, способности открыто выражать и аргументированно отстаивать свою точку зрения).
Место урока в школьном курсе: урок изучается в разделе «Первоначальные химические понятия»
Планируемые результаты:
урок должен помочь обучающимся 8 класса сформировать следующие универсальные учебные действия:
1)Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, отстаивать свою точку зрения в процессе беседы, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни; оценивать жизненные ситуации и поступки с точки зрения общечеловеческих норм.
2)Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией.
3)Познавательные УУД: научиться выполнять творческие задания для самостоятельного получения и применения знаний; устанавливать причинно-следственные связи; выдвигать гипотезы и обосновывать их; формулировать проблемы.
4)Коммуникативные УУД: участвовать в диалоге на уроке и в жизненных ситуациях; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
Форма учебного процесса: классный урок.
Оборудование:компьютер, проектор, презентация «Типы химических реакций», на столах у учащихся незаконченный исследовательский кластер «Типы химических реакций», реактивы и оборудование для демонстрационного эксперимента и лабораторных опытов:Mg , колба с кислородом, железный гвоздь, раствор CuSO 4 , Zn , раствор SnCl 2 , CuO, HCl, малахит.
Хронометраж урока:
Организационный момент ……………………………… 1 мин.
Мотивация знаний ………………………………………..2 мин.
Актуализация опорных знаний ………………………… 3 мин
Изучение нового материала (физкультминутка)….….20 мин.
Систематизация знаний …………………………….…… 9 мин.
Рефлексия ………………………………………………….3 мин.
Подведение итогов урока.
Информация о домашнем задании …..………………….. 2 мин.
Тип урока:Изучение нового материала
Методы:Проблемный, частично-поисковый, личностно-ориентированный.
Форма организации: индивидуальная, фронтальная, работа в парах.
Ход урока:
Организационный момент:-Здравствуйте. Сегодня нам с вами предстоит совместная работа и я хочу, чтобы вы получили от нее удовлетворение. Для этого у вас есть все. У Вас есть глаза, чтобы увидеть мои записи, у Вас есть разум, чтобы их воспринять, у Вас есть смелость , чтобы последовать моим советам, у Вас есть Все, чтобы « подняться на вершину знаний»! Поэтому не будем стоять на месте, а будем двигаться только вперед! В качестве девиза сегодняшнего урока я предлагаю слова ОливэрУэндэлХоумза (Слайд № 1).
2.Мотивация. Все, что нас окружает, состоит из веществ. Кажется, они живут своей жизнью, таинственной, непостижимой. Взаимодействуя, они изменяют свой состав . И задача человека , изучив этот мир, постараться использовать полученные знания на благо.Сегодня, мы продолжим знакомство с удивительным , волшебным миром химических реакций.
Вашему вниманию предлагается кластер, отражающий различные характеристики химических реакций (Слайд №2).
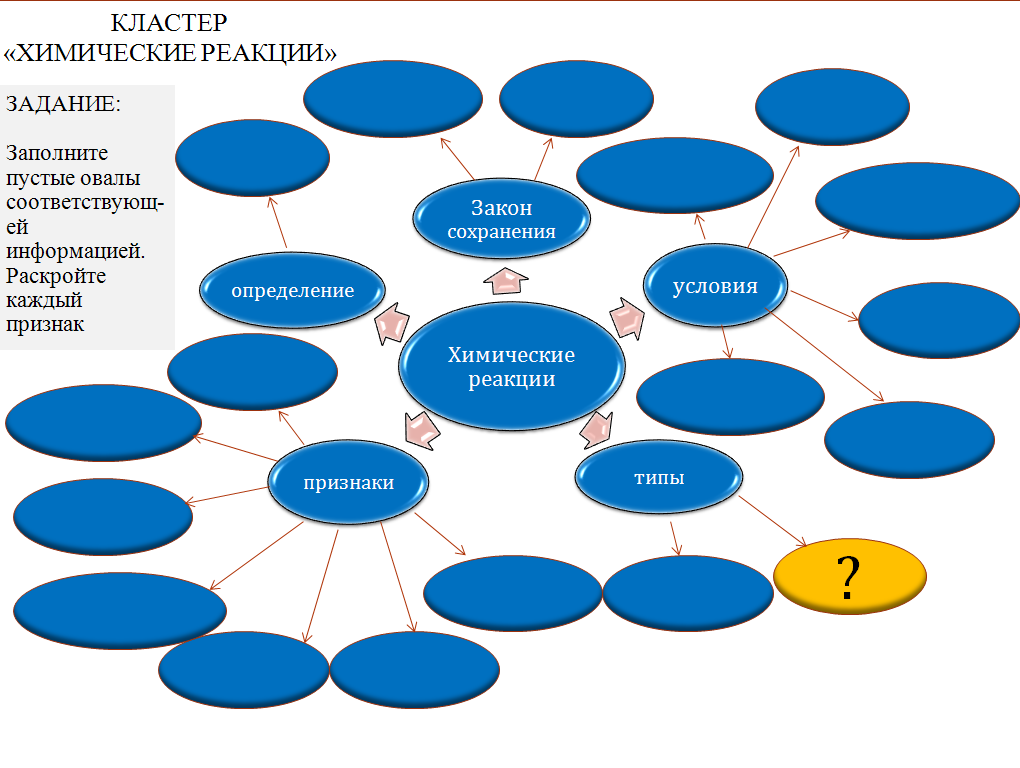 Кластер
Кластер
«Химические реакции»
Задание: Заполните пустые овалы
Соответствующей информацией. Раскройте каждый признак
3.Этап актуализации знаний.
Учащимся задаются вопросы , на основании которых заполняются свободные овалы кластера.
Что такое реакция?
Каковы признаки химических реакций?
Каковы условия возникновения химических реакций?
Как много химических реакций окружает нас в жизни?
Что может помочь нам в изучении многообразия химических реакций? (Классификация)
Что такое классификация? (Деление на группы)
Сравните свои результаты с кластером на слайде № 5.
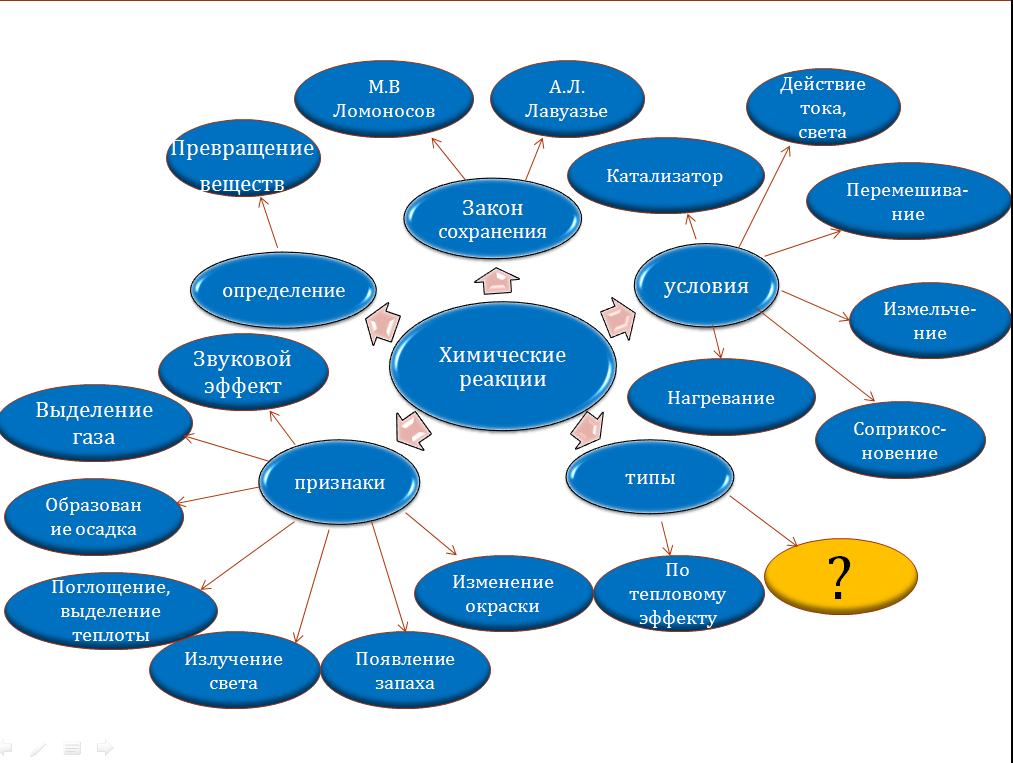
4. Этап изучение нового материала.
Учащиеся записывают тему урока в тетрадь.
На доске записаны уравнения химических реакций:
2Н2 +О2=2Н 2О
Са + Н 2О =Са (ОН)2
Си (ОН)2= Си О + Н 2О
2Нg О = 2 Hg + О2
Мы переходим с Вами к этапу выявления существенных признаков для определения химических реакций. Посмотрите на эти реакции.
Постановка проблемы.
Можно ли выделить признак по которому эти реакции,возможно, разделить на группы?
Различаются ли между собой реакции одной группы?
Учащиеся пытаются самостоятельно сделать вывод, что химические реакции отличаются друг от друга по числу и составу вступающих и образующихся веществ.
Проводится демонстрационный опыт, горение магния. Один из учащихся записывает уравнение реакции на доске:
2Мg + О2= 2 МgО
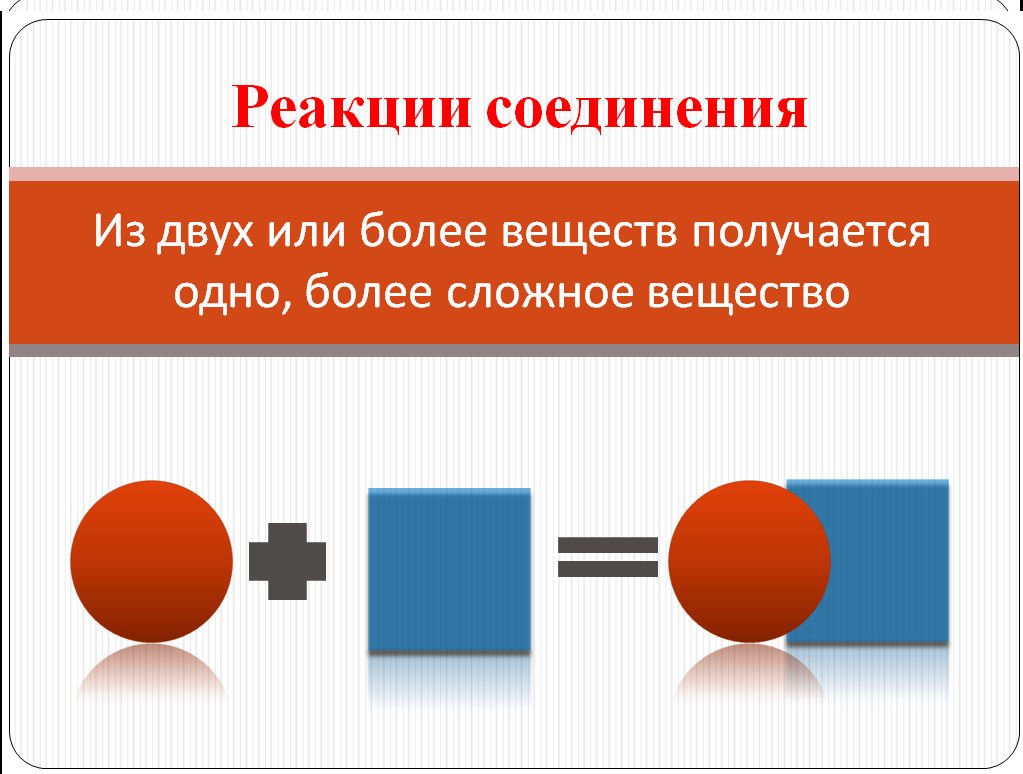
Вводится понятие реакции соединения.
Учащимся предлагается несколько уравнений химических реакций ( Слайд № 8).
Учащиеся приходят к выводу:
1). что идет процесс соединения веществ,но в 1-м и 2-м случае в реакцию вступают простые вещества, а в 3-ми 4-м – сложные.
2).Во всех этих реакциях образуется одно сложное вещество.
Эта работа выполняется в парах, результаты сверяются со слайдом №7.
Для того, чтобы продолжить классификацию химических реакций, Вам необходимо использовать инструктивную карточку, изучив которую выполняете опыт самостоятельно
(Карточка содержит не только последовательность выполнения опыта, но и правила по Т.Б.которые необходимо соблюдать при работе с химическими веществами).
Образец инструктивной карточки проведения опыта:
Железный гвоздь опустите в раствор Cu SO4 . Через 2 мин. Выньте гвоздь. Что наблюдаете? Кирпично-красный цвет налета на гвозде говорит о образовании чистой меди. Спрогнозируйте, что еще образовалось? Запишите уравнение данной реакции. Определите ее тип. Укажите признаки по которым вы определили, что произошла химическая реакция?

Fe + Cu SO4 = Fe S O 4 + Cи
Учащиеся называют признаки данной реакции.
Обращаю внимание учащихся на демонстрационный опыт:«Оловяный ежик»


Zn +Sn Cl 2=ZnCl2 + Sn
Спрогнозируйте, какие продукты реакции образовались?
Запишите уравнение реакции
Назовите признаки химической реакции
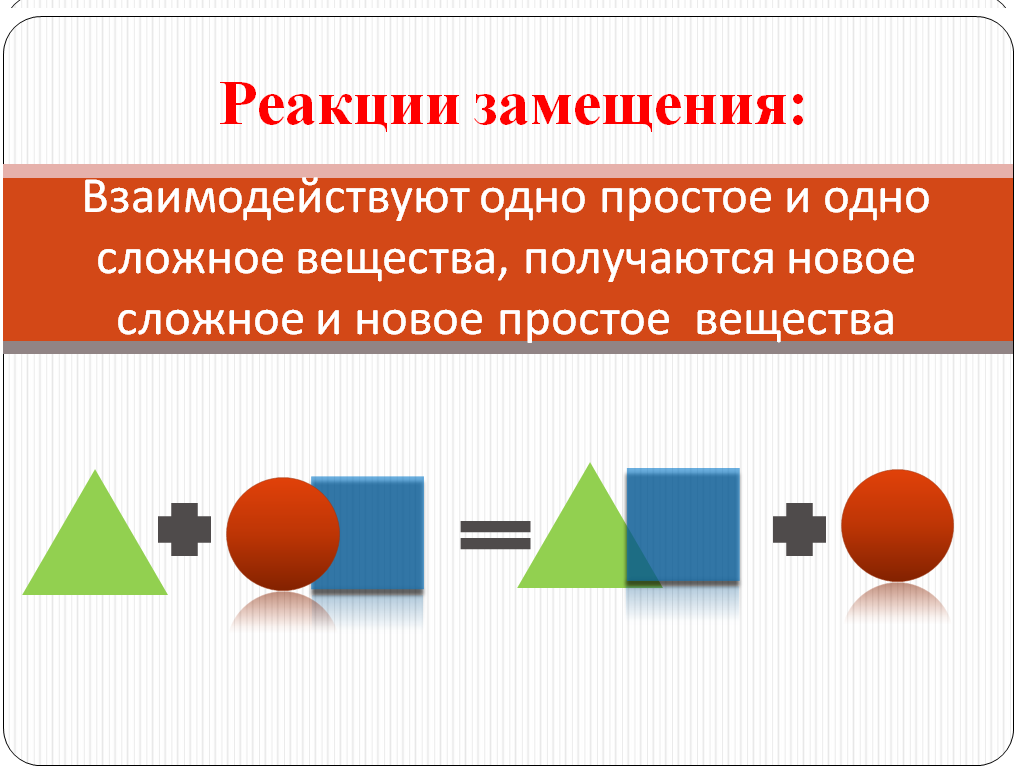
Сформулируем определение данного типа реакции , назовем тип
На этом примере, учащиеся отмечают, что в реакцию вступают простое и сложное вещество и атомы простого вещества ,замещают атомы одного из элементов в сложном веществе. Продукты реакции замещения – простое и сложное вещество. Называют признак данной реакции. Называют ее тип. Записывают определение. Используя геометрические фигуры составляют схему реакции замещения. Работают в парах. ( Этот опыт обычно готовлю заранее, цинковую гранулу –сплющиваю, делаю в ней отверстие,в которое продеваю нитьи подвешиваю в центре стакана с раствором Sn Сl2 ). Свой вариант схемы сравнивают со слайдом № 9.
Физминутка.
Если выделится газ-
Это раз;
И получится вода -
Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Для выявления следующего типа реакций, я предлагаю Вам провести лабораторный опыт. (Напоминаю учащимся правила по Т.Б. при работе с химическими веществами.)
На доске записаны исходные вещества:
Cu O + H Cl =
На Ваш взгляд, каков механизм образования продуктов реакции?
Возьмите геометрические фигуры и смоделируйте алгоритм взаимодействия веществ в данном типе реакции.
Попробуйте записать продукты реакции, используя химические формулы в тетради
Проведите взаимопроверку, прокомментируйте
Попытайтесь дать название данного типа реакций и сформулировать определение
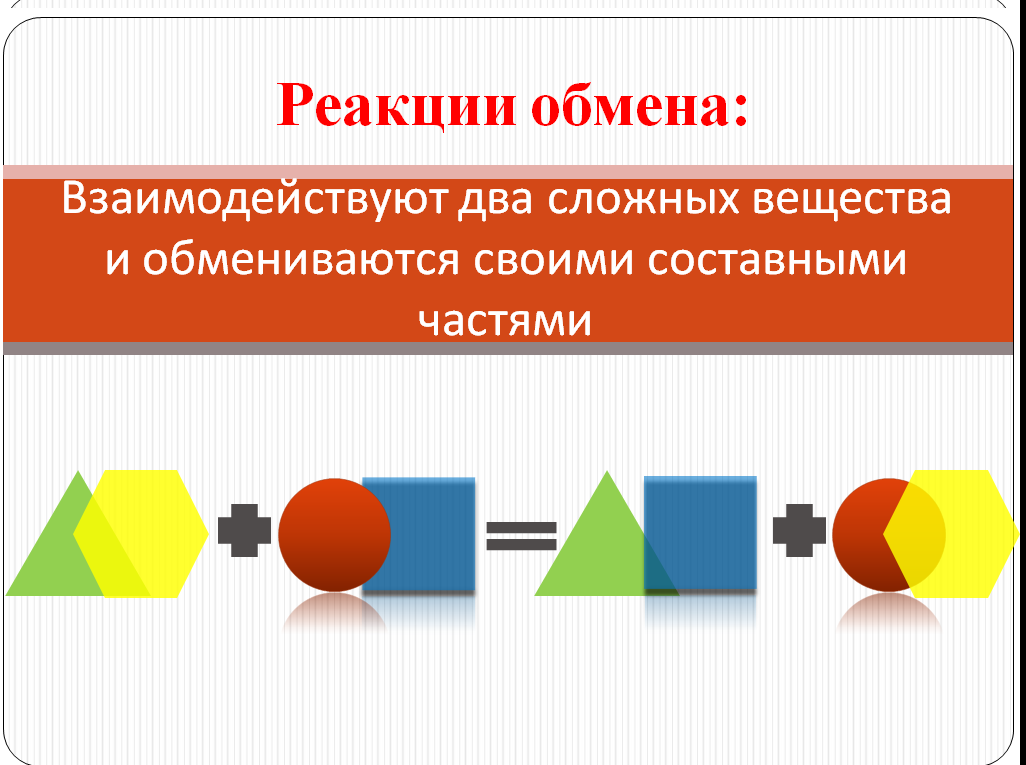
Учащиеся приходят к выводу:
1.что в реакцию вступали сложные вещества, которые в результате взаимодействия обменялись своими частями
2.В результате реакции тоже образовались сложные вещества
3.Данный тип реакций относится к реакциям обмена
Используя учебник, учащиеся сравнивают свой вариант определения с книжным, воспроизводят его в парах и записывают определение реакций обмена в тетрадь. Сравнивают схему с использованием геометрических фигур со слайдом №10.
Подведение итогов. Рефлексия
Релаксация. Закройте глаза и вспомните приятные моменты нашего урока. Я рада, что на протяжении всего урока вы были внимательны. Я хочу, чтобы все, кто работал хорошо – улыбнулись мне, а кто чувствует в себе потенциал работать ещё лучше – поаплодировали себе.
| Плюс (что понравилось на уроке) |
|
| Минус (что не понравилось, непонятно) |
|
| Интересно (любопытно, что ещё хотелось бы узнать) |
|
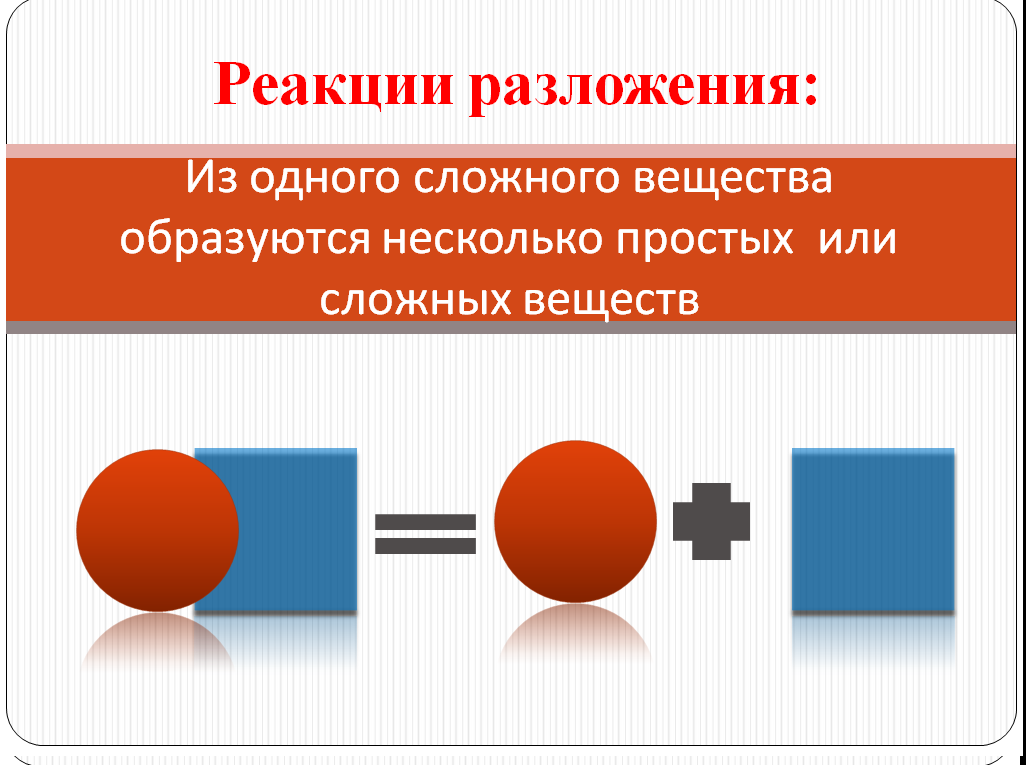
С последним типом реакции познакомимся при наблюдении демонстрационного опыта, разложение малахита:

 Cu 2C O 5H 2 =2 Cu O + C O2+ H 2O
Cu 2C O 5H 2 =2 Cu O + C O2+ H 2O
Малахит


2 H 2O = 2 H2+O2
Учащиеся предлагают свои варианты названия данного типа реакций, выделяя главные признаки: одно исходное вещество и несколько продуктов реакции, которые могут быть, как простыми, так и сложными. Записывают определение в тетрадь.Составляют схему реакции разложения. Сравнивают со слайдом № 11
.
5.Систематизация знаний.
Задание: Составить схему «Типы химических реакций». Дописать уравнения реакций, определить их тип.
Zn + 2HCl =
CuO + 2HCl =
C O2 + H2O = H 2C O3
HgO= Hg +
H2+ O2=
Ca C O 3= Ca O + C O
Mg + CuCl2=Cu+
Работа выполняется учащимися у доски, «по цепочке»,


Типы химических реакций
соединения разложения замещения обмена
2H2 + O2=2 H2O 2 HgO=2 Hg + O2Zn + 2HCl =ZnCl2 + H2CuO + 2HCl=CuCl2 +H2O
C O2 + H2O = H 2C O3 Ca C O 3= Ca O + C O 2Mg + Cu Cl 2=Mg Cl 2+ Cu
Вывод учителя: обобщаю всю информацию по изученному материалу
6.Рефлексия:
Учащиеся выполняют самостоятельную работу на 2 варианта

Учащиеся проводят взаимопроверку, ответы сравнивают на слайде №12.Каждое правильное задание оценивается в 2 балла

«Подведение итогов.
Релаксация. Закройте глаза и вспомните приятные моменты нашего урока. Я рада, что на протяжении всего урока вы были внимательны. Я хочу, чтобы все, кто работал хорошо – улыбнулись мне, а кто чувствует в себе потенциал работать ещё лучше – поаплодировали себе.
| Плюс (что понравилось на уроке) |
|
| Минус (что не понравилось, непонятно) |
|
| Интересно (любопытно, что ещё хотелось бы узнать) |
|
Подвожу итог по результатам самостоятельной работы. Благодарю всех за работу.
Учащиеся записывают домашнее задание.

 Получите свидетельство
Получите свидетельство Вход
Вход


 Кластер
Кластер








 Cu 2C O 5H 2 =2 Cu O + C O2+ H 2O
Cu 2C O 5H 2 =2 Cu O + C O2+ H 2O













 Урок химии "Типы химических реакций" (0.94 MB)
Урок химии "Типы химических реакций" (0.94 MB)
 1
1 2297
2297 170
170 Нравится
0
Нравится
0








