МОУ Приволжская основная школа
Учитель химии: Пронина Л.В.


Цель урока :
Изучить химические свойства кислот в свете ТЭД. Совершенствовать умения учащихся в составлении молекулярных и ионных уравнений химических реакций.

Взаимодействие с металлами
Zn+2HCl=ZnCl2+H 2
ЗАПОМНИТЕ: металл должен находиться в ряду напряжения металлов до водорода

Взаимодействие кислот с оксидами металлов
Кислота + оксид металла→ соль + вода
(реакция обмена)
С uO + H 2 SO 4 → CuSO 4 + H 2 O
SiO 2 + H 2 SO 4 → не идет

Взаимодействие кислот с основаниями
Кислота + основание → соль + вода
(реакция нейтрализации), (реакция обмена)
HCl + NaOH → NaCl + H 2 O
H 2 SO 4 + Cu(OH) 2 → Cu SO 4 + 2H 2 O
ЗАПОМНИТЕ: реакция между основанием и кислотой называется реакцией нейтрализации (записываем ионно-молекулярное уравнение реакции)

Взаимодействие кислот с солями
Кислота + соль → новая кислота + новая соль
(Если образуется осадок или газ) (реакция обмена)
H 2 SO 4 + Na 2 CO 3 → Na 2 SO 4 + H 2 O + CO 2 ↑
H 2 SO 4 + BaCI 2 →BaSO 4 +2HCI
H 2 SO 4 +NaCI → не идет
ЗАПОМНИТЕ: реакция между солью и кислотой протекает в случае, когда выпадает осадок или выделяется газ (записываем ионно-молекулярные уравнения реакций)

Можно ли кислоту превратить в воду?
И если можно, то, каким образом?
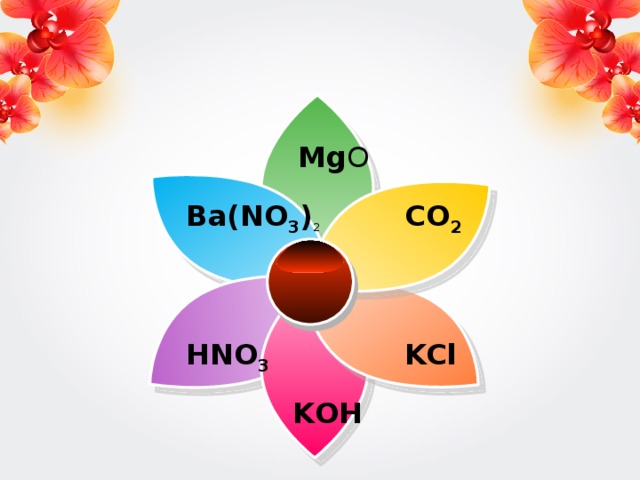
Mg O
Ba ( NO 3 ) 2
CO 2
HNO 3
KCl
K OH

Домашнее задание
Параграф 39, выполнить письменно №4,5

 Получите свидетельство
Получите свидетельство Вход
Вход













 Кислоты в свете теории электролитической диссоциации (883.5 KB)
Кислоты в свете теории электролитической диссоциации (883.5 KB)
 0
0 829
829 29
29 Нравится
0
Нравится
0