
МБОУ «Гимназия № 8 » Энгельсского муниципального района Саратовской области
Учебно-исследовательский проект
Электрический ток в электролитах
Работу выполнил
Баженов Георгий обучающийся 9 «А» класса
Руководители:Екимова Л.П. - учитель химии
Сурьянинова Т.В. – учитель физики
2017г

Цель исследования: выяснение природы электрического тока в жидких проводниках и рассмотрение его применения на практике. Поставленная цель потребовала решения ряда взаимосвязанных задач: • изучение механизма электрического тока в жидких проводниках; • рассмотрение открытия явления электролиза; • ознакомление с краткими биографиями ученых, участвующих в исследовании этого процесса; • сравнение первых гальванических элементов с современными батарейками ведущих фирм мира; • сравнение батареек ведущих фирм мира между собой; • изучение применения электролиза (тяжёлая вода, получение металлов, гальваническое производство); • проведение экспериментов с использованием процесса электролиза.
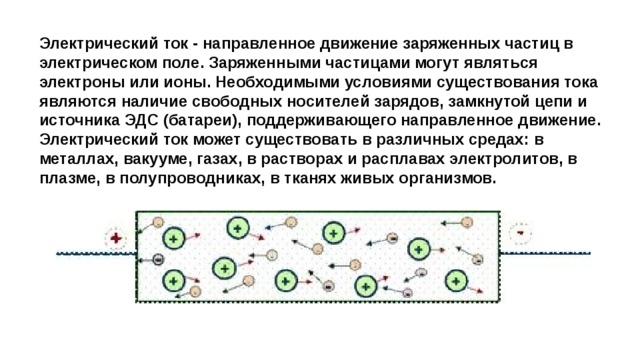
Электрический ток - направленное движение заряженных частиц в электрическом поле. Заряженными частицами могут являться электроны или ионы. Необходимыми условиями существования тока являются наличие свободных носителей зарядов, замкнутой цепи и источника ЭДС (батареи), поддерживающего направленное движение. Электрический ток может существовать в различных средах: в металлах, вакууме, газах, в растворах и расплавах электролитов, в плазме, в полупроводниках, в тканях живых организмов.

Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решетках твердых электролитов. К электролитам относятся расплавы солей, оксидов или гидроксидов, а также растворы солей, кислот или щелочей.
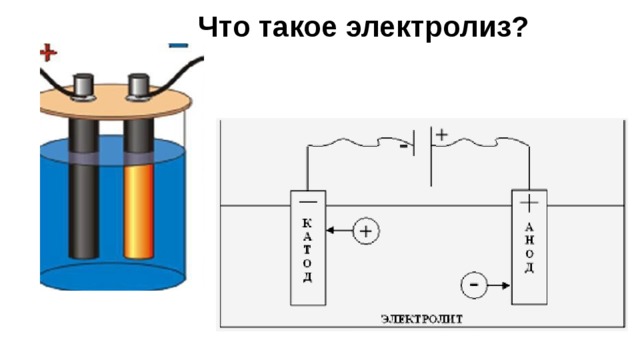
Что такое электролиз?
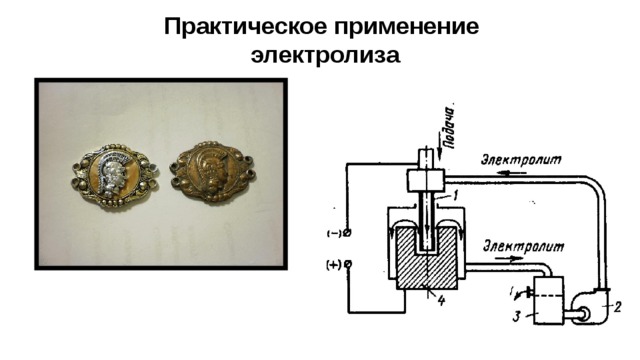
Практическое применение электролиза


Проводимость электрического тока в электролитах

Электролиз раствора CuSO 4 с инертными электродами
Катод (-)
Анод (+)
Cu 2+ +2e→Cu 0
2H 2 O -4e→4OH - +O 2 ↑
H +
SO 4 2-
2CuSO 4 + 2 H 2 O = 2Cu 0 + O 2 ↑ + 2Н 2 SO 4

Электролиз раствора CuSO 4 с активным латунным анодом
Катод (-)
Сu 2+ +2e→Cu 0
Анод (+)
Cu 0 -2e→Cu 2+

Электролиз раствора иодида калия
на инертных электродах
Катод (-)
Анод (+)
K +
OH -
2H + +2e→H 2 ↑
2I - -2e→I 2 0
2КI + 2H2O = H 2 ↑ + I 2 0 + 2KOH

Гальванопластика

Электролиз раствора FeSO 4 с активным железным анодом. Fe – активный анод, в качестве электролита – водный раствор FeSO 4 FeSO 4 = Fe 2+ + SO 4 2- Итог: на катоде: Fe 2+ +2ē → Fe на аноде: Fe − 2ē → Fe 2+
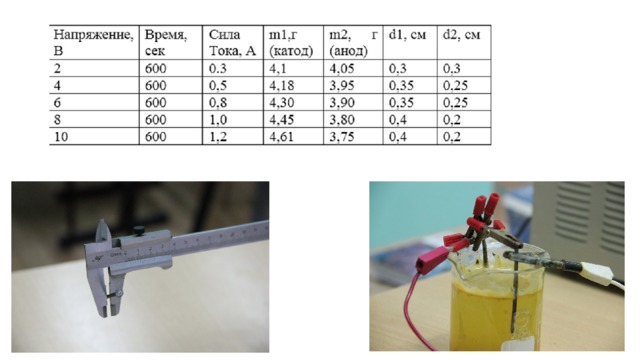
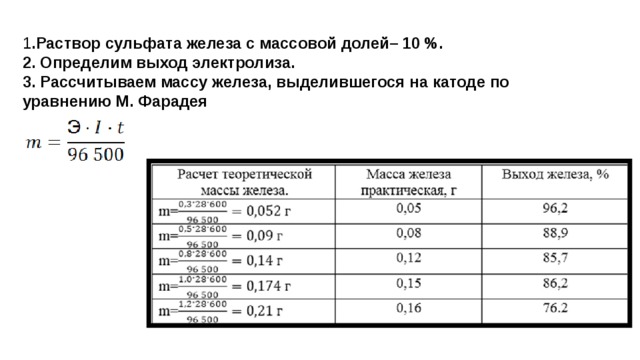
1 .Раствор сульфата железа с массовой долей– 10 %. 2. Определим выход электролиза. 3. Рассчитываем массу железа, выделившегося на катоде по уравнению М. Фарадея
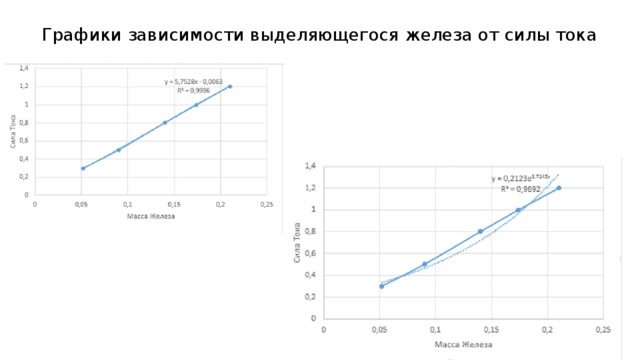
Графики зависимости выделяющегося железа от силы тока

Выводы
- Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов.
- Преимущества электролиза перед химическим методами получения целевых продуктов заключаются в возможности сравнительно просто управлять скоростью и направленностью реакций.

Литература
- Браун Т., .Лемей Г.Ю. Химия в центре наук -2, - Мир Москва.1997 г - Волович П.М., Бровко М.И. Готовимся к экзамену по химии - Айрис-пресс; 2006 г - Егоров А.С. Репетитор по химии - Издательство: Феникс 2002 г. - Третьяков К.А. Методические указания к лабораторным работам по химии - Свердл. инж.-пед.ин-т. Екатеринбург, 1995 г - Мухленов И.П., Авербух А.Я. и др. Важнейшие химические производства - «Высшая школа», г. Москва. 1990 г

Спасибо за внимание!

 Получите свидетельство
Получите свидетельство Вход
Вход











 Электролиз в растворах (12.97 MB)
Электролиз в растворах (12.97 MB)
 0
0 1309
1309 13
13 Нравится
0
Нравится
0


