"Электролиз растворов электролитов"
Цели и задачи урока:
формирование и закрепление знаний учащихся по теме «Сущность процессов электролиза и его применение» (без употребления понятия «стандартный электродный потенциал», что является предметом углубленного изучения химии);
развитие умений решать расчетные задачи, выступать с докладами по заданной теме;
закрепление навыков работы с мультимедийными средствами обучения (компьютерные программы – «Виртуальная лаборатория» и тестирование: по правилам техники безопасности и итоговое).
Оборудование:
мультимедийные средства обучения:
– компьютер: учебно-электронное издание «Виртуальная лаборатория» (тестирование, опыты 1 и 2), презентация урока в программе Microsoft PowerPoint (Приложение 1);
– демонстрация опыта 4 на DVD-диске сборника Современной Гуманитарной Академии «Химия и электрический ток»;
оборудование для проведения демонстрационного опыта 3;
таблицы: «Схема электролиза раствора хлорида меди (II)», «Электрохимическое получение натрия», «Электрохимическое получение алюминия», «Электролитическое получение водорода, хлора и гидроксида натрия», «Применение электролиза (никелирование)».
План урока
Сообщение цели и задач урока. Мотивация учебной деятельности.
Выявление, актуализация и корректировка опорных знаний:
Формирование новых знаний:
- опыт 1 Электролиз раствора хлорида меди (II) CuCl2
- опыт 2 Электролиз раствора сульфата меди (II) CuSO4
- опыт 3 Электролиз раствора иодида калия KI
- опыт 4 Электролиз раствора сульфата натрия Na2SO4
Ход урока
1. Сообщение цели и задач урока. Мотивация учебной деятельности.
2. Выявление, актуализация и корректировка опорных знаний.
а) – проверка д/з – схема электролиза расплава сульфида магния (на доске), определение процесса электролиза;
б) – решение расчетной задачи № 24 с.112 (учебник Л. С. Гузей, Р. П. Суровцева «Химия. 10 класс») МГУ97:
При пропускании постоянного электрического тока силой 6,4 А в течение 30 мин через расплав хлорида неизвестного металла на катоде выделилось 1,07 г металла. Определить состав соли, которую подвергли электролизу.
Решение:
Cогласно закону Фарадея: m = M I τ / nF , следовательно, M/ n = m F/ I τ, время τ = 30 мин или 0,5 ч, постоянная Фарадея F = 26,8 А∙ч/моль. M/ n = 1,07 г ∙ 26,8 А∙ч/моль / 6,4 А ∙ 0,5 ч = 9 г/моль, т.е. числовое значение М в 9 раз больше n.
Выписываем возможные значения n и М:
М = 9 г/моль соответствует бериллию Ве, но для него n = 2, а не 1, т.е. Ве не удовлетворяет условию. М = 27 г/моль и n = 3 соответствует алюминию Al.
Ответ: состав соли AlCl3.
3. Формирование новых знаний:
Для усиления мотивации изучения данной темы, демонстрации практического значения химии в жизни человека и применения полученных в школе знаний в нестандартных ситуациях зачитывается отрывок из произведения американского фантаста Гарри Гаррисона «Космический врач». Сюжет данного произведения: с космическим кораблем произошла авария, из офицерского состава в живых остался врач Дональд Чейз, к которому переходит командование кораблем. Дональду приходится решать множество проблем, одна из которых - нехватка кислорода на борту, т.к. многие его производители – зеленые одноклеточные водоросли – погибли. «…Где взять кислород в глубине межпланетного пространства? Думай! Он вбивал все это в свой утомленный мозг, но там была лишь полная пустота. И, тем не менее, его терзала мысль, что ответ находится прямо перед глазами. Единственной вещью, находящейся перед ним, были водоросли в их водяной купели. Они делали все, что могли, он знал это, и, тем не менее, ответ где-то здесь. Но где?..» [1] Ответ на этот вопрос учащиеся смогут дать после изучения опыта 4.
А – тест на проверку знаний т/б
Б – проблемный демонстрационный химический эксперимент выступает не как средство иллюстрации готовых знаний, а как источник знаний и способ создания проблемной ситуации.
1) Электролиз раствора хлорида меди (II).
Демонстрационный эксперимент проводится с помощью УЭИ «Виртуальная лаборатория». Признаки реакции: выделение красной металлической меди на катоде и хлора (газа, вызывающего обесцвечивание влажной лакмусовой бумаги) на аноде.
Задание: сравните электролиз расплава и раствора хлорида меди (II), есть ли разница в продуктах? Самостоятельно составьте схему электролиза раствора данной соли.
Схема процесса:

Вывод: электролиз раствора данной соли практически не отличается от электролиза ее расплава.
2) Электролиз раствора сульфата меди (II).
Демонстрационный эксперимент проводится с помощью УЭИ «Виртуальная лаборатория».
Признаки реакции: выделение красной металлической меди на катоде и кислорода (газа, вызывающего загорание тлеющей лучины) на аноде.
Задание: сравните состав хлорида и сульфата меди (II), найдите принципиальную разницу и сделайте вывод, от чего зависит состав продуктов окисления на аноде.
Ответ: разница в составе анионов кислотных остатков: хлорид-анион Cl - простой, а сульфат-анион SO42- сложный.
Учитель сообщает, что выделяющийся на аноде кислород выделяется не из сульфат-анионов, а образуется при окислении молекул воды.
Схема процесса:

Для подбора коэффициентов используем метод электронно-ионного баланса:
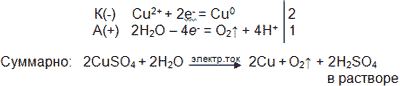
Вывод: последовательность разрядки анионов на аноде зависит от природы аниона:
При электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде окисляются анионы кислотных остатков, например: 2Cl - - 2e - = Cl20↑
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления молекул воды: 2H2O – 4e - = O2↑ + 4H + (среда околоанодного пространства кислая). Анионы кислотных остатков таких кислот остаются в растворе вместе с образующимися ионами водорода H +, т.е. после электролиза получается раствор кислоты.
При электролизе растворов щелочей окисляются гидроксид-ионы: 4OH - - 4e - = O2↑ + 2H2O
Анионы по их способности окисляться располагаются в следующем порядке:

Анодные процессы в водных растворах электролитов
| Кислотный остаток (анион) Аm- |
| Бескислородный
(Cl -, Br -, I -, S 2- и др., кроме F -) | Кислородсодержащий
(SO42-, NO3-, CO32- и др.) и F - |
| Окисление аниона (кроме фторида)
Аm- - me- = А0 | В кислой и нейтральной среде – окисление молекул воды: 2H2O – 4e- = O2↑ + 4H+
в щелочной среде: 4OH- - 4e- = O2↑ + 2H2O |
Задание на закрепление:
Какие вещества будут образовываться на электродах при пропускании постоянного электрического тока через раствор нитрата серебра AgNO3? (серебро на катоде и кислород на аноде). Раствор какого вещества останется в электролизере после окончания реакции? (раствор азотной кислоты HNO3) На дом: составить схему данного процесса.
3) Электролиз раствора иодида калия KI.
Демонстрационный процесс проводит учитель (в околокатодное пространство добавить 2-3 капли спиртового раствора фенолфталеина).
Признаки реакции: выделение газа на катоде и окрашивание околокатодного раствора в малиновый цвет; выделение молекулярного йода коричневой окраски на аноде.
Задание: сравнить электролиз растворов хлорида меди и иодида калия. Катодными или анодными процессами они отличаются? Почему во втором случае невозможно выделение металлического калия? Подсказка – в положении меди и калия в ряду активности металлов (вернее, в электрохимическом ряду напряжений металлов).
При затруднении ответа учитель напоминает, что калий – активный металл, реагирующий с водой с выделением водорода и образованием щелочи, а ведь раствор иодида калия содержит, помимо соли, и воду...
Схема процесса:

Вывод: последовательность разрядки катионов на катоде зависит от положения металла в электрохимическом ряду напряжений:
Если металл неактивен и расположен после водорода, то на катоде восстанавливаются ионы металлов: Men+ + ne- = Me0
Если металл обладает высокой химической активностью и расположен в начале ряда, от лития до алюминия включительно, то на катоде восстанавливаются молекулы воды:
2H2O + 2e- = Н2↑ + 2ОН- (среда околокатодного пространства щелочная). Катионы таких металлов остаются в растворе вместе с образующимися гидроксид-анионами ОН-, т. е. после электролиза получается раствор щелочи.
Если металл обладает средней химической активностью и расположен в ряду напряжений между алюминием и водородом, то будут происходить оба процесса (в зависимости от концентрации соли, рН среды, плотности тока и других факторов): и восстановление ионов металла, и восстановление молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе растворов кислот на катоде восстанавливаются катионы водорода: H+ + 2e- = Н2↑
Катодные процессы в водных растворах электролитов
| Электрохимический ряд напряжений металлов |
| Li, K, Ba, Ca, Na, Mg, Al | Mn, Zn, Cr, Fe, Cd, Co, Ni | НH2 | Cu, Hg, Ag, Pt, Au |
| Восстановление молекул воды:
2H2O + 2e- = Н2↑ + 2ОН- | Оба процесса:
1) Men+ + ne- = Me0
2) 2H2O + 2e- = Н2↑ + 2ОН- |
| Восстановление катиона:
Men+ + ne- = Me0 |
Задание на закрепление:
Какие вещества будут образовываться на электродах при пропускании постоянного электрического тока через раствор хлорида натрия NaCl? (водород на катоде и хлор на аноде). Раствор какого вещества останется в электролизере после окончания реакции? (раствор щелочи NaOH) – правильность ответа проверяем с использованием таблицы «Электрохимическое получение водорода, хлора и гидроксида натрия. На дом: составить схему данного процесса.
4) Электролиз раствора сульфата натрия Na2SO4.
Эксперимент демонстрируется с помощью DVD-диска сборника Современной Гуманитарной Академии «Химия и электрический ток» (в раствор соли добавлен раствор лакмуса). Признаки реакции: на катоде – выделение газа и окрашивание лакмуса в синий цвет; на аноде – выделение газа и окрашивание лакмуса в красный цвет.
Учащиеся самостоятельно объясняют результаты эксперимента, исходя из выводов опытов 2 и 3 (см. таблицы по анодным и катодным процессам).
При определении среды раствора можно воспользоваться мнемоническим стихотворением:
Индикатор лакмус – красный, кислоту укажет ясно,
Индикатор лакмус – синий, щелочь здесь – не будь разиней.
Схема процесса:
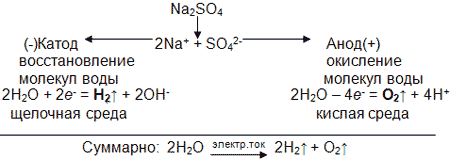
Вывод: электролиз данной соли сводится к разложению воды; соль необходима для увеличения электропроводности, так как чистая вода является очень слабым электролитом; масса самой соли в растворе не изменяется.
Учащиеся дают ответ на вопрос, поставленный перед изучением темы: где взять кислород на борту космического корабля? Ответ – получить его электролизом воды, в которую добавлена нужная соль. (Приложение 3);
Применение электролиза (доклад учащегося):
Электрометаллургия:
получение активных металлов (K, Na, Ca, Mg, Al и др.) электролизом расплавов природных соединений;
получение металлов средней активности (Zn, Cd, Co) электролизом растворов их солей.
В химической промышленности – получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водорода H2O2, тяжелой воды D2O и др.
Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов. Неочищенная медь, которая является анодом, растворяется, т. е. переходит в раствор соли меди в виде ионов. Энергия электрического тока расходуется на перенос этих ионов к катоду, их восстановление и осаждение чистой меди (степень чистоты – 99,95%). Примеси (Ag, Au и другие благородные металлы), которые имеют больший стандартный электродный потенциал, не восстанавливаются, а выпадают в осадок на дне ванны, тем самым окупая расходы на проведение рафинирования меди. Данный процесс – одно их старейших электрохимических производств. Впервые этот метод был применен в России в 1847 г.
Гальваностегия – нанесение металлических покрытий на поверхность металлического изделия для защиты от коррозии или придания декоративного вида. Например, оцинковка, хромирование, никелирование и пр.
Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.
Ответы к тесту: 1а, 2в, 3г, 4а, 5б, 6г, 7 – вагб, 8 – отрицательным, катода
Подведение итогов урока, сообщение домашнего задания. Домашнее задание записывалось учащимися в ходе урока;
Итоговое тестирование:
Расплав какого вещества подвержен электролизу?
а) оксид кальция; б) парафин; в) глюкоза; г) азот.
Что следует подвергнуть электролизу для получения хлора?
а) хлорную воду; б) раствор хлората калия; в) расплав хлорида калия; г) хлор электролизом не получают.
Цвет лакмуса в околокатодном пространстве при электролизе раствора бромида натрия
а) малиновый; б) фиолетовый; в) красный; г) синий.
Какое вещество нельзя получить при электролизе раствора поваренной соли?
а) Na; б) H2; в) Cl2; г) NaOH;
При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется
а) Zn; б) O2; в) H2; г) SO2.
При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить
а) выделение NO2; б) выделение меди; в) выделение O2; г) растворение анода.
Расставьте анионы в порядке уменьшения их восстановительной активности. Ответ запишите в виде последовательности букв.
а) Cl-; б) F-; в) I- г) OH-.
Вставьте в предложение пропущенные слова: «При никелировании предмет, на который наносят слой никеля, надо соединять с ... полюсом батареи, чтобы он выступал в качестве ... ».
6

 Получите свидетельство
Получите свидетельство Вход
Вход

















 Урок химии "Электролиз расплавов и растворов электролитов" (58.16 КB)
Урок химии "Электролиз расплавов и растворов электролитов" (58.16 КB)
 1
1 1425
1425 218
218 Нравится
0
Нравится
0


