
Электролитическая диссоциация
урок химии в 8 классе
учитель химии Метелёва Ирина Евгеньевна
г. Комсомольск-на-Амуре
2019 г.

Сванте-Август Аррениус
Автор теории электролитической диссоциации. Лауреат Нобелевской премии
Родился 19 февраля 1859 года в старинном шведском городе Упсале.
В гимназии он был одним из лучших учеников, особенно легко ему давалось изучение физики и математики. В 1876 году юноша был принят в Упсальский университет. И уже через два года (на шесть месяцев раньше срока) он сдал экзамен на степень кандидата философии.
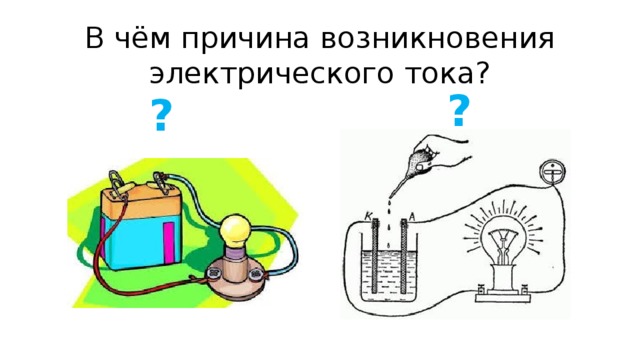
В чём причина возникновения электрического тока?
?
?

Причина возникновения электрического тока
- направленное движение электронов
- образование заряженных частиц в растворе или расплаве электролита

Все ли вещества проводят электрический ток?
электролиты
неэлектролиты
- все растворимые соли
- щёлочи
- растворимые кислоты
- нерастворимые соли, кислоты,
основания
- оксиды
- вещества с ковалентной неполярной связью (газы)
- большинство органических веществ

Все ли вещества проводят электрический ток?
электролиты
неэлектролиты
- NaCl (раствор)
- NaOH(раствор)
- Н 2 SO 4 (раствор)
- СuSO 4 (раствор)
- CH 3 COOH (раствор; столовый уксус 9%)
- Н 2 О (прот.)
- сахар (раствор)
- Н 2 О (дист.)
- NaCl (крист.)
- сахар (крист.)
- C 2 H 5 OH (этиловый спирт)
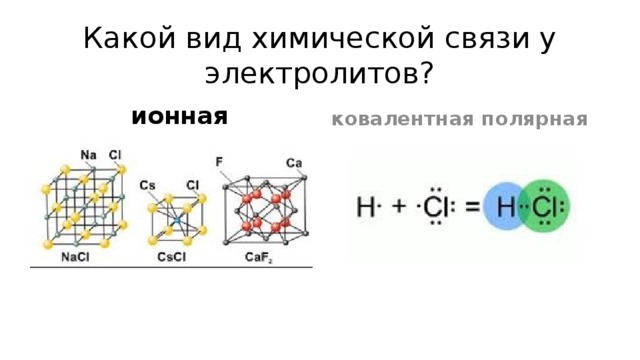
Какой вид химической связи у электролитов?
ионная
ковалентная полярная
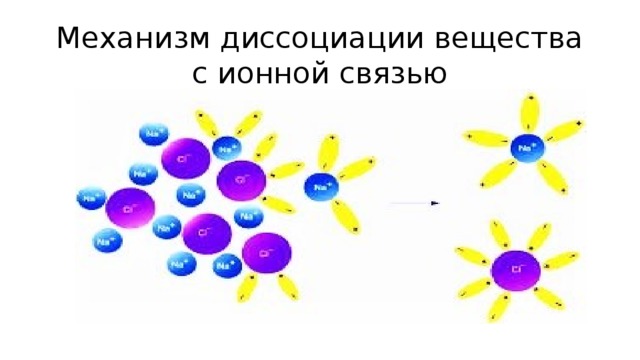
Механизм диссоциации вещества с ионной связью
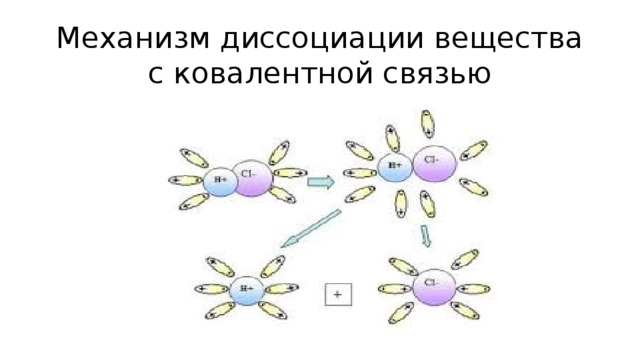
Механизм диссоциации вещества с ковалентной связью
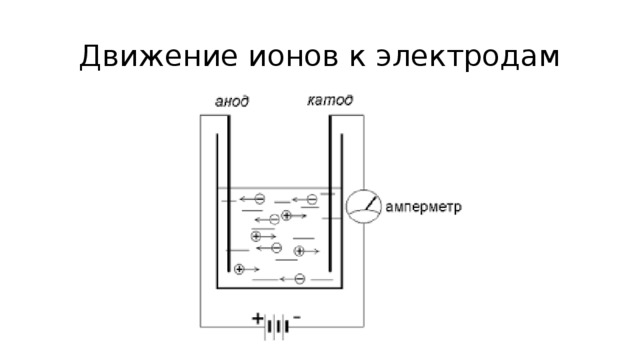
Движение ионов к электродам
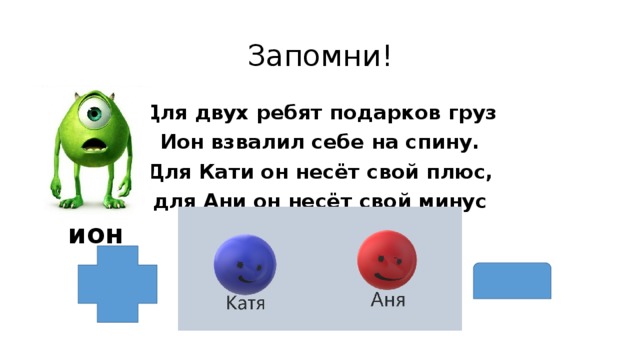
Запомни!
Для двух ребят подарков груз
Ион взвалил себе на спину.
Для Кати он несёт свой плюс,
для Ани он несёт свой минус
ион

Электролитическая диссоциация
- процесс распада электролита на ионы при растворении или расплавлении

Степень диссоциации
-это отношение числа частиц, распавшихся на ионы (N д ), к общему числу растворенных частиц (N P ):
α=N д /N P

В зависимости от степени диссоциации электролиты делят на
сильные электролиты
слабые электролиты
1.Практически все соли;
1.H 2 O
2.Сильные кислоты(HCl, HNO 3 ,H 2 SO 4 и др.);
2.Слабые кислоты (H 2 S, HNO 2 , H 2 CO 3 и др.);
3.Все щелочи (KOH, NaOH,
3.Водный раствор аммиака
Ca(OH) 2 и др.)
NH 3 *H 2 O

Запишите уравнение диссоциации
Допишите уравнения диссоциации
Допишите возможные реакции
- NaCl =
- HCl=
- NaOH=
- CuSO 4 =
- H 2 SO 4 =
- FeCl 3 =
- Al 2 (SO 4 ) 3 =
- Ba(OH) 2=
- H 2 SiO 3=
- BaSO 4=
- H 2 S=
- Fe(OH) 2 =

что мы сегодня узнали?
- 1. Какие вещества называются электролитами? Приведите примеры.
- 2. Почему эти вещества проводят электрический ток?
- 3. Какие вещества называются неэлектролитами? Приведите примеры.
- 4. Что понимают под электролитической диссоциацией?
- 5. Что показывает степень диссоциации?
- 6. Как классифицируют электролиты по степени диссоциации?

Запишите домашнее задание и выберите смайлик
Распределите вещества в 2 столбика (I- электролиты, II-неэлектролиты)
Жидкий аммиак, раствор хлорида кальция, серная кислота, нитрат калия, гидроксид калия, ацетон, фосфат кальция, бензол, раствор сахара, азотная кислота, карбонат кальция, иодоводород
Спасибо ребята за урок !

 Получите свидетельство
Получите свидетельство Вход
Вход











 Электролитическая диссоциация (607.4 KB)
Электролитическая диссоциация (607.4 KB)
 0
0 646
646 24
24 Нравится
0
Нравится
0


