
Задания по соединениям азота
11 класс
Кривцова С.В.
Учитель химии МАОУ «Лицей № 6»
Г. Миасс

Задание 28
- Рассчитайте массу осадка, образующегося при взаимодействии раствора, содержащего 41,6 г хлорида бария, с раствором, содержащим 20,52 г сульфата алюминия. Выход реакции составил 99.2%.

Задание 29
- Из предложенного перечня выберите кислоту и вещество, между которыми протекает окислительно-восстановительная реакция с образованием газа. В ходе этой реакции в процессе восстановления участвует один электрон (в пересчете на один атом окислителя). Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Перечень веществ: серная кислота, иодоводород, ацетат бария, нитрит калия, хлорид натрия, гидроксид железа (III). Допустимо использование водных растворов.

Задание 30
- Нитрат натрия, нитрит натрия, перманганат натрия, азотная кислота, гидроксид бария. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.

Задание 31
- Над поверхностью налитого в колбу раствора едкого натра пропускали электрические разряды, при этом воздух в колбе окрасился в бурый цвет, который исчезал через некоторое время. Полученный раствор осторожно выпарили и установили, что твёрдый остаток представляет собой смесь двух солей. При нагревании этой смеси выделяется газ и остается единственное вещество. Напишите уравнения описанных реакций.
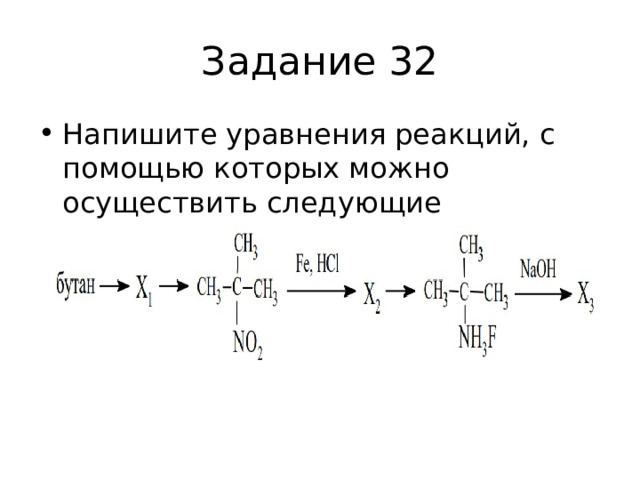
Задание 32
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

Задание 33
- Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11 г натриевой соли этой кислоты.

Задание 34
- Смесь аммиака и углекислого газа объёмом 11,2 л (н.у.) полностью поглотили водой, объём которой 100 мл, при этом образовалась средняя соль. К полученному раствору добавили раствор хлорида железа(II). При этомобразовалось 214 г раствора с массовой долей единственного растворённого вещества 10%. Вычислите массовую долю хлорида железа(II) в добавленном растворе.
- Процессами гидролиза пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).

Ответы
29) 2KNO 2 + 4HI = 2KI + I 2 + 2NO + 2H 2 O
2I −1 – 2𝑒̅= I 2 0 1
N +3 + 1𝑒̅= N +2 2
KNO2 (N +3 ) – окислитель, HI (I −1 ) – восстановитель.
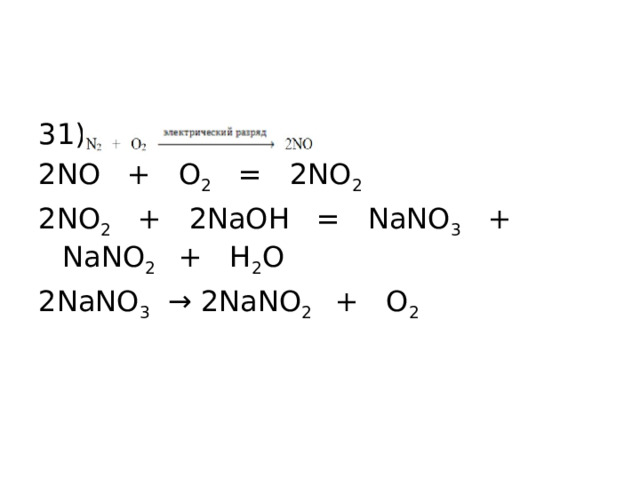
31)
2NO + O 2 = 2NO 2
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
2NaNO 3 → 2NaNO 2 + O 2
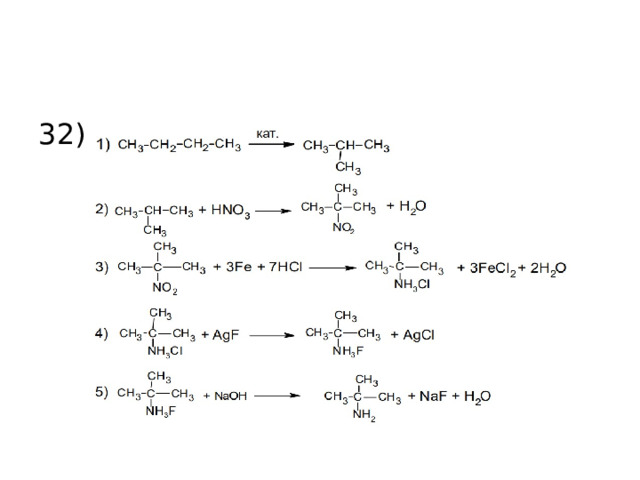
32)

33) Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что .Можно это сделать математически, если принять, что .
Это аланин — аминопропановая кислота.
Ответ:

- 34) Записаны уравнения реакций: 2NH 3 + H 2 O + CO 2 = (NH 4 ) 2 CO 3 (NH 4 ) 2 CO 3 + FeCl 2 = 2NH 4 Cl + FeCO 3 2NH 3 + 2H 2 O + FeCl 2 = 2NH 4 Cl + Fe(OH) 2
- Рассчитаны количество вещества реагентов и массы продуктов реакций: n(NH 3 ) + n(CO 2 ) = 11,2 : 22,4 = 0,5 моль m(NH 4 Cl) = 214 ∙ 0,1 = 21,4 г n(NH 4 Cl) = 21,4 / 53,5 = 0,4 моль n(NH 3 ) = n(NH 4 Cl) = 0,4 моль m(NH 3 ) = 0,4 ∙ 17 = 6,8 г n(CO 2 ) = 0,5 – 0,4 = 0,1 моль m(CO 2 ) = 0,1 ∙ 44 = 4,4 г
- n(FeCl 2 ) = 0,5n(NH 4 Cl) = 0,2 моль m(FeCl 2 ) = 0,2 ∙ 127 = 25,4 г n(FeCO 3 ) = n(CO 2 ) = 0,1 моль m(FeCO 3 ) = 0,1 ∙ 116 = 11,6 г n(Fe(OH) 2 ) = 0,1 моль m(Fe(OH) 2 ) = 0,1 ∙ 90 = 9 г
- m(р-ра FeCl 2 ) = 214 – 100 – 6,8 – 4,4 + 11,6 + 9 = 123,4 г ω(FeCl 2 ) = 25,4 : 123,4 ∙ 100 = 20,6%

 Получите свидетельство
Получите свидетельство Вход
Вход











 Задания по соединениям азота (174.91 KB)
Задания по соединениям азота (174.91 KB)
 0
0 228
228 0
0 Нравится
0
Нравится
0


