Азот. Фосфор.
I вариант
1. Азот проявляет положительную степень окисления в соединениях:
а) N2; б) NH4Cl;
в) KNO3.
2. Какое вещество называется "бурый газ"
а) NH3 , б) NO2,
в) NO.
3. В реакции N2+3H2 ↔ 2NH3 окислителем является:
а) NH3; б) H2;
в) N2.
4. Кристаллическая решётка азота:
а) молекулярная; б) атомная;
в) ионная.
5. Окислительные свойства сильнее выражены у:
а) N; б) C;
в) P.
6. Между атомами в молекуле азота существует:
а) двойная связь;
б) тройная связь;
в) одинарная связь;
г) пять химических связей.
7. Летучее водородное соединение азота имеет формулу:
a) NH2;
б) N2H4;
в) NH3;
г) NО2.
8. Вещество Mg3N2 называют:
а) нитрат магния;
б) нитрит магния;
в) сульфат магния;
г) нитрид магния.
9. Аммиак в лаборатории получают по реакции:
а) NH4Cl + Ca(OH)2 = ... ;
б) N2 + 3H2 = ... ;
в) Са3(PO4)2 + (NH4)2SO4 = ... ;
г) (NH4)3РO4 + HCl = ... .
10. Аммиак может реагировать с соляной кислотой по реакции NH3 + HCl = NH4Cl. Четвертый атом водорода присоединяется по донорно-акцепторному механизму, при этом донором является:
а) водород;
б) хлор;
в) азот;
г) группа NH4.
11. Нашатырный спирт – это:
а) NH3;
б) NH3•H2O;
в) NH4Сl;
г) N2H4.
12. Соль NH3NO3 называется:
а) нитрат аммония;
б) фосфат аммония;
в) нитрит аммония;
г) дигидрофосфат аммония.
13. Высшая валентность фосфора равна:
а) 5;
б) 6;
в) 2;
г) 3.
14. Заряд ядра равен +15 в атоме:
а) кислорода;
б) азота;
в) фосфора;
г) серы.
15. 15 электронов, 15 протонов, 16 нейтронов содержит атом:
а) Zn;
б) N;
в) Са;
г) Р.
16. При взаимодействии концентрированной азотной кислоты с серебром помимо соли и воды выделяется газ:
а) NO2;
б) NO;
в) N2;
г) N2О.
17. Вещество Са3Р2 называется:
а) фосфат кальция;
б) фторид кальция;
в) фосфид кальция;
г) фосфин.
18. Вторая ступень диссоциации фосфорной кислоты выражается уравнением:
а) H3PO4 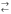 H + + H2PO4- ;
H + + H2PO4- ;
б) H2PO4- 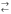 H + + HPO42 - ;
H + + HPO42 - ;
в) HPO42 -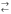 H + + PO43- ;
H + + PO43- ;
г) H3PO4 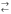 3H + + PO43- .
3H + + PO43- .
19. Какая из приведенных ниже реакций не протекает?
а) Р2О5 + КОН = ... ;
б) H3PO4 + Na2SO4 = ... ;
в) К3PO4 + AgNO3 = ... ;
г) Na3PO4 + H2SO4 (конц.) = ... .
20. В реакцию вступило 1,7 г аммиака и, было получено 5 г соли. Массовая доля выхода хлорида аммония составляет:
а) 8 %;
б) 73,5 %;
в) 89 %;
г) 93%
Азот. Фосфор
II вариант
1.Фосфор проявляет отрицательную степень окисления в соединениях:
а) P2O5; б) Ca3P2;
в) Na3PO4. г) Н3РО4
2. Какой вид фосфора отвечает формуле P4
а) белый, б) красный,
в) чёрный г) зеленый
3. В реакции 4P+5O2 2P2O5 восстановителем является:
а) P2O5; б) O2;
в) P. г) О5
4. Кристаллическая решётка белого фосфора:
а) ионная; б) атомная;
в) молекулярная. г) металлическая
5. Восстановительные свойства сильнее выражены у:
а) Cl; б) P;
в) N. г) С
6. Атом фосфора имеет конфигурацию:
а) 1s22s22p63s23p3;
б) 1s22s22p5;
в) 1s22s22p63s23p64s2;
г) 1s22s22p63s23p5.
7. Азот достаточно инертен по отношению к металлам, но сравнительно легко протекает следующая реакция:
а) Cu + N2 = ... ;
б) Zn + N2 = ... ;
в) Al + N2 = ... ;
г) Li + N2 = ... .
8. В какой реакции азот проявляет восстановительные свойства?
а) 3 Mg + N2 = Mg3N2 ;
б) N2 + O2 = 2 NO ;
в) N2 + 3H2 = 2NH3 ;
г) 6Li + N2 = 2Li3N
9. Сколько свободных электронных пар имеет азот в молекуле аммиака?
а) 2;
б) 4;
в) 1;
г) 3.
10. Выберите ряд веществ, соответствующий нарастанию молекулярных масс:
а) озон, аммиак, кислород;
б) аммиак, кислород, озон;
в) кислород, аммиак, озон;
г) кислород, озон, аммиак.
11. В аммиаке и катионе аммония степень окисления азота одинаковая: –3. Какие валентности у атомов азота в этих соединениях?
а) Обе – III;
б) обе – IV;
в) III и II;
г) III и IV.
12. Для какой реакции повышение давления сместит равновесие вправо?
а) N2 (г.) + О2 (г.) = 2NO (г.);
б) Н2 (г.) + S (ж.) = Н2S (г.);
в) N2 (г.) + 3Н2 (г.) = 2NН3 (г.);
г) Н2 + Сl2 = 2НCl.
13. В лаборатории азотную кислоту получают по реакции:
а) NO2 + H2O = ;
б) NaNO3 + H2SO4 = ;
в) Na3PO4 + HCl = ;
г) NO + H2O = .
14. При термическом разложении нитрата калия выделяется газ:
а) N2;
б) NO2;
в) О2;
г) N2О.
15. Чтобы получить белый фосфор нужно:
а) нагреть красный фосфор без доступа кислорода;
б) охладить красный фосфор;
в) нагреть черный фосфор без доступа кислорода;
г) растворить красный фосфор в воде.
16. При каком условии протекает реакция
P2O5 + 3H2O = 2H3PO4?
а) Нагревание;
б) охлаждение;
в) измельчение Р2О5;
г) в присутствии катализатора.
17. Формула аммиачной селитры:
а) КNO3;
б) (NH4)3PO4;
в) NH4NO3;
г) (NH4)2SO4.
18. Первая ступень диссоциации фосфорной кислоты выражается уравнением:
а) H3PO4 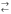 H + + H2PO4- ;
H + + H2PO4- ;
б) H2PO4- 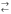 H + + HPO42 - ;
H + + HPO42 - ;
в) HPO42 -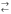 H + + PO43- ;
H + + PO43- ;
г) H3PO4 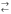 3H + + PO43- .
3H + + PO43- .
19. Какая из приведенных ниже реакций не протекает?
а) H3PO4 + KCl = ... ;
б) P2O5 + H2O =
в) К3PO4 + AgNO3 = ... ;
г) Na3PO4 + H2SO4 (конц.) = ... .
20.Из азота массой 5,6 г получили 5 кг аммиака. Выход аммиака от теоретически возможного:
а) 8 %;
б) 73,5 %;
в) 89 %;
г) 93 %.
Азот. Фосфор
III вариант
1.Среди перечисленных веществ неметаллические свойства наиболее сильно выражены у:
а) сурьмы;
б) мышьяка;
в) азота;
г) фосфора.
2. Схема строения внешнего энергетического уровня атома элемента …ns2np3.Формулы водородного соединения и высшего оксида этого элемента:
а) H2R и RO3;
б) RH2 и RO;
в) RH4 и RO2;
г) RH3 и R2O5;
3. Кислотные свойства оксидов типа R2O5 с ростом порядкового номера элемента:
а) усиливаются;
б) ослабевают;
в) усиливаются, затем ослабевают;
г) остаются неизменными.
4. Выделите из перечисленных свойств азота верные:
а) наличие тройной связи в молекуле и ее малая длина;
б) газ без цвета, запаха и вкуса; реагирует с водородом в присутствии катализатора при высоком давлении и температуре, проявляя окислительные свойства;
в) хорошо растворим в воде;
г) высокая температура кипения.
5. Реакция, в которой азот восстановитель:
а) N2 + H2 →
б) N2 + Li →
в) N2 + O2 →
г) N2 + Mg →
6. Азот встречается в природе преимущественно в виде соединения:
а) Mg3N2 ; б) NH3;
в) KNO2; г) KNO3;
7. Диоксид азота может взаимодействовать с:
а) раствором хлорида натрия;
б) кислородом;
в) соляной кислотой;
г) гидроксидом кальция.
8. Выделите утверждения, которые характеризуют строение молекулы аммиака и химические связи в ней:
а) водородная связь;
б) форма молекулы пирамидальная;
в) связи ковалентные полярные;
г) валентный угол связи H—N —Н равен 106 0.
9. Механизм образования химической связи в ионе аммония:
а) обменный, ковалентная связь;
б) донорно-акцепторный, ковалентная связь;
в) ионный;
г) радикальный.
10. Ион, являющийся реактивом на катион аммония:
а) сульфат – ион;
б) хлорид – ион;
в) гидроксид – ион;
г) карбонат – ион.
11. Концентрированная азотная кислота пассивирует на холоду металлы:
а) марганец; б) цинк;
в) хром; г) железо.
12. «Царская водка» - это смесь:
а) 1 объёма HNO3 и 1 объёма HCl;
б) 1 объёма HNO3 и 2 объёмов HCl
в) 1 объёма HNO3 и 3 объёмов HCl
г) 3 объёмов HNO3 и 1 объёма HCl
13. В уравнении реакции I2 + HNO3 ( конц.) → HIO3 + NO2 ↑ + H2O коэффициент перед формулой окислителя равен:
а) 2; б) 4;
в) 9; г) 10.
14.Азотную кислоту в лаборатории можно получить из нитрата натрия:
а) посредством электролиза;
б) при взаимодействии с концентрированной серной кислотой;
в) посредством окисления;
г) посредством восстановления.
15. Фосфор в природе встречается главным образом в виде:
а) фосфата кальция;
б) фосфорной кислоты;
в) в свободном виде;
г) оксидов.
16. Схема получения фосфина:
а) P + H2 →
б) Mg3P2 + H2→
в) Ca3P2 + 6 HCl →
г) Ca3P2 + 6 H2O →
17. Похож на графит, жирный на ощупь, атомная кристаллическая решетка, устойчив, - приведены свойства … фосфора:
а) белого;
б) красного;
в) черного;
г) фиолетового.
18. Проявляя все свойства кислотного оксида, фосфорный ангидрид P2O5 реагирует с:
а) H2O;
б) NaOH;
в) CO2;
г) CaO.
19. Вещества, реагирующие с ортофосфорной кислотой:
а) оксид кальция;
б) карбонат натрия;
в) аммиак;
г) нитрат серебра.
20. Через 420 г 15%-ного раствора азотной кислоты пропустили 22,4 л (н.у.) аммиака. Получили раствор, массовая доля соли в котором равна:
а) 19 %;
б) 19,7 %;
в) 17,5 %;
г) 18,3 %
Азот. Фосфор
IV вариант
1. По электронной конфигурации валентного уровня определите, у какого атома окислительная способность выше
а) … 4s2 3d104p3;
б) … 3s23p3;
в) … 2s22p3;
г) … 4 d105s25p3.
2. Укажите общие формулы высшего оксида и гидроксида элемента, электронная конфигурация внешнего энергетического уровня которого …2s22p3
а) R2O5 и H3RO4;
б) R2O3 и HRO2;
в) R2O5 и HRO3;
г) RO2 и H2RO3
3. Молекула азота химически инертна при обычных условиях, так как:
а) образована тремя ковалентными связями: одна σ - связь и две π - связи;
б) форма молекулы пирамидальная;
в) не способна к образованию водородных связей;
г) высокая энергия связи = 940 кДж/моль.
4. С увеличением заряда ядра атома полярность и прочность связи в водородных соединениях элементов V А группы:
а) возрастает;
б) уменьшается;
в) уменьшается, затем возрастает;
г) не изменяется.
5. Вещество, с которым может реагировать азот при комнатной температуре:
а) H2O; б) O2;
в) Ca; г) Li.
6. В процессе превращения по схеме: N20 → 2 N+ 2 азот:
а) восстановитель;
б) отдает электроны, окисляется;
в) принимает электроны, восстанавливается;
г) окислитель.
7. Молекула аммиака имеет форму
а) изогнутую;
б) линейную;
в) плоскую;
г) пирамидальную.
8. Оксид азота (IV) может взаимодействовать с:
а) раствором хлорида натрия;
б) кислородом и водой;
в) соляной кислотой;
г) гидроксидом кальция
9. Характеристики строения и химической связи в ионе аммония:
а) валентность атома азота равна IV;
б) степень окисления азота равна – 4;
в) степень окисления азота равна – 3;
г) одна из связей N – Н образована по донорно-акцепторному механизму.
10.Соли аммония разлагаются при нагревании, если:
а) образованы летучей кислотой;
б) образованы нелетучей кислотой;
в) анион проявляет окислительные свойства;
г) анион проявляет восстановительные свойства.
11. Концентрированная азотная кислота пассивирует на холоду металлы:
а) железо; б) медь;
в) алюминий; г) магний.
12. Вещества, с которыми аммиак проявляет свойства оснований:
а) серная кислота;
б) оксид меди;
в) кислород;
г) вода.
13. В уравнении реакции: S + HNO3 ( конц.) → H2SO4 + NO2 ↑ + H2O, коэффициент перед формулой окислителя равен:
а) 2; б) 4;
в) 5; г) 6.
14. Ортофосфорную кислоту в лаборатории можно получить:
а) окислением фосфора раствором 30 % - ной HNO3
б) при взаимодействии измельченного ортофосфата кальция при нагревании с гидроксидом натрия;
в) при взаимодействии P4O10 с водой;
г) при взаимодействии измельченного ортофосфата кальция при нагревании с серной кислотой;
15. Степень окисления фосфора, в которой его соединения наиболее устойчивы:
а) – 3; б) + 3;
в) +5; г) все устойчивы.
16. Схема, в которой фосфор является окислителем:
а) 3O2 + 4 P →
б) P4 + 6H2O + 3O2→
в) 3Cl2 + 2P→
г) 2P + 3 Mg →
17. Молекулярная кристаллическая решетка, на воздухе окисляется, светится в темноте, ядовит, - приведены свойства … фосфора.
а) белого;
б) черного;
в) красного;
г) фиолетового.
18. Вещество, с которым фосфористый ангидрид P2O3 проявляет восстановительные свойства:
а) Н2О; б) КОН;
в) СаО; г) О2.
19. Вещества, реагирующие с ортофосфорной кислотой:
а) калий;
б) карбонат калия;
в) гидроксид натрия;
г) нитрат серебра.
20. При каталитическом окислении аммиака объемом 560 л был получен оксид азота () объемом 448 л. Массовая доля выхода продукта реакции от теоретически возможного составляет:
а) 80 %;
б) 75 %;
в) 90 %;
г) 96,5 %
![]()
![]()
![]()
![]()

 Получите свидетельство
Получите свидетельство Вход
Вход


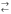 H + + H2PO4- ;
H + + H2PO4- ;








 Тест по химии "Азот. Фосфор" (36.49 КB)
Тест по химии "Азот. Фосфор" (36.49 КB)
 2
2 10122
10122 925
925



спасибо